Статья опубликована в рамках: XXIX Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 10 марта 2015 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИЗУЧЕНИЕ ГУМОРАЛЬНОГО ЗВЕНА СПЕЦИФИЧЕСКОГО ИМУНИТЕТА ПРИ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ РАССЕЯННОГО СКЛЕРОЗА — АЛЛЕРГИЧЕСКОГО ЭНЦЕФАЛОМИЕЛИТА
Милихина Наталья Владимировна
магистрант 2 курса, кафедра биохимии СамГУ, РФ, г. Самара
E-mail:
Макурина Ольга Николаевна
научный руководитель, д-р биол. наук, профессор СамГУ, РФ, г. Самара
Рассеянный склероз (РС) — хроническое заболевание центральной нервной системы (ЦНС), которым в мире страдают более 1 млн. человек, относят к категории аутоиммунных. Этиология РС остается неясной. Более всего вероятна его многофакторная (комплексная) природа — воздействие внешних факторов на индивиды с наследственной предрасположенностью. Основную роль в патогенезе РС играет сочетание хронического воспалительного и нейродегенеративного процессов, в генезе которых существенную роль играют аутоиммунные процессы [2].
Хотя ведущим аутоиммунным механизмом при РС является Т-клеточный иммунитет, в развитии заболевания участвует и В-система (гуморальный иммунитет) [6]. Одним из проявлений активации гуморального иммунитета при РС является повышенный синтез в ткани мозга и спиномозговой жидкости иммуноглобулинов, обычно Ig G [3].
Важную роль в понимании иммунопатогенеза демиелинизирующих заболеваний нервной системы, в том числе РС, внесла разработка экспериментальных моделей, в частности экспериментального аллергического энцефаломиелита. Экспериментальный аллергический энцефаломиелит (ЭАЭ) признается в настоящее время достаточно адекватной моделью РС, поствакцинальных энцефаломиелитов, острого диссеминированного энцефаломиелита и некоторых других аутоиммунных демиелинизирующих заболеваний человека, так как клинические, морфологические, иммунологические и биохимические проявления указанных заболеваний имеют принципиальное сходство с экспериментальной моделью. Использование данной модели позволяет значительно расширить и усугубить исследование вопросов патогенеза, клиники и рациональной терапии таких заболеваний [4].
Исследования проводили на взрослых кроликах-самцах породы шиншилла массой 2,5—3,0 кг, у которых вызывали ЭАЭ путем однократной внутрикожной инокуляции в подушечки лап 1 мл (по 0,25 мл в каждую лапу) энцефалитогенной эмульсии, содержащей 20 мг лиофилизированного миелина спинного мозга кроликов, 0,2 мл физиологического раствора и 0,8 мл полного стимулятора Фрейнда (100 мг сухих, убитых нагреванием M.tuberculosis, 15 г ланолина и 15 г вазелинового масла).
Первые симптомы появились после 10—12 дневного латентного периода: ухудшалось общее состояние и аппетит, начиналась снижаться масса тела, а к концу второй недели появились первые неврологические симптомы, которые в дальнейшем прогрессировали, достигая максимума на 23—27 день. При этом наблюдались двигательные нарушения (атаксия, мышечная слабость, парезы и параличи конечностей), а также расстройство функций тазовых органов (непроизвольная дефекация и мочеиспускание).
В нашей работе мы определяли содержание иммуноглобулинов трех основных классов — IgM, IgG, IgA, уровень циркулирующих иммунных комплексов (ЦИК) и титр комплемента.
Определение активности системы комплемента основано на феномене лизиса эритроцитов в присутствии антиэритроцитарных антител и комплемента. Для определения активности комплемента в исследуемую сыворотку вводят гемолитическую тест-систему, состоящую из эритроцитов барана и гемолитической сыворотки (сыворотка, полученная от животного, иммунизированного бараньими эритроцитами, и содержащая антиэритроцитарные антитела). Комплемент исследуемой сыворотки, связываясь с комплексом антиген-антитело (в данном случае эритроциты — гемолизины), вызывает гемолиз.
Активность комплемента выражают в гемолитических единицах. За одну 50 % гемолитическую единицу комплемента (CH50) принимают такое его количество, которое вызывает гемолиз 50 % 0,5 мл стандартной суспензии сенсибилизированных эритроцитов при 37 °С за 45 мин. Эта единица условная, величина ее зависит от концентрации бараньих эритроцитов, количества антител, использованных для сенсибилизации, величины рН, ионной силы системы. В связи с тем, что присоединение к иммунному комплексу первого компонента комплемента не происходит в отсутствие Ca2+, а для присоединения 4-го компонента (следующего за активацией C1) необходимо наличие Mg2+, важно строго соблюдать концентрацию этих веществ в буферных растворах. Необходимо стандартизировать время реакции, температуру [5].
Определение иммуноглобулинов в сыворотке крови проводили твердофазным методом, который проводится на принципе «сэндвича». На первой стадии калибровочные пробы с известной концентрацией IgA, M, G и исследуемые образцы инкубируются в лунках стрипированного планшета и иммобилизированными моноклональными антителами (МКАТ) к Ig. Затем планшет отмывается. На второй стадии связавшийся в лунках Ig обрабатывают конъюгатом МКАТ к Ig с пероксидазой (конъюгат МКАТ и иммобилизированные в лунках планшета МКАТ специфичны к разным участкам молекулы Ig). После отмывания избытка конъюгата образовавшиеся иммунные комплексы «иммобилизированные МКАТ — Ig — конъюгат» выявляют ферментативной реакцией пероксидазы с перекисью водорода в присутствии хромогена (тетраметилбензидина). Интенсивность окраски хромогена пропорциональна концентрации Ig в анализируемом образце. После постановки пероксидазной реакции стоп-реагентом результаты учитываются фотометрически. Концентрацию Ig в пробах определяют по калибровочному графику [4].
Определение уровня циркулирующих иммунных комплексов в сыворотке основано на принципе связывания антигена с антителом с образованием иммунного комплекса. Циркулирующие иммунные комплексы (ЦИК) способны присоединять компоненты комплемента и образовывать комплекс антиген-антитело-комплемент, который оседает в тканях, сосудистой стенке, вызывая повреждения различной степени тяжести вследствие активации системы комплемента. Большая группа заболеваний патогенетически тесно связана с образованием и персистенцией ЦИК. В связи с этим уровень ЦИК в сыворотке крови является одним из диагностических показателей активости и степени тяжести иммунопатологического процесса.
Принцип метода определения ЦИК основан на изменении величины светового рассеяния раствора полиэтиленгликоля в следствии осаждения им ЦИК из сыворотки крови.
Прогресс в изучении механизмов формирования патологического процесса демиелинизирующих заболеваниях достигнут, главным образом, в ходе иммунологических исследований. Основой для этого послужили достижения теоретической иммунологии. При столкновении организма с патогеном в иммунной системе запускается процесс клональной селекции, когда стимулируются клоны, несущие соответствующие рецепторы. Этот механизм объясняет громадный приспособительный потенциал иммунной системы. В ходе иммунных реакций Т- и В-клетки взаимодействуют. В-клетки могут захватывать антигены своими рецепторами и презентировать его на своей поверхности. В этом виде антиген узнается антигенспецифическими рецепторами соответствующих клеток Т-хелперов, которые побуждают В-клетки к росту и дальнейшим генетическим модификациям. Результатом этих процессов является синтез специфических антител. Антитела связывают и нейтрализуют патоген в экстрацеллюлярном пространстве, делают его возможным для поглощения фагоцитами и активируют комплементарный каскад. Повреждение олигодендроцитов и миелина, вызванное антителами, реализуется посредством нескольких механизмов, характерных для гуморального ответа, направленного на элиминацию любых чужеродных клеток и макромолекул. Первый механизм заключается в простом связывании антител с антигенами. Другой механизм — реализуется при связывании Fc-фрагмента иммуноглобулинов с Fc-рецептором на макрофагах и микроглии с образованием комплекса IgGFc-рецептор, что значительно увеличивает скорость рецептор- опосредованного фагоцитоза миелина. Третий механизм связан с активацией системы комплемента иммуноглобулинами класса М и большинством подклассов иммуноглобулинов класса G.
Контрольные значения соответствующих показателей были получены при исследовании здоровых кроликов. Собственно контрольную группу составили 3 кролика без неврологических симптомов. Титр комплемента составил 29,3±0,51; циркулирующие иммунные комплексы: мелкомолекулярные 0,068±0,004 у.е., среднемолекулярные 0,074±0,004 у.е. и крупномолекулярные 0,065±0,002 у.е. Иммуноглобулины классов А, М, G — 2,93±0,154 мг/мл, 2,16±0,07 мг/мл, 9,04±0,146 мг/мл соответственно.
При изучении титра комплемента мы установили, что при легкой степени тяжести происходит увеличение титра на 5%, при средней степени тяжести на 7,2 % (см рисунок 1).
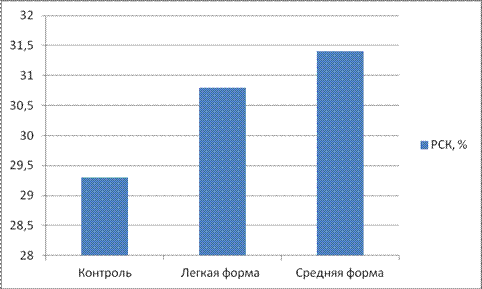
Рисунок 1. Реакция связывания комплемента
Данные о содержании иммуноглобулинов классов А, М, G в крови весьма малочисленны. Сообщается о снижении уровня Ig G и повышении уровня Ig М в сыворотки крови [4]. В сыворотке крови кроликов, зараженных ЭАЭ, происходила активация выработки иммуноглобулинов класса М у легкой степени тяжести на 43,5 % и у средней степени тяжести на 50 % по сравнению с контролем; и увеличение выработки иммуноглобулинов класса G на 36,4 % и на 53,7 % соответственно (см. рисунок 2).
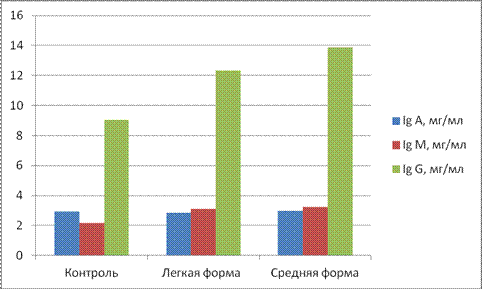
Рисунок 2. Изменение иммуноглобулинов сыворотки крови при ЭАЭ
Проводя анализ содержания сывороточных иммуноглобулинов классов А, М, G при экспериментальной модели рассеянного склероза выявлено повышение содержания Ig M и незначительное снижение уровня Ig G. Изменение же уровня Ig A в сыворотке при аллергическом энцефаломиелите не является показателем для данного заболевания.
При экспериментальной модели рассеянного склероза происходит увеличение содержания циркулирующих иммунных комплексов в сыворотке крови. У легкой формы возрастает содержание среднемолекулярных ЦИК на 9 % по сравнению с контрольной группой, а при средней форме заболевания на 21 %. Так же происходит возрастание крупномолекулярной формы ЦИК у легкой формы заболевания на 12 %, а у средней на 38 % (см рисунок 3).
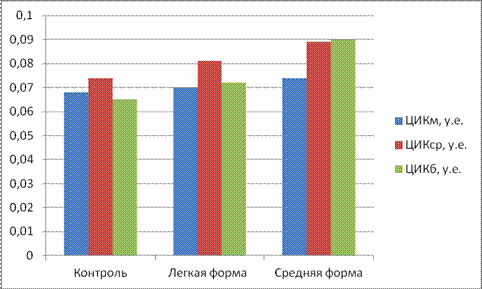
Рисунок 3. Изменение показателей циркулирующих иммунных комплексов при ЭАЭ
Таким образом, результаты исследования при экспериментальной модели рассеянного склероза — аутоиммунном аллергическом энцефаломиелите позволили установить, что при данном заболевании происходит активация гуморального звена иммунитета, которая проявляется в нарастании титра комплемента, увеличении выработки иммуноглобулинов класса М и G, и увеличении количества циркулирующих иммунных комплексов в сыворотке крови опытных животных.
Список литературы:
1.Бойко А.Н. Рассеянный склероз: молекулярные и клеточные механизмы / А.Н. Бойко // Молекулярная биология. — 1995. — Вып. 4. — С. 727—749.
2.Гусев Е.И. Рассеянный склероз: от изучения иммунопатогенеза к новым методам лечения / Е.И. Гусев, А.Н. Бойко М.: Губернская медицина, 2001. — 256 с.
3.Гусев Е.И. Рассеянный склероз / Е.И. Гусев, Т.Л. Демина, А.Н. Бойко М.: Нефть и газ, 1997. — 124 с.
4.Лебедев К.А. Иммунограмма в клинической практике / К.А. Лебедев, И.Д. Понякина М.: Наука, 1990. — 224 с.
5.Новиков П.Д. Принципы оценки иммунного статуса и диагностики иммунодефицитных болезней / П.Д. Новиков, Н.Ю. Коневалова, Н.Д. Титова // Иммунопатология. — 2005. — № 2. — С. 8—22.
6.Archelos J.J. The role of B cells and autoantibodies promotes central nervous systems remyelination / J.J. Archelos, M.K. Storch, H.P. Hartung // Multiple sclerosis — 1998. — № 4. — Р. 217—221.
дипломов


Оставить комментарий