Статья опубликована в рамках: XII Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 10 октября 2013 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИЗУЧЕНИЕ ДИНАМИКИ ЧИСЛЕННОСТИ LISTERIA MONOCYTOGENES В АССОЦИАЦИИ С ОВОЩНЫМИ КУЛЬТУРАМИ
Овод Артем Артурович
студент 5 курса, кафедра экологии РГАУ-МСХА им. К.А. Тимирязева, г. Москва
E-mail: belosom@rambler.ru
Годова Галина Владимировна
научный руководитель, канд. биол. наук, доцент РГАУ-МСХА им. К.А. Тимирязева, г. Москва
Пушкарева Валентина Ивановна
научный руководитель, д-р биол. наук, ведущий научный сотрудник НИИЭМ им. Н.Ф. Гамалеи, г. Москва
Данная работа была выполнена при поддержке гранта № 11G34.310079 правительства РФ.
Установлено, что овощные растения могут служить эконишей для патогенных микроорганизмов [1]. Поскольку естественным первичным природным резервуаром патогенных форм считается почва [4], существует опасность проникновения патогенов в растительные субстраты. Источником заражения сельскохозяйственных животных служат корма, в частности, силос, где листерии активно размножаются. Инфицирование людей связано с употреблением в пищу контаминированных овощей и продуктов животноводства [3].
Следует отметить, что в последние годы интерес к данной проблеме возрастает: это связано, прежде всего, с глобализацией экономики, что обусловливает трансконтинентальное перемещение огромных объемов овощей, фруктов, других продуктов по водным, воздушным, наземным путям и возможное распространение возбудителей пищевых инфекций не только в страны с низким уровнем санитарно-эпидемиологического и ветеринарного контроля, но и в благополучные по этим параметрам государства.
Современная пищевая индустрия направлена на внедрение новых технологий и новых продуктов, которые приводят к изменению пищевого поведения населения, к отказу от национальных традиций в пользу так называемого биогенного питания, а также внедрение вегетарианства, фаст-фуда, введение в рацион проростков ряда агрокультур: люцерны, бобов, клевера, редиса, а также других растений, не подвергающихся тепловой обработке, которые наряду с привычными овощными культурами занимают все больший удельный вес в питании современных жителей городов. Следствием структурных изменений в рационе является возникновение вспышек пищевых токсикоинфекций, часто неясной этиологии, которые всегда носят резонансный характер и нередко остаются нерасшифрованными, с не выявленными резервуарами и источниками возбудителя [5].
Цель данной работы: определить динамику численности листерий (вирулентного штамма EGD и аттенуированного — Δhly) в ассоциации с каллусами листового салата (Lactuca sativa L.), пекинской капусты (Brassica pekinensis) и петрушки (Petroselinum crispum).
Для получения стерильных эксплантов из семян листового салата, пекинской капусты и петрушки использовалась сулема — дихлорид ртути, который применяется как антисептик, для протравливания семян. После чего семена промывали стерильной водой и высевали на питательную среду MS [2] После прорастания семян и получения проростков выращивали каллусы по общепринятой методике [2]. Каллусы всех растений выращивали в климат-камере при влажности воздуха 70 %, освещенности 5000 люкс и температуре 25 ºС.
Заражение каллусов для бактериологических исследований проводили с помощью шприца, вводя бактериальную суспензию в агар под каждый каллус в дозе 106 м.к./мл (по оптическому стандарту мутности — National opacity standard). В качестве контроля оставляли каллусы, под которые вводили по 1,0 мл изотонического раствора NaCl. Посевы исследовали в динамике (через 1—3-5—7 суток после заражения клеточных культур) путем высева суспензии из гомогенизированных в изотоническом растворе хлористого натрия каллусов (Disperser T 10 basic IKA, Germany) на селективную среду для количественного учета листерий по КОЕ.
Бактериологические исследования каллусов листового салата в первые сутки после заражения выявили следующее: листерии штамма EGD, также как и его изогенного мутанта проникали в растительные ткани и их концентрация была практически одинаковой — 6,8 lg КОЕ (рис. 1).
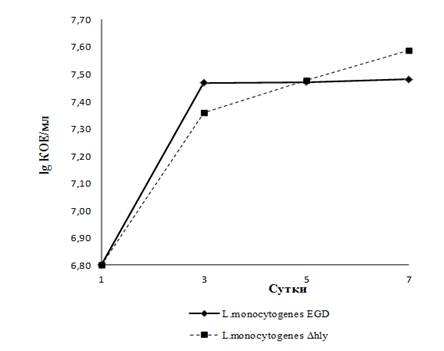
Рисунок 1. Численность L.monocytogenes в ассоциации с листовым салатом, 25 С
Косвенным свидетельством колонизации является то, что листерии изолировали только из гомогената тканей, тогда как смывы с поверхности образцов не содержали искомых бактерий, а лишь незначительное количество грибов (Penicillim sp. и Candida sp.), что расценивалось как естественная поверхностная контаминация. Каллусы не изменяли цвета и выглядели как интактные растения. Начиная с 3-их суток, каллусы, зараженные L.monocytogenes EGD, останавливались в росте и желтели; при этом численность листерий оставалась высокой — 107 КОЕ/г. Образцы, зараженные аттенуированными листериями сохраняли нормальный внешний вид, однако при посевах гомогената отмечена столь же высокая численность бактерий — 107 КОЕ/г. Через неделю каллусы, зараженные L.monocytogenes, представляли собой мацерированные ткани, практически распавшиеся; напротив, каллусы, инфицированные авирулентными листериями в эти сроки не испытывали видимого фитопатогенного воздействия на растительные ткани, при этом, сохранялась прежняя численность бактерий — 107 КОЕ/г.
Популяционная динамика листерий изогенных штаммов, взаимодействующих с каллусами, показала, что микроорганизмы хорошо размножались в ассоциации с живыми растительными клетками, однако при гибели каллусов, зараженных L.monocytogenes EGD, их концентрация не менялась, очевидно, бактерии использовали распавшиеся ткани в качестве питательного субстрата.
Контрольные каллусы сохраняли первоначальный вид: при просмотре на световом микроскопе при увеличении х1600 были отмечены большие клетки округлой формы, плотно прижатые друг к другу, сильно вакуолизированные и оводненные, имеющие мелкое ядро и не содержащие хлорофилла.
Аналогичные опыты, проведенные на модели пекинской капусты выявили сходную динамику роста как вирулентного, так и аттенуированного штаммов листерий в ассоциации с растительными клетками (рис. 2).

Рисунок 2. Численность L.monocytogenes в ассоциации с пекинской капустой, 25 С
При взаимодействии с каллусами петрушки численность листерий в течение недели уменьшалась, постепенно — в случае использования штамма EGD, а при инфицировании растительных клеток L.monocytogenes Δ hly, который лишен гена патогенности листериолизина О, наблюдалось резкое снижение численности бактерий — практически до нуля (рис. 3). Снижение численности может быть связано с проявлением фитонцидных свойств петрушки, содержащей эфирные масла, обеспечивающие защитный механизм при внедрении бактерий в растительные клетки.
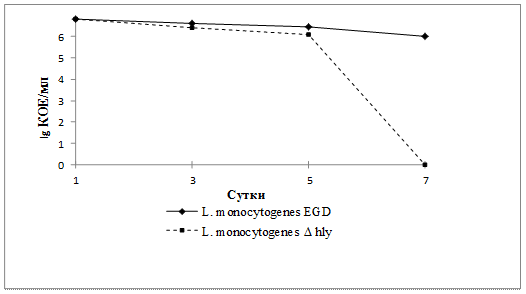
Рисунок 3.Численность L.monocytogenes в ассоциации
с петрушкой, 25 °С
Культуральные, морфологические и биохимические свойства изолятов листерий, полученных в ходе экспериментов, не изменялись; лишь скорость роста культур после посевов замедлялась до 48 часов.
Таким образом, популяционная динамика инфицированных каллусов разных моделей выявила различия между штаммами EGD и Δhly в ассоциации с петрушкой, фитонцидные свойства которой существенно снижают численность аттенуированного штамма.
Список литературы:
1.Годова Г.В., Пушкарева В.И. и др. Овощные культуры как возможные резервуары листерий // Известия ТСХА. 2009. № 4.
3.Литвин В.Ю., Гинцбург А.Л., Пушкарева В.И. и др. Эпидемиологические аспекты экологии бактерий.// М: Фармарус-принт, 1998, — 257 с.
4.Пушкарева В.И. Патогенные бактерии в почвенных и водных сообществах. Дисс..докт. биол. наук. М. 1994, — 220 с.
5.Пушкарева В.И., Литвин В.Ю., Ермолаева С.А. Растения как резервуар и источник возбудителей пищевых инфекций. // Эпидемиология и вакцинопрофилактика .— 2012. — № 2. — С. 10—20.
дипломов


Комментарии (1)
Оставить комментарий