Статья опубликована в рамках: XI Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 30 мая 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ПРИМЕНЕНИЕ ЭЛЕКТРОМЕДИАТОРА ДЛЯ ИНИЦИИРОВАНИЯ РЕАКЦИЙ СЕРОВОДОРОДА С (ГЕТЕРО-)АРОМАТИЧЕСКИМИ СОЕДИНЕНИЯМИ
Краморенко Анна Олеговна
студент 3 курса, кафедра АГТУ, г. Астрахань
E-mail: selena_kram@mail.ru
Шинкарь Елена Владимировна
научный руководитель, д-р хим. наук, профессор кафедры органической, биологической и физколлоидной химии АГТУ, г. Астрахань
Работа выполнена при поддержке РФФИ (грант № 12-03-00513а)
В настоящее время актуальной задачей химии органических соединений является поиск новых реакций, направленных на совершенствование известных труднодоступных методов синтеза. Введение в молекулы органических соединений атома серы обуславливает существенное возрастание их биологической активности. Серосодержащие органические соединения включают в состав антибактериальных, противотуберкулезных и противоопухолевых препаратов. Они находят широкое применение в качестве присадок к моторным маслам и топливам, стабилизаторов резин, пластмасс и полимеров, составляющих пестицидов и гербицидов, отбеливающих средств, пищевых ароматизаторов и т. д. [4].
Большинство методов получения тиопроизводных органических соединений основано на использовании термодинамически стабильного и кинетически инертного сероводорода, являющегося дешевым источником тиильных радикалов. В связи с этим осуществить реакции одностадийного тиолирования ароматических и гетероароматических соединений в присутствии сероводорода при низких температурах достаточно сложно. Несмотря на неоспоримые успехи в синтезе органических соединений серы, необходим поиск новых эффективных путей их получения при снижении энергозатрат.
Одним из универсальных методов для установления механизма органических реакций и определения промежуточных стадий изучаемых редокс-процессов является метод циклической вольтамперометрии на твердых стационарных электродах [6—9]. Для снятия циклических вольтамперограмм использовали систему электрохимических измерений, состоящую из трехэлектродной бездиафрагменной ячейки с рабочим объемом 2 мл, сопряженную с потенциостатом «IPС-Pro» и IBM. В качестве рабочего электрода применяли стационарный игольчатый платиновый электрод (S = 3,14 мм2), функцию электрода сравнения выполнял насыщенный хлорсеребряный электрод с водонепроницаемой диафрагмой, вспомогательным электродом служила платиновая пластина (S = 70 мм2).
Процесс окисления сероводорода при потенциале Епа = 1,6 В в рассматриваемых условиях является необратимым (рис. 1), так как на обратной ветви ЦВА отсутствует катодный пик и отношение пиков по току Iпк/Iпа= 0.
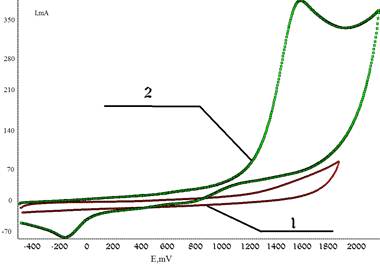
Рисунок 1. ЦВА окисления: 1 — фонового электролита, 2 — сероводорода (CH3CN, n-Bu4NClO4, С(H2S)РРH=0,005 моль/л, Pt – анод, Ag/AgCl/KCl нас.)
Окисление сероводорода приводит к образованию нестабильного катион-радикала:
H2S - ē → [H2S].+ → H+ + HS. (1)
На ЦВА фиксировали пик восстановления протона при потенциале Епк= –0,2 В, cледовательно, катион-радикал сероводорода фрагментируется с отщеплением протона и образованием тиильного радикала.
В настоящее время электросинтез эффективней использовать, чем обычные химические методы, потому что его проведение не требует дополнительных реагентов, позволяет осуществлять реакцию практически в замкнутой системе с минимальным количеством ее участников, позволяет повысить селективность превращения исходных субстратов и выход целевых продуктов [8].
Ранее нами были изучены реакции присоединения к ненасыщенным углеводородам и замещения в ароматических соединениях с участием тиильного радикала, генерируемого при окислительной электрохимической активации H2S [3]. В результате прямого способа окисления сероводорода на аноде в СH3CN удалось получить продукты SH-функционализации алкенов линейного строения (гексантиол-1, гептантиол-1), ароматических углеводородов (бензол, толуол, анилин, бензойная кислота) и пятичленных S-, N-содержащих гетероциклических соединений (фуран, тиофен, пиррол) c выходом по току 37—84 % при комнатной температуре [4].
К современным тенденциям в области применения непрямого электроокисления cоединений следует отнести разработку эффективных и экологичных методов синтеза органических производных в достаточно мягких условиях. Это оказалось возможным за счет катализа органических реакций различными медиаторами (Med) или медиаторными системами [5, 8]. При этом электроокислительные процессы позволяют осуществлять превращения соединений с высокой селективностью при более низких значениях анодного потенциала по сравнению со стандартным потеницалом их окисления [1].
Преимуществом предлагаемого в работе метода является также применение медиатора в каталитических количествах ввиду его доступной регенерации в ходе редокс-процесса. При использовании электромедиатора удается избежать влияния напряженности электрического поля, адсорбции реагента на электроде, поскольку реакция протекает более независимо от электрода [2].
Применение третичных и вторичных незамещенных и галогензамещенных ароматических аминов в роли электромедиаторов в реакциях алифатических и ароматических соединений с H2S позволило за счет цикличности процесса значительно увеличить выход продуктов тиоприсоединения при снижении анодного перенапряжения в процессе электролиза в среднем на 0,4 В [5]. Энергозатраты на проведение синтеза SH-производных органических соединений в случае непрямого окисления H2S лимитируются значением потенциала окисления выбранного медиатора [7]. Таким образом, использование электромедиаторов в синтезе органических соединений серы оказалось достаточно эффективным способом активации сероводорода.
Для проведения реакций с участием сероводорода были выбраны конденсированные соединения ароматического и гетероароматического рядов: нафталин (I), антрацен (II), акридин (III) и хинолин (IV). В данной работе предложено для активации сероводорода использовать электромедиатор — n-(C4H9)4NBr, который окисляется в две стадии при потенциалах Епа1= 0,76 В; Епа2= 1,08 В (рис. 2).
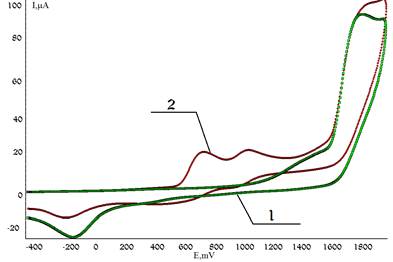
Рисунок 2. ЦВА окисления: 1 — сероводорода в присутствии нафталина, 2 — медиатора в присутствии нафталина и сероводорода (CH3CN, n-Bu4NClO4, С(H2S) РРH= C (Med) = 0,005 моль/л, Pt — анод, Ag/AgCl/KCl нас.)
Первая обратимая стадия отвечает окислению аниона брома до радикала, что позволяет генерировать из молекулы сероводорода тиильный радикал в мягких условиях в соответствии со схемой:
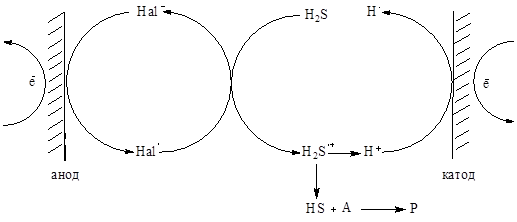 (2)
(2)
Hal = Br A- субстрат Р- продукт реакции
С увеличением концентрации реагента на ЦВА наблюдается возрастание по току пика окисления Med и снижение обратимости процесса, что свидетельствует о возможности использования n-(C4H9)4NBr в качестве электромедиатора процесса окисления сероводорода.
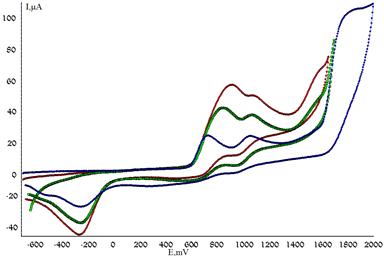
Рисунок 3. ЦВА окисления медиатора в присутствии нафталина при различных концентрациях сероводорода (С1=5·10-3, С2=10·10-3, С3=15·10-3 моль/л) (CH3CN, n-Bu4NClO4, РРHPt — анод, Ag/AgCl/KCl нас.).
Общий механизм промотирования процесса окисления Н2S медиатором n-(C4H9)4NBr в реакциях с выбранными органическими соединениями I-IV (RH) включает следующие cтадии:
1. Электрогенерирование активной формы медиатора и образование радикального интермедиата:
Br‾ – ē → Br• (3)
2. Генерирование тиильного радикала из молекулы сероводорода:
Br• + Н2S → H2S•+ + Br‾ (4)
3. Фрагментация нестабильного катион-радикала сероводорода:
Н2S•+ → HS• + H+ (5)
4. Тиолирование органического субстрата с участием образующихся тиильных радикалов:
RH + HS• → R• + Н2S (6)
R• + НS• → RSH (7)
5. Регенерирование медиатора на катоде:
Br• + ē → Br‾ (8)
Электролиз смеси Н2S и соединения I—IV с применением n-(C4H9)4NBr медиатора проводили в ходе процесса "in-cell", при котором окисление реагента осуществляли в одну стадию непосредственно в электролизере. В результате проведенных реакций был получен спектр различных органических производных серы, в присутствии каталитических количеств редокс-медиатора при комнатной температуре.
После проведения электролиза смеси ароматического субстрата (I, II) с H2S наблюдали пик окисления продукта реакции тиозамещения в нафталине и антрацене за счет применения редокс-пары медиатора (Br- /Br.).
При взаимодействии соединений III, IV с сероводородом в присутствии электромедиатора в условиях электролиза при его потенциале окисления (рис. 4) получены также и продукты радикального тиоприсоединения к субстрату, что возможно благодаря восстановлению протона — продукта фрагментации катион-радикала сероводорода — до атомарного сероводорода.
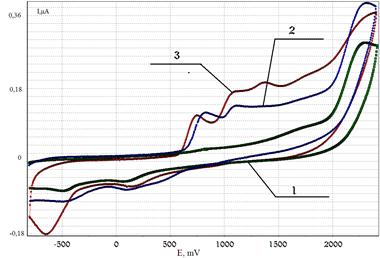
Рисунок 4. ЦВА окисления: 1 — хинолина, 2 — медиатора в присутствии хинолина, 3 — продуктов электролиза хинолина и сероводорода в присутствии Med (2 часа) (CH3CN, n-Bu4NClO4, РРHPt — анод, Ag/AgCl/KCl нас.)
В связи с этим реакция хинолина с сероводородом протекает по двум направлениям:
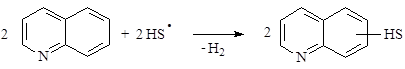 (9)
(9) 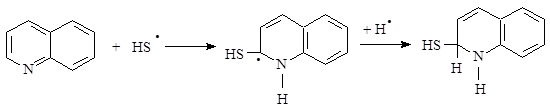 (10)
(10)
Аналогичные превращения характерны и для акридина в присутствии активированной формы H2S. В ходе взаимодействия соединений III, IV с окисленной формой сероводорода (катион-радикалом) происходит протонирование субстрата, что приводит к образованию катионов хинолиния и акридиния и влияет на снижение выхода основных продуктов тиолирования N-содержащих гетероциклов:
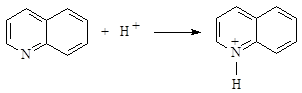 (11)
(11)
Результаты проведенного электрохимического исследования реакций ароматических и гетероароматических соединений I—IV с сероводородом в присутствии электромедиатора представлены в табл. 1,2.
Таблица 1.
Электрохимические характеристики исходных соединений I—IV и продуктов их взаимодействия с сероводородом в присутствии Med
|
Субстрат |
Eпа |
Iпк/Iпа |
ΔЕ |
Епк |
Епа2 |
|
I |
1,84 |
0,35 |
0,12 |
- |
1,58 |
|
II |
1,40 |
0,42 |
0,15 |
- |
1,14 |
|
III |
1,70 |
0,30 |
0,12 |
-0,52 |
1,36 |
|
IV |
2,20 |
0,20 |
0,15 |
-0,56 |
1,36; 1,83 |
Примечание: Eпа — потенциал окисления соединений I—IV, Iпк/Iпа — отношение по току пика катодного к пику анодному; ΔЕ — разница между потенциалами пиков анодного и катодного; Епк — потенциал восстановления солей хинолиния и акридиния; Епа2 — потенциал окисления продуктов реакции соединений I—IV с сероводородом в присутствии электромедиатора n-(C4H9)4NBr
Таблица 2.
Результаты проведенных электрохимических исследований реакций соединений I—IV с сероводородом в присутствии Med
|
Cубстрат |
Выход продуктов реакции, % |
Степень превращения субстрата, % |
|
I |
32,5 |
39,2 |
|
II |
20 |
51,8 |
|
III |
32,4 |
73,1 |
|
IV |
12,9; 26,6 |
45,3 |
Таким образом, применение электромедиатора — n-(C4H9)4NBr в синтезе тиопроизводных (гетеро-)ароматических соединений позволяет снизить потенциал активации H2S до катион-радикала на ≈ 0,8В по сравнению с потенциалом прямого окисления сернистого реагента на аноде. Зафиксированный каталитический эффект в смеси сероводорода и медиатора выражается в снижении обратимости процесса окисления n-(C4H9)4NBr при увеличении концентрации H2S. В случае хинолина получен продукт радикального тио-замещения в ароматическом кольце гетероциклического соединения и продукт тио-присоединения по кратным связям азотсодержащего цикла. В качестве побочных продуктов реакции хинолина (акридина) с активированной медиатором формой сероводорода образуются соответствующие гетероциклические соли.
Список литературы:
1.Бaйзер М., Лунд Х. Органическая электрохимия: В двух книгах: Кн. 2, Пер. с англ./ Под ред. Петросяна В.А., Феоктисова Л.Г.. — М.: Химия, 1988. — 469 с. (кн. 1), 1024 с.(кн. 2).
2.Берберова Н.Т., Шинкарь Е.В. // Известия РАН, Серия химическая, 2000. — № 7. — С. 1182—1188.
3.Берберова Н.Т., Шинкарь Е.В., Разуваева А.В. // Вестник АГТУ, Астрахань, 2005. — № 6(29). — С. 29—34.
4.Берберова Н.Т., Шинкарь Е.В., Смолянинов И.В., Охлобыстин А.О. Вовлечение сероводорода, тиолов и полисульфанов в синтез органических соединений серы. Монография, Ростов-н/Д.: ЮНЦ РАН, 2009. — 256 c.
5.Будникова Ю.Г., Будников Г.К. Медиаторные системы в органической электрохимии // ЖОХ, 1995. — Т. 65. — Вып. 9. — С. 1517—1535.
6.Ёсида К. Электроокисление в органической химии. Роль катион-радикалов как интермедиатов в синтезе. — М.: Мир, 1987. — 326 с.
7.Манн Ч., Барнес К. Электрохимические реакции в неводных системах. — М.: Химия, 1974. — 480 с.
8.Огибин Ю.Н., Элинсон М.Н., Никишин Г.И. Органический электросинтез с использованием медиаторных систем окисления // Успехи химии, 2009. — Т. 78. — № 2. — C. 99—150.
9.Охлобыстин А.О., Охлобыстина А.В., Шинкарь Е.В., Берберова Н.Т., Еременко И.Л. // Доклады Академии наук, 2010. — Т. 435. — № 3. — С. 1—5.
дипломов


Оставить комментарий