Статья опубликована в рамках: IX Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 04 апреля 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
АКТИВАЦИЯ СЕРОВОДОРОДА В РЕАКЦИЯХ ТИОЛИРОВАНИЯ ЦИКЛОАЛКЕНОВ
Кудрявцев Даниил Александрович
студент 4 курса, кафедра органической, биологической и физколлоидной химии АГТУ, г. Астрахань
E-mail: littleboot@bk.ru
Шинкарь Елена Владимировна
научный руководитель, д-р хим. наук, профессор кафедры органической, биологической и физколлоидной химии АГТУ, г. Астрахань
Работа выполнена при поддержке РФФИ (грант № 12-03-00513а)
Широкое применение органических соединений серы в различных областях промышленности делает необходимым и актуальным поиск более рациональных путей их синтеза и подбор оптимальных условий. В последнее время особый интерес обращен к SН-функциональным производным углеводородов, которые используют в качестве экстрагентов, растворителей, флотореагентов, специфических пластификаторов, пестицидов, а также в синтезе различных биологически активных веществ, в частности, лекарственных препаратов.
Циклические тиолы являются составляющими противовоспалительных, сердечно-сосудистых, иммуномодулирующих, нестероидных, седативных и антисептических лекарственных препаратов. Циклоалкантиолы используют в качестве компонентов лекарственных средств для лечения бронхиальной астмы, диабета, ишемической болезни сердца. Помимо достаточно широкого применения в фармакологии, циклоалкантиолы используются в качестве стабилизаторов реакций полимеризации, присадок к моторным топливам, одорантов и пищевых добавок [8, 9].
К современным тенденциям в области применения электросинтеза следует отнести разработку эффективных и экологичных методов получения органических производных в достаточно мягких условиях, основанных на активации реагента или субстрата. Ранее проведенные исследования показали целесообразность использования предварительной окислительной активации сероводорода в реакции тиолирования бензола, толуола, тиофена и гексена-1 при комнатной температуре [1]. В настоящей работе рассмотрены способы 1-8 получения циклоалкантиолов, основанные на предварительной окислительной и восстановительной активации Н2S до нестабильных ион-радикалов по схеме (1) в реакциях с циклопентеном Ia и циклогексеном IIa.
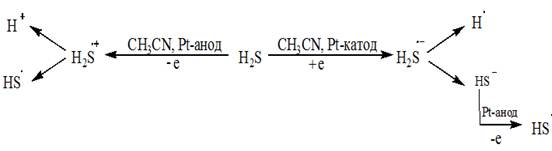 (1)
(1)
Соединения Ia, IIa достаточно инертны к окислению в отличие от сероводорода, что позволяет проводить реакцию активированного Н2S с их молекулярной формой.
Существующие методы синтеза циклоалкантиолов труднодоступны ввиду необходимости повышенной температуры или использования химических реагентов в качестве катализаторов [2, 5]. В отличие от известных методов получения циклопентантиола и циклогексантиола предлагаемые в работе способы их синтеза по схеме (2) позволяют реализовать процесс при комнатной температуре и атмосферном давлении за счет генерирования тиильных радикалов из сероводорода путем его предварительной активации:
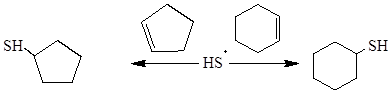 (2)
(2)
Электролиз смеси (соединение Ia,(IIa) + H2S) проводили в бездиафрагменном электролизере в ацетонитриле при использовании для активации сероводорода ряда способов 1—7.
Способ 1 основан на прямой электрохимической активации сероводорода в реакциях с соединениями Ia, IIa на платиновом аноде до нестабильного катион-радикала и последующей фрагментацией с отрывом протона. В качестве атакующей субстрат частицы выступает тиильный радикал и продукты реакции — циклопентантиол Ib, циклогексантиол IIb образуются по радикальному механизму [5].
Для идентификации полученных циклоалкантиолов применяли метод циклической вольтамперометрии. Серию электрохимических экспериментов проводили при помощи потенциостата «IPC-Pro», сопряженного с IBM (рис. 1). Для снятия циклических вольтамперограмм использовали трёхэлектродную, бездиафрагменную ячейку (V=2 мл). В качестве рабочего электрода применяли платиновый электрод (D=1 мм2), электрод сравнения — Ag/AgCl в КСl нас. с водонепроницаемой диафрагмой, вспомогательный электрод — платиновый, (S=70 мм2). Рабочая скорость развертки потенциала 0,2 В/с, фоновый электролит (n-Bu4NClO4) с концентрацией 0,1 моль/л. Продувку рабочего раствора для удаления следов растворённого кислорода и остаточного количества Н2S после проведения реакции с циклоалкенами осуществляли аргоном в течение 10—15 мин. Определение числа переносимых электронов в ходе электрохимической реакции проводили сравнением со стандартом — ферроценом.

Рисунок 1. Схема ячейка для электрохимических исследований методом ЦВА: 1 — тефлоновая пробка; 2 — корпус ячейки; 3 — рабочий электрод; 4 — вспомогательный электрод; 5 — электрод сравнения; 6 — трубка для ввода продувочного газа
Электронные спектры поглощения (ЭСП) растворов (С=1·10-4 моль/л) исходных субстратов и синтезированных продуктов реакции в СН3CN регистрировали на спектрофотометре СФ-103 (190÷1100 нм) в кварцевых кюветах (l=10 мм) при 298 К. Хроматографические исследования проводили на газовом хроматографе Кристаллюкс-4000 М в изотермическом режиме, газ-носитель — гелий, капиллярная колонка фирмы "Agilent" (100 м × 0,25 мм), tк=80 °С, l детектор — пламенно-ионизационный, tд= 250°С, стационарная фаза НР-1.
Способы 2, 3, 5 базируются на непрямом электрохимическом окислении H2S во взаимодействии с соединениями Ia, IIa при использовании 3,5-ди-трет-бутил-бензол-1,2-диола или электромедиаторов (рис. 2) — бромида тетрабутиламмония (трифениламина). Применение непрямого способа активации характеризуется значительным (0,5-0,8 В) снижениием энергозатрат. Установлено, что природа электрокатализатора или электромедиатора значительно влияет на выход целевых продуктов реакции (циклопентантиол и циклогексантиол) [4, 6].
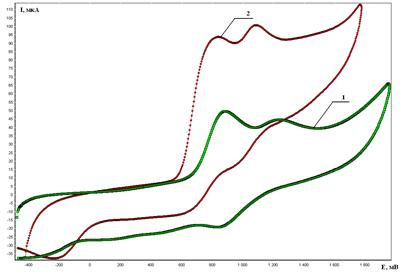
Рисунок 2. ЦВА окисления n-Bu4NBr (C=5∙10-3 моль/л): 1 — до, 2 — после добавки сероводорода (C=5∙10-3 моль/л) (Ag/AgCl, СН3CN, 0,1 М n-Bu4NClO4)
Cпособ 4 реализуется путем предварительного взаимодействия сероводорода с триэтиламином, что позволяет проводить дальнейшее электрохимическое генерирование тиильного радикала из H2S при низком анодном потенциале в реакциях с соединениями Ia, IIa [7].
Cпособ 6 основан на прямой электрохимической активации сероводорода в реакциях с циклоалкенами Ia, IIa на платиновом катоде до нестабильного анион-радикала и последующей фрагментацией с отщеплением тиолат-аниона. Дальнейшее окисление тиолат-аниона также приводит к генерированию тиильного радикала.
Способ 7 базируется на применении прямой активации сероводорода при взаимодействии с соединениями Ia, IIa в присутствии серы. Однако при использовании данного способа наблюдалось также образование полисульфидов (8,1—18,8 %) ввиду конденсации серы с циклоалкенами [3].
Сравнительная характеристика предложенных способов 1—7 электрохимической активации сероводорода в реакциях с циклоалкенами Ia, IIa представлена на рис. 3.
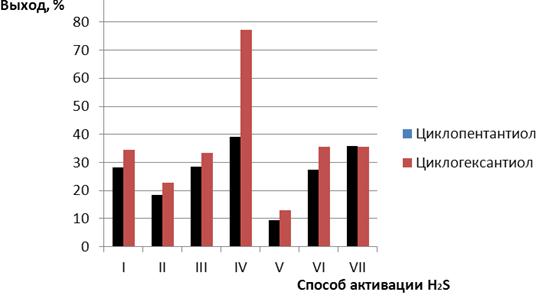
Рисунок 3. Зависимость выхода циклопентантиола и циклогексантиола от способа активации сероводорода в реакции с соответствующими циклоалкенами
Способ 8 предполагает использование химических окислителей класса пространственно-затрудненных о-бензохинонов для активации сероводорода в реакциях с соединениями Ia, IIa. Установлено, что при взаимодействии H2S с циклоалкенами в различных условиях активации происходит образование сульфанов и молекулярной серы. В качестве побочных превращений следует также рассматривать процесс полимеризации циклоалкенов по радикальному механизму в присутствии образующейся серы.
Данные экспериментальных исследований свидетельствуют о более высокой реакционной способности соединения Ia в отличие от циклоалкена IIa, что подтверждали квантово-химическим расчетом тепловых эффектов их реакций с H2S в неэмпирическом базисе 6—31 G(d,p). С позиций термодинамики образование циклогексантиола (ΔН= –71,0 кДж/моль) легче, чем циклопентантиола (ΔН= –65,7 кДж/моль).
Таким образом, впервые осуществлено тиолирование непредельных циклических соединений по радикальному механизму в присутствии активированного сероводорода. Предложено для повышения реакционной способности сероводорода использовать прямые или косвенные способы активации посредством одноэлектронного окисления или восстановления H2S в неводных средах. В качестве химических реагентов при использовании комбинированных систем с участием анода для активации сероводорода предложено использовать о-бензохинон или триэтиламин, что приводит к значительному снижению анодного перенапряжения процесса электросинтеза тиопроизводных циклоалкенов. Выход циклоалкантиолов зависит от способа активации H2S, причем наиболее эффективный способ основан на совокупности применения платинового анода и триэтиламина.
Список литературы:
1.Берберова Н.Т., Шинкарь Е.В., Смолянинов И.В., Охлобыстин А.О. Вовлечение сероводорода, тиолов и полисульфанов в синтез органических соединений серы. Монография, Ростов-на-Дону: ЮНЦ РАН, 2009. — 256 c.
2.Воронков М.Г. Реакции серы с органическими соединениями, Н.: Наука,1979. — 360 с.
3.Кудрявцев Д.А., Арефьев Я.Б., Пащенко К.П., Шинкарь Е.В., Берберова Н.Т.. Использование сероводорода в процессе тиолирования ненасыщенных циклических углеводородов// Сборник материалов III научно-практической конференции «Новейшие технологии освоения месторождений углеводородного сырья и обеспечение безопасности экосистем Каспийского шельфа», Астрахань, Изд-во: Издательский дом «Астраханский университет». — 2012. — С. 193—195.
4.Кудрявцев Д.А., Юсупова Л.Р., Арефьев Я.Б., Шинкарь Е.В., Берберова Н.Т. Усовершенствование способа получения циклоалкантиолов как основных реагентов в синтезе ряда лекарственных препаратов// Сборник материалов и тезисов докладов Всероссийской молодежной конференции «Инновации и технологии Прикаспия», Астрахань, Изд-во: Издательский дом «Астраханский университет». — 2012. — С. 264—267.
5.Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. — М.: Бином, 2003. — 2354 с.
6.Юсупова Л.Р., Арефьев Я.Б., Пащенко К.П., Шинкарь Е.В., Берберова Н.Т.. Применение редокс-катализа в реакциях сероводорода с (цикло-)алканами// Сборник тезисов и статей международной молодежной конференции «Катализ в органическом синтезе», Новочеркасск: «ЛИК». — 2012. — C. 160—163.
7.Юсупова Л.Р., Арефьев Я.Б., Пащенко К.П., Шинкарь Е.В., Берберова Н.Т. Утилизация сероводорода в тиопроизводные циклических алкенов// Сборник материалов III научно-практической конференции «Новейшие технологии освоения месторождений углеводородного сырья и обеспечение безопасности экосистем Каспийского шельфа», Астрахань, Изд-во: Издательский дом «Астраханский университет». — 2012. — С. 204—207.
8.Lipkowitz Myron A. and Navarra, Tova The Encyclopedia of Allergies. FactsonFile, NewYork, 2001. — P. 167.
9.Mohamed A. Metwally, Bakr F. Abdel-Wahab. Commun., 2009. — № 2. — V. 4 — PP. 84—119.
отправлен участнику


Комментарии (7)
Оставить комментарий