Статья опубликована в рамках: IV Международной научно-практической конференции ««Проба пера» ЕСТЕСТВЕННЫЕ И МАТЕМАТИЧЕСКИЕ НАУКИ» (Россия, г. Новосибирск, 12 февраля 2013 г.)
Наука: Химия
- Условия публикаций
- Все статьи конференции
дипломов
КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ В ИЗУЧЕНИИ СТРУКТУРНЫХ СВОЙСТВ ВОДЫ
Агишев Алмансур
класс 10 «Ә», казахская средняя школа № 30, г. Актобе, Казахстан
Агишев Болат
класс 8«Ә», казахская средняя школа № 30, г. Актобе, Казахстан
Агишева Алмагуль Абилкаировна
научный руководитель, канд. хим. наук, старший преподаватель, Актюбинский государственный педагогический институт, Казахстан
Данная работа посвящена освоению универсального химического пакета программного средства HyperChem фирмы Hypercube Inc., проведению компьютерного эксперимента [5] и изучению водных ассоциатов [3].
Молекула Н2О. Методика расчета состоит в следующем. Вначале функцией draw — рисование — произвольным образом рисуется нужная частица. Затем построитель моделей — model build — на основе имеющейся у него информации придает модели определенную геометрию. При изображении молекулы воды построителем моделей был выбран валентный угол sp3-гибридизации 109,47 и длина связи О-Н 0,96 А. Заряды атомов при этом не устанавливливаются. С помощью функции display — rendering модели можно менять внешний вид, функцией display — labels различным образом обозначать атомы. Функция setup позволяет выбирать метод расчета молекулярных орбиталей. Здесь использовался расширенный метод Хюккеля, как наиболее быстрый полуэмпирический метод. В методе (Сomplete Neglect of Differential Overlap, CNDO) не учитываются двухэлектронные взаимодействия. В результате получены значения энергии системы, атомных зарядов -0,290 на атоме кислорода и +0,145 на каждом атоме водорода. Функция compute — properties дает значение общей энергии, как суммы энергий связей, теплоты образования, энергий электронов и ядер. Дальнейшая оптимизация геометрии молекулы (compute – geometry optimization) дает значения длин связей Н-О 1,03А, Н-Н 1,62А, угол Н-О-Н 104,2о. Дипольный момент 2,11 Дебай. Функция compute — plot molecular graphs — electrostatic potential представляет распределение в пространстве электростатического потенциала (рисунок 1). Энергетические уровни [1] молекулярных орбиталей рассчитываются выбором compute — orbitals (рисунок 2). Можно видеть расположение в пространстве связывающих, несвязывающих и незанятых разрыхляющих орбиталей. Аналогично были рассчитаны параметры других частиц.

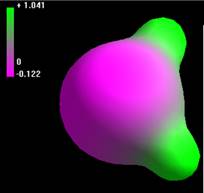
Рисунок 1. Представление электростатического потенциала и общей плотности заряда молекулы воды

Рисунок 2. Энергетические уровни молекулярных орбиталей воды
Ион Н3О+. Волновая функция иона Н3О+ была рассчитана неэмпирическими методами с использованием минимального базисного набора функций STO-3G в приближении Хартри-Фока. Очевиден выигрыш энергии при образовании катиона гидроксония из молекулы воды [2]. Энергетические уровни молекулярных орбиталей Н3О+ по сравнению с уровнями молекулы воды соответствуют более низким значениям энергии. Энергия протолиза составляет порядка 230 ккал/моль. Оптимизация геометрии иона дает значения длин всех связей Н-О 1,047А, Н-Н 1,72А, углов Н-О-Н 110,924о. Катион симметричен относительно трех плоскостей (группа симметрии С3V). Заряд системы +1 распределяется следующим образом: +0,116 на атоме кислорода и + 0,173 на каждом атоме водорода.
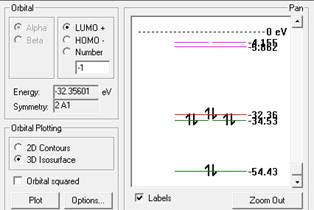
Рисунок 3. Частица Н3О+ и энергетические уровни ее молекулярных орбиталей
Димер (Н2О)2. Согласно проведенным расчетам водородная связь ОН — О близка к линейной, расстояние О — О составляет 2,54 А, угол ОН — О равен 179o. Длина связей О-Н, не участвующих в образовании водородных связей 1,03А. Длина связи О-Н, атом водорода которой участвует в образовании водородной связи увеличивается до 1,04А. Длина самой водородной связи 1,5А, Н-Н 1,63А. Наблюдается некоторое увеличение валентных углов Н-О-Н со 104,2о до 104,5о и увеличение дипольного момента системы до 4,1Дебай.
Происходит перераспределение зарядов с увеличением абсолютной величины отрицательного заряда на атоме кислорода, не участвующего в образовании водородной связи (от -0,266 до -0,319). Этот атом кислорода «готов» образовать еще одну водородную связь [4]. Таким образом, взаимодействие, обусловленное Н-связью, не является насыщенным. Наличие отрицательного заряда вблизи протона, участвующего в связи Н-О, увеличивает на ней поляризацию зарядов, что вызывает более сильное притяжение к атому О- протонов других связей Н-О. Этот кооперативный эффект приводит к образованию кластеров из нескольких молекул.

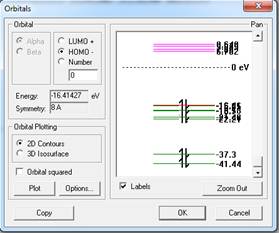
Рисунок 4. Димер воды и энергетические уровни его молекулярных орбиталей
Катионный комплекс Н5О2+. У протона нет внутренних электронных оболочек, и поэтому он может сильно приблизиться к электроотрицательному атому другой молекулы. Таким образом, ион Н3О+ может образовать связь с молекулой воды и дать комплекс [Н5О2]+. Такое взаимодействие называется ионной водородной связью. Заряды на атомах кислорода становятся практически равными между собой -0,26, на концевых четырех атомах водорода +0,28. Заряд центрального атома водорода + 0,39.
Длины четырех связей атомов кислорода с концевыми атомами водорода составляют 1,035А. Длины двух связей атомов кислорода с центральным атомом водорода составляют 1,17А. Длины Н-Н связей между концевыми атомами составляют 1,67А. Длины Н-Н связей между концевыми и центральным атомом составляют 1,9А. Четыре угла Н-О-Н центрального атома водорода составляют 118о. Два угла Н-О-Н «бывших» молекул воды составляют 107,4о. Катионный комплекс представляет собой частицу с равномерным распределением в пространстве электростатического потенциала и электронной плотности заряда. Центральный атом водорода расположен симметрично между электроотрицательными атомами кислорода, и невозможно различить исходный катион гидроксония и молекулу воды. По существу этот комплекс нужно рассматривать как единое химическое образование. Энергетические уровни молекулярных орбиталей снижены, как и в случае иона гидроксония.
Моделирование структуры воды выявило некоторое расхождение полученных данных с принятыми в литературе. Угол Н-О-Н 104,2о (в литературе 104,5о). Дипольный момент 2,11Д (в литературе 1,85Д). Это связано с рассмотрением изолированных частиц, которые в реальном мире находятся в окружении и взаимодействии с другими частицами.
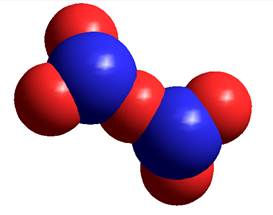
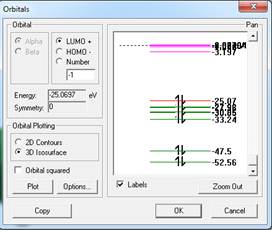
Рисунок 5. Катионный комплекс Н5О2+ и энергетические уровни его молекулярных орбиталей
Список литературы:
1.Грей Г. Электроны и химическая связь // М., Мир, 1997, с. 155—162
2.Гурьянова Е.П., Гольдштейн И.П., Ромм И.П. Донорно-акцепторная связь. М.: Химия, 1993. — 398 с.
3.Зенин С.В., Полануер Б.М., Тяглов Б.В.. Экспериментальное доказательство наличия фракций воды // Ж. Гомеопатическая медицина и акупунктура. 1997. № 2. С. 42—46.
4.Пиментел Дж., Мак-Келан О. Водородная связь // М.: Мир, 1994. — 462 с
5.Соловьев М.Е., Соловьев М.М. Компьютерная химия // М.: СОЛОН-Пресс, 2005. — 536 с.
дипломов

Комментарии (4)
Оставить комментарий