Статья опубликована в рамках: II Международной научно-практической конференции ««Проба пера» ЕСТЕСТВЕННЫЕ И МАТЕМАТИЧЕСКИЕ НАУКИ» (Россия, г. Новосибирск, 29 ноября 2012 г.)
Наука: Математика
Секция: Алгебра
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ЭКСПОНЕНЦИАЛЬНАЯ ЗАВИСИМОСТЬ В ПРИРОДНЫХ ПРОЦЕССАХ
Стойков Дмитрий
10 «А» класс МБОУ СОШ № 177,г. Казань
Хабибуллина Альфия Якубовна
научный руководитель, учитель математики высшей категории МБОУ СОШ № 177,г. Казань
Введение
В природе и жизни человека встречается большое количество процессов, в которых некоторые величины изменяются так, что отношение данной величины через равные промежутки времени не зависит от времени. Среди таковых можно назвать радиоактивный распад веществ, рост суммы на счету в банке и др. Все эти процессы описываются показательной функцией. Меня заинтересовал вопрос, почему протекание этих процессов не зависит от времени. Ведь по логике, любые изменяющиеся процессы должны соотноситься с независимой величиной ― временем. На деле же, это правило работает не всегда.
Цель исследовательской работы: экспериментально подтвердить протекание некоторых химических процессов в соответствии с экспоненциальной зависимостью, описываемой уравнением Аррениуса.
Задачи:
·Изучить показательную функцию;
·Изучить экспоненциальную зависимость, как частный случай показательной функции;
·Изучить уравнение Аррениуса, описывающее экспоненциальную зависимость;
·Изучить примеры химических процессов, протекающих в соответствии с экспоненциальной зависимостью;
·Провести ряд экспериментов и подтвердить на практике протекание некоторых химических процессов в соответствии с экспоненциальной зависимостью, описываемой уравнением Аррениуса.
Гипотеза исследования: при помощи уравнения Аррениуса можно описать некоторые химические процессы.
Объект исследования: показательная функция, как элемент прикладной математики.
Методы исследования:
1. Изучение литературы и электронных ресурсов по теме исследования.
2. Анализ применения экспоненциальной зависимости
3. Химические эксперименты на подтверждение уравнения Аррениуса.
Показательная функция
Пусть х ![]() R, a ≠ 0, {rn} ― последовательность рациональных чисел, сходящихся к x. Определим число ax как предел
R, a ≠ 0, {rn} ― последовательность рациональных чисел, сходящихся к x. Определим число ax как предел . Показательной функцией с основанием a > 0, а ≠ 1 называется функция вида у=ax, х
. Показательной функцией с основанием a > 0, а ≠ 1 называется функция вида у=ax, х ![]() R
R
 Данный предел не зависит от выбора последовательности rn, приводящей к числу x. Областью определения показательной функции является вся числовая ось. Эта функция непрерывна, монотонно возрастает при a > 1
Данный предел не зависит от выбора последовательности rn, приводящей к числу x. Областью определения показательной функции является вся числовая ось. Эта функция непрерывна, монотонно возрастает при a > 1 ![]() и монотонно убывает при 0 < a < 1
и монотонно убывает при 0 < a < 1 ![]() . Функция никогда не обращается в ноль, но имеет горизонтальную асимптоту y = 0.
. Функция никогда не обращается в ноль, но имеет горизонтальную асимптоту y = 0.
График показательной функции у=0,5х
Экспоненциальная зависимость
Особое значение в приложениях имеет показательная функция, в качестве основания которой используют число e, определяемое как
Численно оно равно е = 2,71828182845904523536 и называется константой 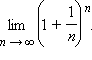 Эйлера.
Эйлера.
Определенная так функция называется экспоненциальной или просто экспонентой и обозначается у = ех ≡ exp x.
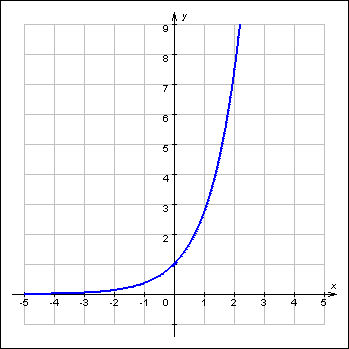
Рассмотрим график экспоненциальной функции y = ex. Так как 2 < е < 3, то функция у = ех монотонно возрастающая на всей области определения. В точке (0;1) касательная наклонена к оси абсцисс под углом 45о (π/4). Производная этой функции в нуле равна 1. Это ― единственная функция, у которой производная и первообразная совпадают с нею же самой.
Уравнение Аррениуса
 Шведский физик и химик Сванте Аррениус получил Нобелевскую премию по химии в 1903 г. за создание теории электролитической диссоциации. В своей докторской диссертации (Уппсальский университет) Аррениус высказал предположение, что такие «молекулы», как хлорид натрия, самопроизвольно распадаются в растворе, образуя ионы, которые исполняют роль реагентов при электролизе. Однако более всего Аррениус известен своим уравнением, определяющим температурную зависимость константы скорости реакции.
Шведский физик и химик Сванте Аррениус получил Нобелевскую премию по химии в 1903 г. за создание теории электролитической диссоциации. В своей докторской диссертации (Уппсальский университет) Аррениус высказал предположение, что такие «молекулы», как хлорид натрия, самопроизвольно распадаются в растворе, образуя ионы, которые исполняют роль реагентов при электролизе. Однако более всего Аррениус известен своим уравнением, определяющим температурную зависимость константы скорости реакции.
Точное соотношение между скоростью реакций и температурой Аррениус впервые установил в 1889 г. Это соотношение, получившее название уравнения Аррениуса, имеет вид
![]() ,
,
где: к ― константа скорости реакции;
А ― постоянная, характеризующая каждую конкретную реакцию (константа Аррениуса);
e ― экспонента;
Ea ― еще одна постоянная, характерная для каждой реакции и называемая энергией активации;
R ― газовая постоянная;
Т ― абсолютная температура в градусах Кельвина.
Отметим, что это уравнение связывает температуру не со скоростью реакции, а с константой скорости.
Связь скорости реакции с температурой была выведена из результатов первых кинетических исследований в 1880―1884 гг. и получила название правила Вант-Гоффа: скорость многих реакций при нагревании на 10оС увеличивается в 2―4 раза. Данное правило выполняется для относительно медленных реакций в растворах и поэтому не является универсальным. При решении некоторых задач можно пользоваться формулой Вант-Гоффа:
![]()
где: γ ― коэффициент Вант-Гоффа ( = 2―4),
Т ― температура в градусах по шкале Цельсия или Кельвина (поскольку используется разность, шкала не имеет значения).
Уравнением Аррениуса более точно и более универсально выражает зависимость константы скорости реакции от температуры. Множитель А в этом уравнении связан с частотой столкновений частиц и их ориентацией при столкновениях.
Примеры природных процессов, протекающих в соответствии с уравнением Аррениуса
Пример 1. Скорость (частота) пиликанья сверчков подчиняется, хотя и не вполне строго, уравнению Аррениуса, плавно увеличиваясь в температурном интервале от 14.2°С до 27°С, с эффективной энергией активации Ea = 51 кДж/моль. По частоте стрекотаний можно достаточно точно определить температуру: надо подсчитать их число за 15 с и прибавить 40, получится температура в градусах Фаренгейта (F) (американцы до сих пор пользуются этой температурной шкалой). Так, при 55 F (12.8°С) частота стрекотаний составляет 1 стрек./с, а при 100 F (37.8°С) ― 4 стрек./с.


Пример 2. В температурном интервале от 18°С до 34°С частота сердечных сокращений морской черепахи согласуется с уравнением Аррениуса, которое дает энергию активации Ea = 76.6 кДж/моль, но при более низких температурах энергия активации резко увеличивается. Это может быть связано с тем, что при пониженных температурах черепаха чувствует себя не очень хорошо и частота ее сердечных сокращений начинает управляться другими биохимическими реакциями.
Пример 3. Особенно интересны попытки «положить на аррениусовскую зависимость» психологические процессы человека. Так, людей с разной температурой тела (от 36.4°С до 39°С) просили отсчитать секунды. Оказалось, что чем выше была температура, тем быстрее был счет (Еа = 100.4 кДж/моль). Таким образом, наше субъективное ощущение времени подчиняется уравнению Аррениуса. Автор проведенного социологического исследования Г. Хогланд предположил, что это связано с некоторыми биохимическими процессами в мозге человека.
Немецкий исследователь Х. фон Ферстлер измерял у людей с разной температурой скорость забывания. Он давал людям последовательность разных знаков и измерял время, в течение которого люди эту последовательность помнили. Результат был тот же, что и у Хогланда: аррениусовская зависимость с Еа = 100.4 кДж/моль.
Богатый народный опыт подсказывает многие выводы, которые подтверждаются научно. На Руси издавна существует поговорка: «Держи ноги в тепле, а голову ― в холоде». Уравнение Аррениуса обосновывает это высказывание.

Зависимость скорости химических реакций от температуры
Изменение температуры оказывает резкое влияние на константу скорости, а, следовательно, и на скорость химической реакции. В подавляющем большинстве случаев скорость химической реакции с нагреванием возрастает.
В соответствии с правилом Вант-Гоффа, при повышении температуры на каждые 10 градусов скорость химической реакции возрастает, в среднем, в 2—4 раза:
v2 = v1×γ(T2-T1)/10,
где: γ - температурный коэффициент, который можно рассчитать по формуле:
γ = kT+10/kT,
где: kT — константа скорости реакции при температуре Т;
kT+10 — константа скорости реакции при температуре (Т+10).
Эксперименты
Эксперимент № 1: Взаимодействие цинка с разбавленной серной кислотой.
Взяли несколько кусочков цинка с точно известной массой и поместили в равные объемы растворов разбавленной серной кислоты различной температуры. Измерили время полного растворения цинка, проходящего в соответствии с реакцией:
Zn + H2SO4 = ZnSO4 + H2↑
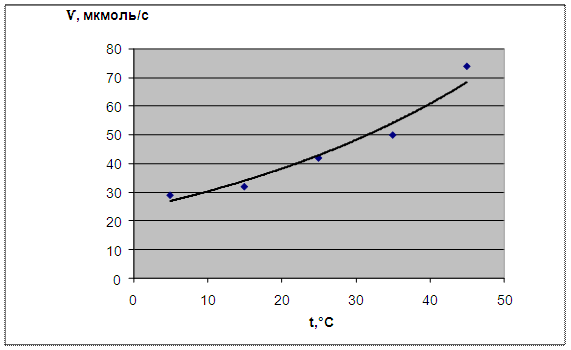
Рассчитали скорость реакции в мкмоль/с (количество вещества в моль посчитано через массу, деленную на атомную массу цинка). Результаты представлены в таблице и в виде графика зависимости скорости реакции от температуры.
Таблица 1.
t oC |
5 |
15 |
25 |
35 |
45 |
Ѵ, моль/с |
29 |
32 |
42 |
50 |
74 |


Зависимость скорости взаимодействия цинка с разбавленной серной кислотой от температуры серной кислоты:
Эксперимент № 2: Влияние температуры на скорость ферментативной реакции.
В качестве модельной ферментативной реакции мы взяли реакцию гидролиза бутирилхолина, катализируемую ферментом бутирилхолинэстеразой:
(СН3)3N+-CH2-CH2-O-C(O)-C3H7 + H2O → (СН3)3N-CH2-CH2-OH + HO-C(O)-C3H7
Трехмерная модель молекулы бутирилхолинэстеразы.
Для проведения реакции использовали планшет для иммунохимических исследований (см. рисунок 1 Приложения 1). Приготовили растворы субстрата ― бутирилхолина и фермента ― бутирилхолинэстеразы путем растворения точной навески вещества в 0.002 моль/л фосфатном буферном растворе, содержащем кислотно-основной индикатор бромтимоловый синий, с pH = 8. Индикатор имеет синюю окраску в щелочной среде (рН>7) и желтую окраску в кислой среде. Так как в результате ферментативной реакции гидролиза происходит образование кислоты, рН раствора понижается, а окраска индикатора изменяется от синей через зеленую до желтой. Таким образом, скорость химической реакции можно оценить по скорости изменения окраски индикатора.
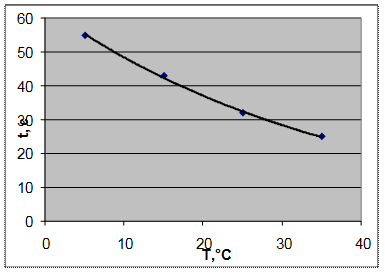
Проведение реакции. Растворы субстрата и фермента с помощью снега и водяной бани охлаждали либо нагревали до нужной температуры (5°С, 15°С, 25°С, 35°С). Максимальной температурой было выбрана температура 35°С, т. к. фермент холинэстераза имеет температурный оптимум 37°С (температура, при которой активность фермента максимальна). В ячейку планшета с помощью дозатора на 100 мкл вносили раствор фермента определенной температуры, затем 100 мкл раствора субстрата и засекали время с помощью секундомера. Измеряли время от начала реакции (момент добавления субстрата к ферменту) до изменения цвета индикатора до желтого. При каждой температуре эксперимент проводили в трех повторностях, затем рассчитывали среднее время изменения окраски.
Зависимость времени изменения окраски индикатора от температуры растворов:
 Данный метод оценки скорости реакции является вариантом каталитического метода анализа — способом фиксированной концентрации. Это способ, в котором реакцию проводят до строго определенной (фиксированной) концентрации индикаторного вещества и измеряют время достижения этой концентрации. В данной реакции индикаторным веществом является масляная кислота, от концентрации которой зависит окраска индикатора. Время достижения определенной концентрации является мерой скорости реакции. График строят в координатах: величина, обратная времени достижения фиксированной концентрации — изучаемый параметр (температура).
Данный метод оценки скорости реакции является вариантом каталитического метода анализа — способом фиксированной концентрации. Это способ, в котором реакцию проводят до строго определенной (фиксированной) концентрации индикаторного вещества и измеряют время достижения этой концентрации. В данной реакции индикаторным веществом является масляная кислота, от концентрации которой зависит окраска индикатора. Время достижения определенной концентрации является мерой скорости реакции. График строят в координатах: величина, обратная времени достижения фиксированной концентрации — изучаемый параметр (температура).
Зависимость скорости изменения окраски индикатора от температуры:

Эксперимент № 3 (расчетная задача): Скорость дегидратации этилового спирта.
Задача: Во сколько раз увеличится скорость дегидратации этилового спирта при увеличении температуры со 180оС до 200оС, если температурный коэффициент реакции равен трем?
Решение: В соответствии с правилом Вант-Гоффа, v2 = v1×γ(T2-T1)/10, отсюда
v2/v1 = γ(T2-T1)/10 , где γ = 3, Т1 = 180, Т2 = 200. Таким образом, v2/v1 = 3(200-180)/10 = 9, т. е. скорость возрастет в 9 раз при повышении температуры на 20 градусов.
По полученным данным можно построить графическую зависимость скорости дегидратации этилового спирта от температуры (при повышении температуры на каждые 10 градусов скорость реакции возрастает в 3 раза).
Зависимость скорости реакции от температуры: 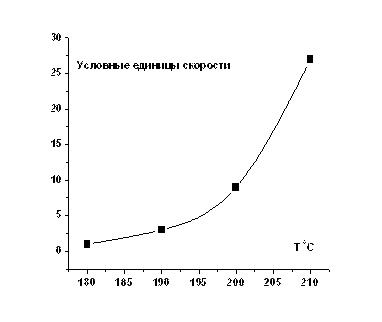
Выводы. Заключение
В процессе работы над исследовательской темой была изучена показательная функция, экспоненциальная зависимость, как частный случай показательной функции, а также уравнение Аррениуса, описывающее экспоненциальную зависимость.
После рассмотрения примеров природных процессов, протекающих в соответствии с экспоненциальной зависимостью, был проведен ряд химических экспериментов и подтверждено на практике протекание некоторых химических процессов в соответствии с экспоненциальной зависимостью, описанной уравнением Аррениуса.
Мы считаем, что гипотеза исследования «при помощи уравнения Аррениуса можно описать некоторые химические процессы» подтвердилась. Так, при растворении Zn в серной кислоте при разных температурах скорость протекания химической реакции изменяется по экспоненте. Кроме того, скорость ферментативной реакции в нейронах человеческого мозга также изменяется в зависимости от температуры в соответствии с уравнением Аррениуса.

Таким образом, было экспериментально подтверждено протекание некоторых химических процессов в соответствии с уравнением Аррениуса, описываемым экспоненциальной зависимостью.
Список литературы:
1.Лаврентьев М.А., Шабат Б.В. Методы теории функций комплексного переменного. М.: Наука, 1987. — 688 с.
2.Леенсон И.А. Почему устарело правило. Энциклопедия для детей. Т. 17. Химия. — М.: Аванта+, 2000. — 640 с.
3.Леенсон И.А. Почему и как идут химические реакции. — М.: МИРОС, 1994. — 176 с.
4.Хапланов М.Г. Теория функции комплексного переменного (краткий курс). М.: Просвещение, 1965. — 209 с.
дипломов

Оставить комментарий