Статья опубликована в рамках: I Международной научно-практической конференции ««Проба пера» ЕСТЕСТВЕННЫЕ И МАТЕМАТИЧЕСКИЕ НАУКИ» (Россия, г. Новосибирск, 25 октября 2012 г.)
Наука: Химия
- Условия публикаций
- Все статьи конференции
дипломов
ГЕОМЕТРИЯ МОЛЕКУЛ КАК КЛЮЧ К ПОЗНАНИЮ СВОЙСТВ ВЕЩЕСТВ
Филатов Никита
класс 9 «м», МАОУ СОШ № 197 г. Екатеринбурга
Чиликова Светлана Алексеевна
научный руководитель, учитель 1-й квалификационной категории, преподаватель химии МАОУ СОШ № 197 г. Екатеринбурга
Геометрия молекул непосредственно связана со строением атома. Представление о пространственном строении молекул веществ важно для химии в целом как для науки, изучающей вещества, их свойства, способы получения и использования.
Кроме того, представления о пространственном строении молекул развивают абстрактное и пространственное мышление, что становится особенно актуально в условиях современного развития науки и техники.
К сожалению, этот материал либо выводится за рамки учебных программ, либо на его изучение отводится немного времени.
Понимание взаимосвязи между строением молекулы и свойствами вещества устанавливает логику родства внешне совершенно различных явлений и помогает формировать естественнонаучное мышление.
В настоящей работе нами сделана попытка проанализировать взаимосвязь между пространственным строением молекул воды и метана и их физическими и химическими свойствами.
Вода — вещество, основной структурной единицей которого является молекула H2O. Согласно современным представлениям о строении атома, на втором — внешнем — электронном слое атома кислорода находится шесть электронов, электронная конфигурация обозначается 1ss22р4. Основываясь на теории гибридизации атомных орбиталей и метода валентных связей, пара неспаренных валентных 2p-электронов атома кислорода, находящихся в состоянии sp3-гибридизации, взаимодействует с каждым из 1s-электронов двух атомов водорода, образуя молекулу воды. На двух других sp3-гибридных орбиталях атома кислорода расположены две электронные пары, не участвующие в образовании связи. Все четыре пары электронов занимают определенные области в пространстве вокруг центрального атома кислорода в молекуле. Из-за взаимного электростатического отталкивания между связывающими и несвязывающими электронными парами, молекула воды принимает симметричную форму. На рис. 1 представлена схема перекрывания электронных орбиталей атомов кислорода и водорода при образовании молекулы воды.
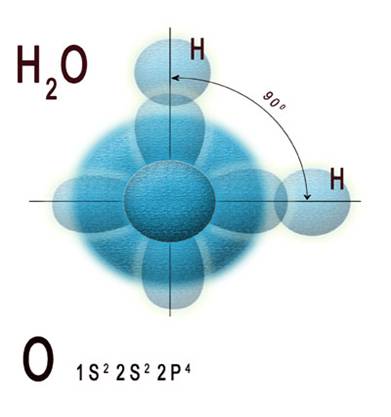
Рисунок 1. Схема перекрывания электронных орбиталей атомов водорода и кислорода в молекуле воды
Молекула воды имеет структуру, напоминающую равнобедренный треугольник, в вершине которого расположен атом кислорода, а в основании — два атома водорода. Угол при вершине составляет 104°27', а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений [1]. Схематически строение молекулы воды изображено на рисунке 2.
Молекула воды представляет собой диполь с положительно и отрицательно заряженными полюсами. Если допустить, что возможно поместить в электрическое поле отдельную молекулу воды, не связанную с другими молекулами, то она повернётся отрицательными полюсами в сторону положительного электрода, а положительными полюсами — в сторону отрицательного.
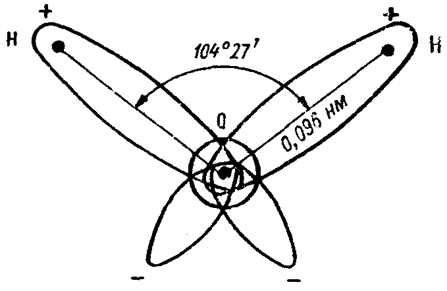
Рисунок 2. Схема молекулы воды
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов молекулы воды, получится объемная геометрическая фигура — правильный тетраэдр.
Так как молекула воды асимметрична, то центры тяжести положительных и отрицательных зарядов не совпадают. Молекулы воды имеют два полюса — положительный и отрицательный. Они, как магнит, создают молекулярные силовые поля. Такие молекулы называют полярными, или диполями (рис. 3) [2].

Рисунок3. Объёмная схема расположения гибридных орбиталей в молекуле воды
Водородные связи, как форма ассоциации между электроотрицательным атомом кислорода одной молекулы и атомами водорода других молекул, ответственны за многие уникальные свойства воды. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызывать ассоциацию молекул, то есть их объединение в димеры или полимеры [2]. Поскольку одна молекула воды может образовать до четырёх классических водородных связей с соседними молекулами, именно такое количество водородных связей объясняет аномально высокую теплоёмкость воды, её относительно высокую температуру кипения, высокие значения вязкости и поверхностного натяжения.
Из всего многообразия структур в природе базовой является гексагональная (шестигранная) структура, когда шесть молекул воды (тетраэдров) объединяются в кольцо (рис. 4 б) [5].
Попытаемся проанализировать взаимосвязь между свойствами воды и особенностями строения ее молекул. В таблице 1 представлены результаты сопоставления. Как видно из таблицы, вода обладает аномальными значениями физических характеристик, что является, вероятно, следствием особенностей строения этого вещества.
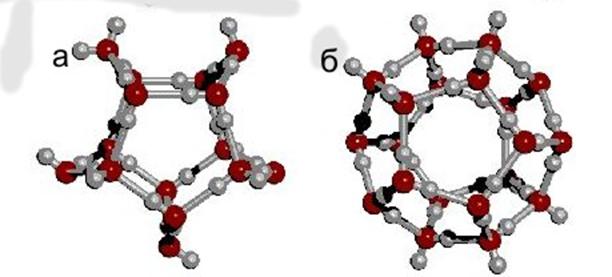
Рисунок 4. Кластеры воды
Таблица 1.
Физические свойства воды [4].
|
Свойства вещества |
Причина |
|
Вода — хороший растворитель солей, кислот, оснований, т. е. веществ, при растворении диссоциирующих на ионы |
1.Полярность молекулы воды является причиной многих её признаков, в том числе позволяет образовывать до 4 водородных связей, что в свою очередь является причиной большинства свойств воды. 2.Водородные связи, которые являются причиной образования кластеров, обеспечивают все эти свойства воды |
|
Показатель диссоциации: pKa = 15,7 (20 оC, вода) |
|
|
Диэлектрическая проницаемость 78,3 Ф/м. при 25 °C |
|
|
Дипольный момент молекулы 1,84 ЭДМ при 20 °C |
|
|
Температура плавления 0 °C |
|
|
Температура кипения 100 °C |
|
|
Удельная теплоемкость 4,2174 Дж/(г•К) |
|
|
Плотность: 1 г/см3 (при 4 °C) |
|
|
Поверхностное натяжение 75,62 мН/м при 0 °C |
Рассмотрим строение другого вещества. Метан — простейший углеводород, химическая формула которого CH4. Как и молекула воды, это вещество состоит из элемента, связанного с несколькими атомами водорода. Но при сходстве состава молекул метана и воды, свойства у этих веществ различны.
Попытаемся найти объяснение этому факту в особенностях строения молекулы метана [3].
Атом углерода на внешнем электронном слое имеет 4 электрона, электронная формула 1ssp2. Казалось бы, что здесь мы сталкиваемся с противоречием — неспаренными являются только 2 р-электрона, а s-электроны спарены, но при этом все химические связи С-Н в молекуле метана совершенно одинаковы по длине и энергии. Поскольку химические связи, как правило, устанавливаются за счет неспаренных электронов, молекула метана должна иметь формулу CH2, что не соответствует действительности. Это противоречие устраняется трактовкой образования химических связей за счет гибридизованных электронных орбиталей.
Когда атом углерода вступает во взаимодействие с атомами водорода, спаренные s-электроны его наружного слоя разделяются, один из них занимает свободное место на р-орбитали и при движении образует облако в виде объемной восьмерки, перпендикулярное по отношению к облакам двух других p-электронов. Атом переходит в возбужденное состояние, и электронная формула его может быть записана как 1ss12p3.
Теперь все четыре валентных электрона являются неспаренными и могут образовывать четыре химические связи.
При этом возникает новое противоречие. Теоретически, три p-электрона должны образовать три химические связи с атомами водорода во взаимно перпендикулярных направлениях, т. е. под углом 90 °, а четвертый атом водорода мог бы присоединяться в произвольном направлении, так как облако s-электрона имеет сферическую форму. Такие связи, очевидно, отличались бы по свойствам. Между тем известно, что все связи C—H в молекуле метана одинаковы и расположены под углом 109°28'. Объяснить это противоречие помогает понятие о гибридизации электронных орбиталей атома углерода — смешивании и выравнивании орбиталей по форме и энергии (рис. 5).

Рисунок 5. Гибридизация электронных орбиталей атома углерода в молекуле метана
Итак, у метана четыре гибридные орбитали атома углерода в пространстве образуют геометрическую фигуру тетраэдр, углы между осями связей С—Н равны 109°28'. Такое валентное состояние атома углерода называется sp3-гибpидизaция. Пространственное расположение атомов в молекуле метана можно показать с помощью тетраэдрических и шаростержневых моделей. На рис.6 изображены шаростержневые модели молекулы метана. Как видно из рисунка, модель молекулы метана вписывается в тетраэдр [7].
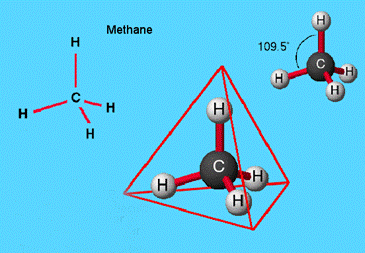
Рисунок 6. Шаростержневые модели молекулы метана
В таблице 2 представлены физические свойства метана. Как видно из представленных данных, неполярность молекулы метана является причиной слабых межмолекулярных связей, как следствие — низких температур кипения и плавления.
Таблица 2.
Физические свойства метана.
|
Свойства вещества |
Причина |
|
Плотность: 0,436, г/см3 при — 170 °C |
Гибридизация атомных орбиталей атома углерода обеспечивает равнозначность всех четырех ковалентных связей между атомом углерода и атомами водорода, и как следствие – неполярность молекулы метана. |
|
Удельная теплоемкость при постоянном давлении 2,22 Дж/г K |
|
|
Температура плавления — 182,48 °C |
|
|
Температура кипения — 161,49 °C |
|
|
Диэлектрическая проницаемость: 1,7 ф/м — при 173 °C |
|
|
Дипольный момент молекулы (в дебаях): 0 при 20 °C |
В таблице 3 нами проведено сравнение молекул воды и метана и особенностей межмолекулярного взаимодействия.
Таблица 3.
Сравнение особенностей молекул и межмолекулярного взаимодействия метана и воды
|
Свойство молекул(ы) |
вода |
метан |
|
Состав молекулы |
Н2О |
СН4 |
|
Молекулярная масса (относительная в а. е. м.) |
18 |
16 |
|
Полярность молекулы |
Диполь |
Молекула неполярна |
|
Межмолекулярная (водородная) связь |
Сильная, требуется большая энергия , чтобы её разрушить |
Слабая, молекулы метана почти не взаимодействуют друг с другом |
|
Экранирование ядра |
Отсутствует |
Полное экранирование ядра |
|
Схемы образования химических связей в молекулах и пространственное расположение орбиталей |
|
|
Сравнивая строение молекул воды и метана и их свойства, можно сделать некоторые выводы.
Молекула метана так же, как и молекула воды, в пространстве образует тетраэдр. Однако, в отличие от молекулы воды, молекула метана не имеет полярности. Гибридные орбитали внешнего электронного слоя атома углерода перекрыты s- орбиталями атомов водорода и все четыре химические связи равноценны [6].
Полярность молекул воды определяет возможность образования водородных связей между молекулами воды, что обуславливает специфические физические и химические свойства воды. Каждая молекула воды подобно маленькому магниту притягивает к себе за счет образования водородных мостиков еще четыре молекулы. При испарении воды разрушение этих многочисленных водородных связей требует больших затрат энергии, и как следствие — высокое значение поверхностного натяжения. Высокая точка кипения воды является следствием высокой теплоемкости испарения, что в свою очередь обусловлено неравномерным распределением электронной плотности в молекуле воды.
Молекулы метана неполярны и относительно слабо взаимодействуют друг с другом. Вследствие этого жидкий метан испаряется при очень низких температурах. Молекулы метана не могут собирать устойчивые структуры и метан газообразен. Неполярность молекул метана объясняет также тот факт, что метан плохой растворитель.
Таким образом, мы делаем вывод о том, что именно строение молекул метана и воды обуславливает различие в их свойствах, и, следовательно, можно предположить, что свойства любых веществ напрямую зависят от строения молекул. Понимание теоретических основ строения веществ является ключом к пониманию свойств, разработке способов получения и использования веществ современными учеными.
Список литературы
1.Геометрия молекул / [Электронный ресурс] — Режим доступа — URL: http://images.yandex.ru (дата обращения октябрь 2012 г.).
2.Гиллеспи Р. Геометрия молекул. Москва, Изд. «Мир», 1975, 282 с.
3.Метан и его свойства / [Электронный ресурс] — Режим доступа — URL: www.rabbit.narod.ru/chem/metan.htm (дата обращения октябрь 2012 г.).
4.О воде // [Электронный ресурс] — Режим доступа — URL: http://www.o8ode.ru/article/water/ (дата обращения октябрь 2012 г.).
5.Строение молекулы воды // [Электронный ресурс] — Режим доступа — URL: http://www.meanders.ru/meiers2.shtml (дата обращения октябрь 2012 г.).
6.Химия // [Электронный ресурс] — Режим доступа — URL: http://himiy.ucoz.ru/index/0-9 (дата обращения октябрь 2012 г.).
7.Цветков Л.А. Эксперименты по органической химии в средней школе. Москва, Изд. «Школьная Пресса», 2000, 193 с.
дипломов



Комментарии (1)
Оставить комментарий