Статья опубликована в рамках: XXVI Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 12 января 2015 г.)
Наука: Биология
Секция: Биологические аспекты сельского хозяйства
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
РАЗВИТИЕ АРБУСКУЛЯРНОЙ МИКОРИЗЫ (GLOMUS FASCICULATUM) В КОРНЯХ СОРГО (SORGHUM SUDANENSE)
Чайковская Людмила Александровна
д-р с.-х. наук Главный научный сотрудник Института сельского хозяйства Крыма, РФ, Республика Крым, г. Симферополь
THE DEVELOPMENT OF GLOMUS FASCICULATUM IN ROOTS OF SORGHUM SUDANENSE
Ludmila Tchaikovskaya
doctor of Agricultural Science, Chief Research Scientist, the Crimea Institute of Agriculture, Russia, Republic of Crimea, Simferepol
АННОТАЦИЯ
Исследовано развитие структур Glomus fasciculatum в корнях сорго с целью получения инокулюма. Окраска структур арбускулярной микоризы (АМ) в корнях растений и определение частоты встречаемости микоризной инфекции проведено по методикам Крюгер и соавторов. Установлено, что насыщенность структур эндофита в корнях достигала 90 %. В коре корней сорго выявлены хорошо развитые структуры АМ: мицелий, арбускулы и везикулы. Таким образом, подобрано растение-хозяин для культивирования АМ.
ABSTRACT
The development of Glomus fasciculatum structures in roots of sorgo to produce inoculum is investigated. The colouring of Glomus fasciculatum in the roots of plants and determining the frequency of occurrence of mycorrhizal infection are carried out according to the Kruger and co-authors’ methods. It is found that saturation of endophyte structures in roots reached 90%. In the cortex of sorgo roots well-developed structure of Glomus fasciculatum is revealed: mycelium, arbuscula and vesicles. Thus, the host plant for cultivation Glomus fasciculatum is chosen.
Ключевые слова: арбускулярная микориза; сорго.
Keywords: arbuscular mycorrhiza; sorgo.
Применение АМ — это один из перспективных приемов, способствующий оптимизации питания сельскохозяйственных растений и повышающий их устойчивость к стрессовым факторам. Влияние АМ на растения многогранно: оно проявляется в улучшении минерального, особенно фосфорного питания и увеличении их продуктивности, повышении интенсивности фотосинтеза и устойчивости растений к почвенным патогенам, тяжелым металлам, токсическим солям [9, с. 437; 5, с. 124].
Экологическая ниша АМ — клетки коры корней растений. В связи с этим, не смотря на повсеместное распространение эндофитов, инокуляция растений селекционными штаммами как правило эффективна, особенно на мало окультуренных почвах. Однако сложность практического применения АМ состоит в том, что они являются облигатными симбионтами. Именно это обстоятельство определяет форму инокулюма: его до сих пор получают в симбиозе с растениями. Изначально использовали почвенно-корневые смеси, насыщенные определенными эндофитами. Отсутствие технологичности ограничивало возможности применения этих смесей. Потому одновременно в разных странах проведены исследования по разработке биопрепаратов на основе АМ с использованием различных субстратов, обеспечивающих оптимальное развитие растений [1, с. 108—128; 7, с. 26; 8, с. 1264—1271]. В качестве субстрата используют торф, песок, керамзит, бетонит, перлит, вермикулит в чистом виде или в смеси. Исследователями создан также препарат на основе микоризованных корней растений, заключенных в капсулы альгината [10, с. 614—616]. Основой перечисленных биопрепаратов являются культуры эффективных АМ и растения, в корнях которых происходит размножение эндофитов. В качестве тест-объектов используют чувствительные к микоризации растения, способные формировать хорошо развитую корневую систему в течение короткого промежутка времени. Микоризованные корни этих растений, ввиду отсутствия специфичности эндофитов, могут применяться в качестве инокулюма для различных сельскохозяйственных культур.
Цель исследования. Учитывая вышеизложенное, нами исследовано развитие структур АМ (на примере Glomus fasciculatum) в корнях сорго с целью получения инокулюма для микоризации растений.
Методика исследований. В качестве субстрата для выращивания растений использован простерилизованный вермикулитный песок. Вегетационные опыты проведены в теплице, растения сорго Sorghum sudanense (Piper.) Stapf. выращивали в сосудах объемом 6 литров. Подкормку растений проводили каждые две недели с использованием раствора Прянишникова.
В качестве основы для получения инокулюма АМ использован Glomus fasciculatum: G. fasciculatus штамм Ново-Зеландский, полученный из коллекции Всероссийского научно-исследовательского института сельскохозяйственной микробиологии.
Вегетационные опыты проведены согласно указаниям, изложенным в методических рекомендациях [3, с.44; 4, с. 24]. В лабораторных опытах (5-кратная повторность) проведена окраска структур АМ и определена частота встречаемости (F) микоризной инфекции в корнях по методикам Крюгер и соавторов [2, с. 69—80]. Изучение развития структур АМ в корнях проведено с помощью МБС-9.
Результаты и их обсуждение. В лабораторных опытах детально изучено этапы развития структур АМ в корнях сорго. Анализ результатов исследований свидетельствует о том, что в корнях молодых растений сорго (четвертая неделя культивирования) не выявлено развития структур АМ. Мицелий эндофита G. fasciculatum обнаружен в корнях сорго только после пяти недель культивирования растений. Частота встречаемости АМ в корнях в это время составляла 30 % (Таблица).
Таблица 1.
Насыщенность АМ (Glomus fasciculatum) и развитие его структур в корнях сорго в условиях вегетационных опытов
|
Срок культивирования |
Развитие структур |
F, % |
|
четвертая неделя |
не выявлено |
- |
|
шестая неделя |
молодой мицелий |
30 |
|
восьмая неделя |
хорошо развитый мицелий, арбускулы, молодые везикулы |
65 |
|
десятая неделя |
хорошо развитый мицелий, арбускулы, везикулы |
80 |
|
двенадцатая неделя |
хорошо развитый мицелий, арбускулы, везикулы |
92 |
В конце восьмой недели культивирования растений в коре корней сорго выявлены хорошо развитые мицелий, арбускулы и молодые везикулы; насыщенность структур АМ в коре корня составляет 65 %.
По истечению десятой недели выращивания сорго насыщенность структур эндофита в корнях достигает 80 %, на двенадцатую неделю — 92 %. В коре корней обнаружены хорошо развитые мицелий, арбускулы и сформированные везикули.
Результаты исследований показали, что уже на седьмую неделю культивирования в корнях сорго развиваются наружный мицелий и арбускулы
G. fasciculatum . На восьмую неделю развития растений сорго в коре корней обнаружены молодые везикулы АМ (рис. 1).

Рисунок 1. Развитие структур Glomus fasciculatum в корнях сорго: начало образования везикул; × 20
Позже в корешках растений появляются хорошо развитые везикулы (рис. 2).

Рисунок 2. Развитие структур Glomus fasciculatum в корнях сорго: хорошо развитые везикулы, мицелий; × 20
В конце десятой недели культивирования сорго в корнях присутствуют хорошо развитые структуры АМ (рис. 3).
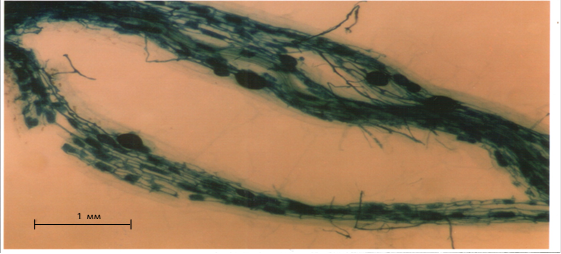
Рисунок 3. Развитие структур Glomus fasciculatum в корнях сорго: везикулы, арбускулы, мицелий; × 20
После завершения развития структур АМ и достижения высокой частоты встречаемости микоризной инфекции в корнях у растений срезали наземную часть и освобождали корни из вермикулита. Высушенные корни измельчали. Таким образом мы получили инокулюм на основе Glomus fasciculatum.
Использование полученного инокулюма в условиях полевых опытов показало, что предпосевная микоризация семян пшеницы озимой позволяет повысить зерновую продуктивность на 5—8 % при выращивании в условиях орошения на черноземе южном [6, с. 69].
Заключение. Изучение развития структур АМ (Glomus fasciculatum) в корнях сорго Sorghum sudanense (Piper.) Stapf. показало, что в конце десятой недели культивирования растений насыщенность эндофита в корнях достигала 80 %, а после двенадцати недель — 92 %. В коре корней сорго выявлены хорошо развитые структуры АМ: мицелий, арбускулы и везикулы. Полученные результаты свидетельствуют о перспективности применения сорго в качестве растения-хозяина с целью получения АМ инокулюма.
Список литературы:
1.Базилинская М.В. Биоудобрения. Зарубежная информация. М: ВО Агропромиздат, 1989. — С. 108—128.
2.Крюгер Л., Селиванов И., Нозадзе Л. К методике определения обилия грибов в эндофитных микоризах и способах количественной характеристики микосимбиотрофизма в растительных ассоциациях // Ученые записки Пермского государственного педагогического института. Пермь, 1968. — С. 69—80.
3.Лабутова Н.М. Методы исследования арбускулярных микоризных грибов: методические рекомендации. СПб: Изд-во Санкт-Петербуржского университета, 2000. — 23 с.
4.Методы исследования грибов, образующих с растениями микоризу арбускулярно-везикулярного типа. Под ред. Г.С. Муромцева. СПб: ВНИИСХМ, 1992. — 44 с.
5.Смит С.Э., Рид Д.Дж. Микоризный симбиоз. Пер. с 3-го англ. издания. М: Товарищество научных изданий КМК, 2012. — 776 с.
6.Chaikovskaya L. Effect of endomycorrhiza on the winter wheat productivity in the conditions of Crimea irrigated lands // Proc. 19th European Regional conference of ICID. Brno and Prague, 2001. — Р. 69.
7.Dehne H.-W. Production and use of inocula of VA mycorrhizal f ungi at inorganic carrier materials // 2nd Europ. Symp. оn Mycorrhizae.: Abstr. Prague, 1988. — Р. 26.
8.Gianinazzi S., Vosatka M. Inoculum of arbuscular mycorrhizal fungi for production systems: science meets business // Canadian Journal of Botany. — 2004. — Vol. 82. — P. 1264—1271.
9.Jakobsen I., Legget M.E., Richardson A.E. Rhizosphere microorganisms and Plant phosphorus uptake // Phosphorus: Agriculture and Environment. Мadisson: American Society of Agronomists, Crop Society of America, Soil Science Society of America, 2005. — P. 437—494.
10.Plenchette C., Strullu D.G. Long-term viability and infectivity of intraradical forms of Glomus intraradices vesicles encapsulated in alginate beads // Mycological Researches. — 2003. — Vol. 107. — P. 614—616.
дипломов


Комментарии (1)
Оставить комментарий