Статья опубликована в рамках: XXV Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 03 декабря 2014 г.)
Наука: Химия
Секция: Физическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
КИНЕТИКА РЕАКЦИИ КАМФЕНА С ДИМЕТИЛЦИАНАМИДОМ ПРИ КАТАЛИЗЕ ГЕТЕРОПОЛИКИСЛОТОЙ H 4SIW12O40
Архипова Анна Викторовна
канд. хим. наук, доцент АПИ НГТУ, РФ, г. Арзамас
E-mail:
KINETICS OF REACTION OF CAMPHENE WITH DIMETHYLCYANAMIDE IN THR PRESENCE OF
HETEROPOLY ACID H4SIW12O40
Anna Arkhipova
candidate of Chemical Sciences, associate professor of Arzamas Polytechnic Institute (branch) of Nizhny Novgorod State Technical University n.a. R .E. Alekseev (NSTU), Russia, Arzamas
АННОТАЦИЯ
Представлены кинетические данные реакции камфена с диметилцианамидом при катализе гетерополикислотой H4SiW12O40. Приведены термодинамические параметры активации данной реакции.
ABSTRACT
The article presents the kinetic data of the reaction of camphene with dimetylcyanamide in the presence of heteropoly acid H4SiW12O40. Given the thermodynamic parameters of activation for this reaction.
Ключевые слова: камфен; диметилцианамид; гетерополикислота; кинетика; термодинамические параметры активации реакции.
Keywords: camphene; dimetylcyanamide; heteropoly acid; kinetics; thermodynamic parameters of activation for reaction.
Введение
Ранее [1, с. 374—376] сообщалось о получении N-замещенных амидов в реакции Риттера при катализе гетерополикислотами H3PW12O40, H7PMo12O42 и H4SiW12O40. В качестве нитрильных субстратов использовали: ацетонитрил, бензонитрил, акрилонитрил, пропионитрил, 1-нафтонитрил, а алкилирующим реагентом служил камфен. Была исследована кинетика реакции камфена и изоборнеола с ацетонитрилом при катализе вольфрамато- и молибдатофосфорной кислотами [2, с. 53—60].
При взаимодействии камфена с диметилцианамидом при катализе гетерополикислотами с высоким выходом (55 %) образуется N,N-диметил-N-изоборнилмочевина [3, с. 21—22]:
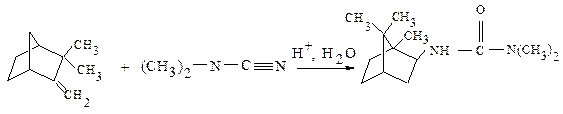
В настоящей работе приводятся результаты кинетических исследований реакции камфена в избытке диметилцианамида при катализе H4SiW12O40.
Экспериментальная часть
В работе использован коммерческий препарат Н4SiW12O40∙19H2O квалификации х. ч., который для удаления кристаллизационной воды нагревали 2 часа в вакууме при температуре 100–1500С. Исходный оптически активный камфен {![]() + 12.5о (с 11.6, СНCI3)}, который по данным ГЖХ содержит 10 % трициклена, доводили до чистоты не менее 99 % перекристаллизацией из EtOH, т.пл. 50 оС (ср. лит. [4, с. 704—705]: 50 0С). Коммерческий препарат диметилцианамида марки «х. ч.» с чистотой 99 % использовали без дополнительной очистки. Диэтиловый эфир и этиловый спирт марки «х. ч.» очищали по известным методикам [5, с. 362, 376].
+ 12.5о (с 11.6, СНCI3)}, который по данным ГЖХ содержит 10 % трициклена, доводили до чистоты не менее 99 % перекристаллизацией из EtOH, т.пл. 50 оС (ср. лит. [4, с. 704—705]: 50 0С). Коммерческий препарат диметилцианамида марки «х. ч.» с чистотой 99 % использовали без дополнительной очистки. Диэтиловый эфир и этиловый спирт марки «х. ч.» очищали по известным методикам [5, с. 362, 376].
Методика проведения кинетических исследований . Реакцию проводили в стеклянном термостатированном реакторе, снабженном обогреваемой рубашкой и обратным холодильником. Кинетические исследования проводили при температуре 65 0C до степени конверсии камфена 65 %.Температуру в реакторе поддерживали постоянной с точностью ±0,2 0С.
H4SiW12O40 вводили в систему в виде раствора в диметилцианамиде, предварительно к катализатору добавив необходимое количество воды (мольное соотношение катализатор : вода равное 1:14). Через определенные промежутки времени, после начала реакции реакционную смесь быстро охлаждали, продукты реакции дважды экстрагировали диэтиловым эфиром в объеме, равном половине объема водной фазы. Объединенную органическую фракцию нейтрализовали 10%-ным раствором NaOH. Затем промывали водой до нейтральной реакции водной вытяжки. Далее пробу сушили над Na2SO4 в течение 24 часов.
После удаления избытка растворителя продукты реакции анализировали методом ГЖХ. Хроматографический анализ вели на хроматографе «Chrom 5» с пламенно-ионизационным детектором, колонкой 30000×10 мм со стационарной фазой ПФМС-4 (15 %) на Хроматоне N-AW-DMSO (0,20—0,25 мм), температурой термостата 180—190 0С, температура испарителя 200 0С, давление газа-носителя азота 2,5 атм.
Расчет количества компонентов реакционной смеси осуществляли методом внутреннего стандарта {N-(1,7,7-триметилнорборнил)пропионамид}. Относительная погрешность единичного анализа при доверительной вероятности 0,95 лежит в пределах ±2 %. За результат анализа принимали среднее значение 5—8 параллельных опытов.
ТСХ проводили на силикагеле марки LSL 5 /40.
Скорость реакции определяли по изменению концентрации продукта реакции — N,N-диметил-N-изоборнилмочевины, выраженную через молярность в единицу времени.
Результаты и их обсуждение
В ходе проведенных исследований было установлено, что скорость реакции удовлетворительно описывается кинетическим уравнением с общим вторым порядком, первым по каждому из реагентов. Полученные кинетические данные (табл. 1) представлены на рис. 1, из которого видно, что зависимость k2 от концентрации катализатора является линейной.
Таблица 1.
Кинетические данные реакции камфена с диметилцианамидом при катализе H 4SiW12O40 ([>С=C<]0 = 0,1 моль/л, 65 0С)
|
[Kt ], моль/л |
0,01 |
0,025 |
0,035 |
0,045 |
|
k 1·105, c-1 |
2,50±0,11 |
4,54±0,17 |
6,44±0,31 |
8,27±0,33 |
|
k 2·106, моль-1 ·л·с-1 |
3,22±0,13 |
6,58±0,33 |
9,84±0,49 |
13,30±0,66 |
|
km ·104, моль-2·л2·с-1 |
2,22±0,11 |
|||
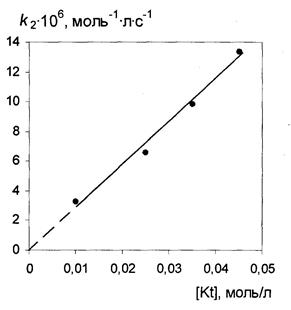
Рисунок 1. Зависимость константы скорости (k 2) от концентрации H4SiW12O40 в реакции диметилцианамида с камфеном (65 0С) km = (2,22±0,11)·10-4 моль-2 ·л2·с-1
Для выяснения энергетических характеристик реакции была исследована зависимость lnkm от 1/T в интервале температур 35—65 0С. На основании этих данных получено уравнение корреляции:
lnkm = 11,19 – 7,03/T; R2 = 0,997; S = 0,0014
и найдена энергия активации 50,43 кДж/моль. Стандартная энтропия активации (–166,4 кДж/моль) найдена из зависимости lnkm/T от 1/T (в интервале температур 35—65 0С) согласно уравнению корреляции:
lnkm/T = 4,4 – 6,7/T; R2 = 0,997; S = 0,518·10-3.
Энергетические параметры данной реакции приведены в табл. 2 (km найдена для одной концентрации катализатора равной 0,035 моль/л). Обращает на себя внимание очень низкая энергия активации и очень высокое отрицательное значение энтропии активации.
Таблица 2.
Параметры уравнения Аррениуса и энтропия активации реакции камфена с диметилцианамидом (катализатор H 4SiW12O40)
|
Т, 0С |
km ·104, моль-2 ·л2·с-1 |
E a, кДж/моль |
A , моль/л·c |
ΔS ≠, Дж/моль·К |
∆G≠, кДж/моль |
|
65 |
2,22±0,11 |
50,43±3,1 |
1,43·104 |
–166,4±10,2 |
103,8±5,2 |
|
55 |
1,72±0,09 |
||||
|
45 |
0,83±0,04 |
||||
|
35 |
0,41±0,02 |
Прежде чем провести анализ кинетических данных отметим, что в диметилцианамиде аминная группа находится в n,π–сопряжении с циангруппой, что приводит к снижению донорных (основных) свойств первой и усилению реакционной способности по отношению к электрофилам последней:
![]()
Диалкилзамещенные амины даже при наличии в своем составе сильных электроноакцепторных групп (в качестве третьего заместителя) обладают достаточно высокими донорными свойствами. Поэтому не исключено, что протонные центры катализатора могут взаимодействовать с диметиламинной группой субстрата. Однако, более вероятным представляется взаимодействие кислотных центров с активированной циан-группой, приводящее к образованию ионной пары, в которой положительный заряд делокализован на трех атомах диметилцианамида:


Такое распределение электронной плотности может обеспечивать достаточную устойчивость катиона ионной пары, вследствие чего при большом избытке реагента подавляющая часть кислотных центров будет находиться в связанном состоянии. В этом случае концентрация ионной пары практически становится равной общей концентрации катализатора, что приводит к линейной зависимости константы скорости, представленной на рис. 1.
Как следует из данных (табл. 2) для этой реакции характерно самое низкое значение энергии активации среди изученных реакций и более высокое отрицательное значение энтропии активации [2]. Отсюда вытекает, что переходное состояние в данной реакции еще более структурированное, за счет участия в переходном состоянии растворителя. Поскольку каталитическими центрами являются ионы, в которых протон связан с нитрильной группой, для протонирования субстрата (камфена) необходимо значительное участие растворителя, по-видимому, воды. Но в целом свободная энергия активации близка к таковым для реакции с нитрилами.
Выводы
1. Реакция камфена с диметилцианамидом является реакцией общего второго порядка, первого по каждому реагенту.
2. Установлена линейная зависимость константы скорости от концентрации катализатора.
Список литературы:
1.Карташов В.Р., Архипова А.В., Малкова К.В., Соколова Т.Н. Получение N-замещенных амидов в реакции Риттера с использованием гетерополикислот в качестве катализаторов // Изв. АН. Сер. хим. — 2006. — № 2. — С. 374—376.
2.Архипова А.В., Соколова Т.Н., Карташов В.Р. Кинетика реакции камфена и изоборнеола с ацетонитрилом при катализе вольфрамато- и молибдатофосфорной кислотами // Химия растительного сырья. — 2007. — № 4. — С. 53—60.
3.Малкова К.В. Гетерополикислоты — катализаторы реакций бициклогептанов и третичных спиртов с нитрилами и тиоцианатами // Автореф. дисс. на соиск. уч. степ. канд. хим. наук. Нижегород. гос. техн. ун-т. Нижний Новгород. 2008. — 24 с.
4.Справочник химика // Под ред. Б.П. Никольского. 2-е изд., перераб. М: Химик. 1964. — 1157 с.
5.Organikum. Organish-chemisches Grundprakukum. Berlin. 1976. — 442 p.
дипломов


Оставить комментарий