Статья опубликована в рамках: VIII Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 06 июня 2012 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
КОНФОРМАЦИОННЫЕ ОСОБЕННОСТИ ЭПИМЕРОВ ПО С2 И С4 N-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ 2-МЕТИЛ-4-ФЕНИЛЭТИНИЛ-4-ГИДРОКСИ-ТРАНС-ДЕКАГИДРОХИНОЛИНОВ
Турмуханова Миргуль Журагатовна
д-р хим .наук, доцент КазНУ им. аль-Фараби, г. Алматы
E-mail: t_mirgul@mail.ru
Абилов Жарылкасын Абдуахитович
д-р хим .наук, профессор КазНУ им. аль-Фараби, г. Алматы
E-mail: abilovs51@mail.ru
Келжанова Назкен
PhD докторант КазНУ им. аль-Фараби, г. Алматы
E-mail: nazken.81@mail.ru
В результате исследования зависимости обезболивающих свойств от природы алкильного заместителя в структуре бензоатов 2-метил-декагидрохинолин-4-олов установлено, что лучшими при терминальной анестезии являются бензоаты N-аллил-2е-метил-цис-4е-гидрокси-декагидрохинолина и N-аллил-2е-метил-транс-4е-гидрокси-декагидро-хинолина. Положительным свойством указанных препаратов является также их более низкая, чем у новокаина токсичность [1, c. 3, 2].
С целью синтеза потенциально биологически активных веществ и изучения влияния гидроксигруппы, фенилэтинильного и аллильного радикала на конформационное и конфигурационное строение декагидрохинолина была проведена реакция алкенилирования индивидуальных изомеров 2е-метил-4-фенилэтинил-4-гидрокси-транс-декагидрохинолинов (3, 4) и 2а-метил-4-фенилэтинил-4-гидрокси-транс-декагидрохинолинов (5, 6), полученных конденсацией (1,2) с фенилацетиленом [3].
Все соединения получены с высокими выходами (таблица 1). Строение синтезированных соединений (7—10) доказаны на основании данных ИК-, ПМР-спектроскопии и масс-спектрометрии. ИК-спектры соединений (7—10) сняты в виде таблеток в KBr (таблица 1).

ПМР-спектры соединений (7—0) записаны в дейтерированном метаноле и хлороформе. Данные приведены в таблице 2.
Соединения (7—10) имеют соответствующее число сигналов протонов. Самыми низкопольными сигналами протонов синтезированных соединений являются мультиплеты пяти фенильных протонов с химическими сдвигами около 7,36 и 7,30 м. д.
Далее по спектрам при смещении в область все более высокого поля появляются сигналы протонов при С13 в виде дублетов дублетов триплетов с центрами около 6,00 и 5,96 м. д. для соединений (7—10) соответственно и расщеплением 17,1, 10,3 и 6,7 Гц.
Таблица 1
Физико-химические и ИК-спектральные характеристики соединений (7—10)
|
Соединение |
Частоты колебаний групп, n см-1 |
Физико-химические характеристики |
||||||
|
OH |
CH (CH3) |
C-O |
С=С |
СºС |
Ph- |
Т.пл., °С |
Выход, % |
|
|
7 |
3410 |
2858-2988 |
1076 |
1639 |
2220 |
693, 756, 1445, 1597, 3078 |
105-107 |
88,9 |
|
8 |
3280 |
2800-2979 |
1078 |
1639 |
2229 |
692, 754, 1446, 1598, 3059 |
127-128 |
90,0 |
|
9 |
3410 |
2858-2988 |
1076 |
1639 |
2220 |
693, 756, 1445, 1597, 3078 |
90-92 |
98,9 |
|
10 |
3280 |
2800-2979 |
1078 |
1639 |
2229 |
692, 754, 1446, 1598, 3059 |
134-136 |
95,0 |
В этой же области с чуть меньшими химическими сдвигами (5,25 и 5,23 м. д.) в спектре соединения (7) находятся сигналы протонов при С14 в виде дублетов дублетов с константами 17,1 и 0,8 Гц. Для соединения (8) сигналы этих же протонов находятся примерно в той же области (5,24 м. д. и 5,21 м. д.) и с примерно такими же константами спин-спинового взаимодействия (17,2 и 0,8 Гц).
Сигналы в области 3,55 и 3,44 м. д. (34) и 3,52 и 3,43 м. д.в в виде дублетов дублетов с расщеплением в 16,3 и 6,7 Гц, а также 10,3 и 6,7 Гц были отнесены к протонам при С12. Дублет квартетов дублетов с центром около 3,00 м. д. и расщеплением 11,8, 6,2 и 2,5 Гц (34) и 3,00 м. д. с расщеплением 11,8, 6,2 и 2,3 Гц (2.212) является сигналом протонов при С2. Характер расщепления и форма сигнала указывают на аксиальную ориентацию протона, что, в свою очередь, подтверждает экваториальную ориентацию метильной группы при С2. Рядом с сигналами этого протона находится триплет дублетов с центром около 2,58 м. д. и расщеплением в 10,3 и 3,3 Гц (34) и 2,50 м. д. с расщеплением в 11,0 и 3,3 Гц (7), отнесенный к сигналу протона при С9, который находится в аксиальном положении. Сигнал протона при С10 также имеет аксиальную ориентацию (триплет дублетов с центром 1,49 м.д. и расщеплением 11,7 и 2,2 Гц) для соединения 34 и (триплет дублетов с центром 1,39 м.д. и расщеплением 12,0 и 2,0 Гц), что в совокупности подтверждает транс-сочленение пиперидинового и циклогексанового колец.
Для соединений (7-10) были также записаны спектры корреляционной спектроскопии COSY, спектры HMBC и HSQC. В спектре COSY наблюдаются обычные, как и в спектре ПМР, геминальные и вицинальные спин-спиновые взаимодействия. Единственным исключением является взаимодействие протонов 12 и 14 через четыре связи. В спектре ПМР оно проявляется только у одной, чистой компоненты дублета 14trans. В сигналах протонов 12 СН2, хотя и имеются признаки слабого расщепления (несимметричные вершины пиков), но количественно они не могут быть оценены. Кроме того, нельзя исключать и слабого геминального взаимодействия протонов 13 и 14, однако спектр COSY не позволяет их идентифицировать. По спектру COSY определены химические сдвиги высокопольных протонов.
В спектре NOESY имеются все соответствующие структуре соединения (7) взаимодействия близко расположенных валентно-несвязанных атомов водорода.
В спектре NOESY также имеются все соответствующие структуре соединения (8) взаимодействия близко расположенных валентно-несвязанных атомов водорода (рисунок 1). В таблице 3 приведены взаимодействия атомов водорода аллильного заместителя при азоте с близко расположенными атомами водорода циклической системы.

Рисунок 1. Пространственное строение и химические сдвиги 13С (7)
На основании данных, приведенных в таблицах (2,3) можно сделать вывод о том, что соединение находится предпочтительно в конформации «А» (рисунок 2), где заместитель при С12 занимает положение в створе угла 2а-N-n-пара, при этом он несколько отклонен в сторону n-пары вследствие отталкивания метильной группой (эффективный объем n-пары значительно меньше объема СН3).
Таблица 2
Химические сдвиги протонов и константы спин-спинового взаимодействия соединений (7, 8)
|
Соеди- нение
|
Р, Т, n |
Химические сдвиги протонов, d, м.д., мультиплетность, (КССВ, J, Гц) |
||||||||
|
2а |
3е |
3а |
5е |
5а |
6е |
6а |
7е |
7а |
||
|
7 |
MeOD-d4 300,13 |
3,00 д11,8 к(6,2) д(2,5) |
2,04 д(13,7) д(2,6) |
1,81 д(13,7) д (11,8) |
2,15 д(11) м |
1,40 к(12) д (2,8) |
1,78 ±0,02 |
1,23 к (11) м |
1,78 ±0,02 |
1,28 к (11) м |
|
|
8е |
8а |
9а |
10а |
11 |
12 |
2 |
3 |
Ph |
|
|
MeOD-d4 300,13 |
2,25 д(12) м |
1,12 к (12) д(3) |
2,58 т(10,3) д(3,3) |
1,49 т(11,7) д(2,2) |
1,14 д(6,3) |
а)3,55 д(16,3) д(6,7) б)3,44 д(16,3) д(6,7) |
6,00 д(17,1) д(10,3) т(6,7)
|
Е:5,25 д(17,1) д(0,8) |
о-7,36 м м-, р- 7,30 м |
|
|
2:5,23 д(10,3) д(0,8) |
||||||||||
|
|
|
2а |
3е |
3а |
5е |
5а |
6е |
6а |
7е |
7а |
|
8 |
MeOD-d4 500,13 300,0К |
3,00 д(11,8) к(6,2) д (2,3) |
2,04 д (12,4) д (2,3) |
1,62 т (12,1) |
2,17 д (11) м |
1,36 к »12 д (»3) |
1,75 д (11) м |
1,24 1,24 м |
1,80 д 10 м |
1,27 1,27 м |
|
|
8е |
8а |
9а |
10а |
11 |
12 |
2 |
3 |
Ph |
|
|
|
2,25 д 12,3 м |
1,15 к (12) д 2,6 |
2,50 т (11) д (3,3) |
1,38 »1,39 т (»12) д (»2) |
1,18 д (6,2) |
а)3,52 д (16,2) д (6,7) б)3,43 д(16,2) д(6,7) |
5,96 д (17,1) д (10,3) т (6,7)
|
Не:5,24 д (17,2) д (0,8) |
о-7,39 м м-, р- 7,32 м |
|
|
Нz:5,21 д (10,2) |
||||||||||
|
|
2а |
3е |
3а |
5е |
5а |
6е |
6а |
7е |
7а |
|
|
COSY |
3,00 |
2,04 |
1,62 |
2,17 |
1,35 |
1,75 |
1,24 |
1,80 |
1,27 |
|
|
NOESY |
3,00 |
2,04 |
1,62 |
2,17 |
1,35 |
1,75 |
1,23 |
1,81 |
1,26 |
|
|
|
8е |
8а |
9а |
10а |
11 |
12 |
2 |
3 |
Ph |
|
|
COSY |
2,25 |
1,15 |
2,50 |
1,38 |
1,18 |
|
5,96 |
|
|
|
|
NOESY |
2,26 |
1,15 |
2,50 |
1,38 |
1,18 |
|
5,96 |
|
|
|
|
Р — растворитель; Т — температура, К; n — рабочая частота прибора |
||||||||||
Такое вращение по оси С12-N приводит к тому, что атом водорода 12На приближается к 8Не, а атом 12б к 11СН3, что проявляется в сильном взаимодействии этих пар атомов. Наличие взаимодействия атома водорода 13Не с 2На, 9На и 8Не позволяет предполагать вращение заместителя при азоте по оси С12-N, однако предпочтительной конформацией все же остается конформация «А» по сравнению с конформацией «В»
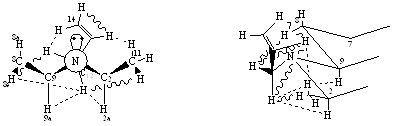
Рисунок 2. Конформация А соединения (7)
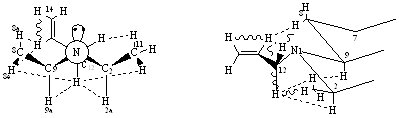
Рисунок 3. Конформация В соединения (7)
Таблица 3
Взаимодействия атомов водорода аллильного заместителя при азоте с близко расположенными атомами водорода циклической системы соединений (7 и 8).
|
|
12 |
11 |
8е |
9а |
2а |
13 |
14 |
|
12 «а» и «б» |
— |
Очень сильно, в основном «а» |
Очень сильно, в основном «б» |
Слабо оба |
Слабо оба |
Сильно оба |
Слабо оба |
|
2 |
Сильно оба |
Слабо |
Слабо |
Средне |
Средне |
— |
Очень сильно |
|
3 |
Средне оба |
Слабо |
Слабо |
Слабо |
Слабо |
Очень сильно |
— |
Индивидуальность, состав и строение N-аллил-2е-метил-4-фенилэтинил-4-окси-транс-декагидрохинолинов (7—10) установлено также на основании данных хромато-масс-спектрометрии. В масс-спектрах соединений (7—10) присутствуют пики молекулярных ионов с m/z 309 (приложения Т.44-Т.47). Распад молекулярных ионов может осуществляться в нескольких направлениях. В первую очередь может происходить выброс метильного радикала с образованием осколочного иона с m/z 294. Конкурирующим направлением распада молекулярного иона является отщепление гидроксильного радикала с образованием осколочного иона с m/z 292. В масс-спектре всех соединений (7—10) присутствует довольно интенсивный пик осколочного иона с m/z 266. Образование этого устойчивого фрагментного иона обусловлено выбросом из молекулярного иона пропильного радикала. Подобный распад весьма характерен для производных декагидрохинолина.
Таким образом, нами впервые синтезированы индивидуальные эпимеры по С2 и С4 N-аллильные производные 2-метил-4-фенилэтинил-4-гидрокси-транс-декагидро-хинолина и на основании данных спектроскопии ЯМР 1Н, 13С, двумерной спектроскопии COSY, NOESY, HSQC, HMBC, HMQC выявлены их конформационные особенности.
Список литературы:
- Самарина Г.Н. Химическое и стереохимическое строение производных пиперидина и декагидрохинолина и их фармакологическая активность: автореф. … докт. мед. наук. — Алма-Ата, 1972. — 32 с.
- Литвиненко Г.С., Хлуднева К.И., Яловенко Е.Г., Пралиев К.Д. и др. Местноанестезирующая активность и токсичность 10 новых производных декагидрохинолина и октагидропиридина //Вопросы фармации. Мин. здравоохранения КазССР. - 1988. - С. 83.
- Искакова Т.К. Синтез, стереохимия, конформационный анализ и биологические свойства новых насыщенных азотистых гетероциклов: автореф. … докт. хим. наук. — Алматы, 2009. — 38 с.
дипломов

Оставить комментарий