Статья опубликована в рамках: VIII Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 06 июня 2012 г.)
Наука: Биология
Секция: Биохимия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
МОДИФИКАЦИЯ ГЕПАРИНОМ АКТИВНОСТИ АМИНОТРАНСФЕРАЗ ПРИ ДЕЙСТВИИ ПЧЕЛИНОГО ЯДА И ЭТАНОЛА
Пурсанов Кузьма Анастасович
канд. мед. наук, доцент, НГМА, г. Н. Новгород
Перепелюк Зоя Владимировна
Аспирантка, ННГУ, г. Н. Новгород
E-mail: labmouse@pochta.ru
Аминотрансферазы, трансаминазы, — ферменты класса трансфераз, катализирующие обратимые реакции трансаминирования, т. е. перенос аминогруппы и водорода от одной молекулы субстрата к другой без промежуточного образования аммиака. Коферменты аминотрансферазы — пиридоксальфосфат и пиридоксаминофосфат. Аминотрансферазы участвуют в азотистом обмене, особенно в обмене аминокислот. Определение аланиновой и аспарагиновой аминотрансфераз в сыворотке крови человека используют в диагностике заболеваний печени и сердца.
Наибольшее клинико-диагностическое значение имеет определение активности двух аминотрансфераз: аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ). Аспартатаминотрансфераза широко распространена в органах и тканях человека. Наибольшее содержание АСТ обнаружено в сердечной мышце, затем последовательно в убывающем количестве в печени, скелетной мускулатуре, головном мозге, почках, семенниках. Активность АСТ в сердечной мышце почти в 10000 раз выше, чем в сыворотке. В эритроцитах АСТ содержится в 10 раз больше, чем в сыворотке. Поэтому при определении аминотрансфераз в сыворотке крови последняя не должна иметь даже следов гемолиза.
Фермент, катализирующий обратимый перенос аминогруппы с аланина на α-кетоглутаровую кислоту, получил название аланинаминотрансферазы. Наиболее высокая активность АЛТ обнаруживается в печени, поджелудочной железе, сердце и скелетной мускулатуре. В печени активность АЛТ в несколько тысяч раз выше, чем в сыворотке крови.
Повышение активности аминотрансфераз в сыворотке крови отмечено при целом ряде заболеваний и особенно при поражении органов и тканей, богатых данными ферментами (печень, миокард и др.). Наиболее резкие изменения в активности АСТ наблюдаются при поражении сердечной мышцы.
Повышение активности АСТ в сыворотке крови больных инфарктом миокарда наблюдается в 93—98 % случаев. Увеличение активности начинается обычно через 6—12 часов после возникновения инфаркта миокарда, достигает максимума через 24—48 часов, затем постепенно падает, возвращаясь к нормальному уровню чрез 4—5 дней. При инфаркте миокарда активность АСТ в сыворотке крови может увеличиваться в 2—20 раз.
Считают, что существует тесная корреляция между размерами очага некроза и активностью АСТ в сыворотке крови. Как показали исследования ряда авторов, некроз площадью 1,5х1,5 см приводит к значительному подъему АСТ в сыворотке крови.
При заболеваниях печени в первую очередь и наиболее значительно по сравнению с АСТ изменяется активность АЛТ. Установлено, что повреждение всего лишь одной печеночной дольки достаточно для значительного увеличения активности сывороточной АЛТ.
Особенно резко повышается активность АЛТ в сыворотке крови при инфекционном гепатите. Максимум повышения активности фермента отмечается на 6—10 день заболевания и постепенно возвращается к норме к 15—20 дню. Активность АЛТ увеличивается уже в инкубационном периоде заболевания, что имеет большое диагностическое значение [2].
Выбор аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) в качестве индикаторов влияния гепарина на токсические свойства был обусловлен тем, что эти два фермента являются информативным клиническим тестом при заболеваниях сердца и печени. Хорошо известно, что этанол и пчелиный яд обладают ярко выраженным кардиотропным и гепатотропным действием, а значит можно гипотетически полагать, что он будет влиять на активность данных ферментов. С другой стороны, печень является одним из основных депо эндогенного гепарина, который, возможно также влияет на активность АлАТ и АсАТ.
Работа была выполнена на 92 лабораторных крысах-самцах, содержащихся на общем рационе вивария. Определение активности ферментов в периферической крови осуществлялось общепринятыми методами.
Статистическая обработка экспериментальных данных была выполнена с помощью программы «Биостат». Для сравнения нескольких групп использовали однофакторный дисперсионный анализ и критерий Стьюдента для множественных сравнений [1].
В нашей работе после введения пчелиного яда наблюдалось повышение уровня активности аминотрансфераз в периферической крови крыс. Активность аланинаминотрансферазы, определенная по прошествии 1 часа от введения пчелиного яда в дозе 2 мг/кг повысилась в 3 раза по сравнению с контролем. Через 6 часов после введения яда активность фермента снижалась до уровня, статистически не отличающегося от контроля (рис. 1).
Введение гепарина (50 МЕ/кг) способствовало понижению активности фермента. Достоверные различия от контрольных величин были выявлены и через 1 час, и через 6 часов после введения. Необходимо отметить, что к 6 часам от введения наблюдается тенденция к увеличению активности фермента (рис. 1). К этому времени происходит нейтрализация гепарина вследствие расщепления гепариназой и образования комплексов с серотонином и белками плазмы крови [3].
Смесь пчелиного яда (2 мг/кг) с гепарином (50 МЕ/кг) вызывала достоверное увеличение активности АлАТ до уровня 0,340±0,045 и 0,258±0,052 мкмоль ПВК/ч мл через 1 час и 6 часов от введения соответственно (рис. 1).
При введении следующим двум группам пчелиного яда (2 мг/кг) на фоне гепарина (50 и 500 МЕ соответственно) также наблюдалось достоверное увеличение активности АлАТ через 1 час и 6 часов от введения. Более высокая активность фермента проявилась через 1 час после применения пчелиного яда на фоне 500 МЕ/кг гепарина. В этой же группе наблюдалось более интенсивное падение активности трансферазы через 6 часов после введения (рис. 1).
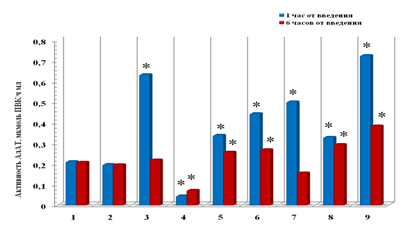
Рис. 1. Влияние пчелиного яда и гепарина на уровень активности аланинаминотрасферазы в периферической крови крыс
1 — Контроль (интактные)
2 — Контроль (физиологический раствор)
3 — Пчелиный яд (2 мг/кг)
4 — Гепарин (50 МЕ/кг)
5 — Пчелиный яд (2 мг/кг)+гепарин (50 МЕ/кг)
6 — Пчелиный яд (2 мг/кг) на фоне гепарина (50 МЕ/кг)
7 — Пчелиный яд (2 мг/кг) на фоне гепарина (500 МЕ/кг)
8 — Протамин сульфат (10 мг/кг)
9 — Пчелиный яд (2 мг/кг) на фоне протамин сульфата (10 мг/кг)
* — Различия между контрольными и экспериментальными группами статистически значимы (р≤0,05)
Нейтрализация эндогенного гепарина протамин сульфатом в количестве 10 мг/кг вызывала не слишком значительное, но статистически достоверное повышение активности АлАТ, в то время как введение пчелиного яда (2 мг/кг) на фоне протамин сульфата вызывало увеличение уровня фермента более чем в 3,5 раза.
Активность аспартатаминотрансферазы, измеренная через 1 час после воздействия пчелиного яда (2 мг/кг) была в 1,6 раза выше контрольной. Через 6 часов от введения яда не наблюдалось статистически значимых отличий от контроля (рис. 2).
Введение гепарина (50 МЕ/кг) способствовало снижению активности фермента через 1 час с последующим повышением через 6 часов после введения.
Введение смеси пчелиный яд (2 мг/кг) — гепарин (50 МЕ/кг) приводило к статистически значимому повышению уровня фермента, причем через 6 часов после введения не отмечалось тенденции к нормализации активности.
При введении пчелиного яда (2 мг/кг) на фоне предварительной гепаринизации (500 МЕ/кг) также наблюдалось увеличение активности АсАТ, однако через 6 часов после введения яда не наблюдалось статистически значимых отличий от контроля.
Антагонист гепарина протамин сульфат вызывал достоверное, с течением времени мало снижающееся повышение уровня АсАТ. Пчелиный яд (2 мг/кг) на фоне протамин сульфата (10 мг/кг) вызывал резкое возрастание активности АсАТ в 5,5 раз с последующим снижением до 1,018±0,073 мкмоль ПВК/ч мл через 6 часов от введения (рис. 2).
Пчелиный яд при введении в организм млекопитающих вызывает тяжелые нарушения обмена веществ. Это связано с прямым его действием на ферментные системы, а также со способностью нарушать нервную и гуморальную регуляцию обмена и вызывать состояние стресса. Установлено, что любые стрессовые состояния, требующие срочной мобилизации компонентов белка для покрытия энергетических нужд организма, связаны с адаптивным, гормонально-стимулируемым биосинтезом определенных аминотрансфераз, участвующих в глюконеогенезе (аланин- и аспартат-аминотрансфераз, аминотрансфераз ароматических аминокислот).
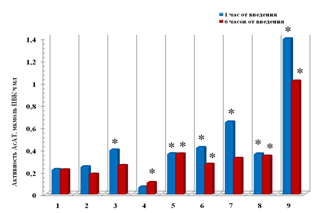
Рис. 2. Влияние пчелиного яда и гепарина на уровень активности аспартатаминотрасферазы в периферической крови крыс
1— Контроль (интактные)
2— Контроль (физиологический раствор)
3— Пчелиный яд (2 мг/кг)
4— Гепарин (50 МЕ/кг)
5— Пчелиный яд (2 мг/кг)+гепарин (50 МЕ/кг)
6— Пчелиный яд (2 мг/кг) на фоне гепарина (50 МЕ/кг)
7— Пчелиный яд (2 мг/кг) на фоне гепарина (500 МЕ/кг)
8— Протамин сульфат (10 мг/кг)
9— Пчелиный яд (2 мг/кг) на фоне протамин сульфата (10 мг/кг)
* — Различия между контрольными и экспериментальными группами статистически значимы (р≤ 0,05)
Повышение активности аминотрансфераз можно объяснить и воздействием компонентов апитоксина непосредственно на мембраны клеток. Известно, что мелиттин — мембранолитик, поэтому он изменяет проницаемость мембраны [7] и таким путем может влиять на локализацию и активность ферментов.
Сам гепарин снижает развитие общего адаптационного синдрома [8]. Предполагается, что гепарин влияет на конститутивный или индуктивный синтез трансаминаз в печени или других органах и тканях, а также образует биокомплекс гепарин + трансаминазы, обеспечивая восстановление нарушенных реакций переаминирования [5]. Кроме того, возможна непосредственная нейтрализация токсичных компонентов яда образованием неактивных комплексных соединений с гепарином [6]. Этим объясняется меньшая токсичность пчелиного яда в составе смеси по сравнению с введением на фоне предварительной гепаринизации.
В следующей серии экспериментов исследовалось изменение активности аминотрансфераз при действии этанола, гепарина и протамин асульфата. У интактных животных активность АлАТ и АсАТ равна 0,156±0,064 и 0,103±0,025 мкМ/мл соответственно. Введение физиологического раствора в объёме 1 мл многократно снижает активность АлАТ (0,061±0,030) и более чем в два раза снижает активность АсАТ (0,051±0,013) относительно интактных животных. В связи с тем, что исследуемые вещества мы разводили в физиологическом растворе, в качестве контроля для статистической обработки были взяты именно эти данные (рис. 3).
При введении гепарина в дозах от 1000 МЕ/кг до 5000 МЕ/кг активность АлАТ повышается и достигает при введении гепарина 5000 МЕ/кг 0,405±0,048 мкМ/мл. При оценке активности АсАТ установлено, что его активность возрастает в тех же пределах, за исключением введения гепарина в дозе 5000 МЕ/кг (0,081±0,065 мкМ/мл) (рис. 4).
Этанол (12 %, 0,5 мл/200г) повышает активность АлАТ и АсАТ, однако 20 % этанол объёме 0,5 мл/200г снижает активность АлАТ до 0,185±0,022 мкМ/мл, АсАТ — до 0,022±0,017 мкМм/л, сравнимых с контрольными величинами.

Рис. 3. Влияние гепарина, этанола и протамин сульфата на активность аланинаминотрансферазы
1. Интактная группа; 2. Контроль (физ.раствор);
3. Гепарин (500 МЕ/кг); 4. Гепарин (1000 МЕ/кг);
5. Гепарин (2500 МЕ/кг); 6. Гепарин (3000 МЕ/кг);
7. Гепарин (5000 МЕ/кг); 8. Этанол (12 %, 0,5 мл/200г);
9. Этанол (20 %, 0,5 мл/200г); 10. Гепарин(500 МЕ/кг)→ Этанол(12 %); 11. Гепарин(1000 МЕ/кг) →Этанол(12%, 0,5 мл/200г);
12. Гепарин (2500 МЕ/кг) →Этанол(12%, 0,5 мл/200г)
13. Гепарин(2500 МЕ/кг) → Этанол(20%, 0,5 мл/200г)
14. Гепарин(2500 МЕ/кг) + Этанол(20%, 0,5 мл/200г)
15. Гепарин (5000 МЕ/кг) → Этанол(12%, 0,5 мл/200г)
16. Этанол (12 %, 0,5 мл/200г)→ Гепарин(500 МЕ/кг)
17. Этанол(12 %, 0,5 мл/200г) → Гепарин(2500 МЕ/кг)
18. Протамин сульфат(1 мг/кг) → Этанол (12 %,0,5 мл/200г)
* Различия между контрольными и экспериментальными группами статически значимы (p<0.05)
Совместное применение гепарина и этанола в различных вариантах введения не выявило каких-либо общих закономерностей и тенденций влияния на активность АлАТ и АсАТ. Правда, следует отметить, что этанол(12 %, 0,5 мл/200г) на фоне предварительного введения гепарина (1000 МЕ/кг) увеличивает активность АлАТ до 0,257±0,021 мкМ/мл, а активность АсАТ — до 0,558±0,205 мкМ/мл. Аналогичное повышение активности АсАТ регистрировалось при введении гепарина (2500 МЕ/кг) и этанола (20 %, 0,5 мл/200г) в виде смеси (рис. 4).
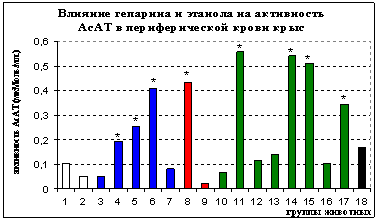
Рис. 4. Влияние гепарина, этанола и протамин сульфата на активность аспартатаминотрансферазы
1. Интактная группа; 2. Контроль (физ.раствор);
3. Гепарин (500 МЕ/кг); 4. Гепарин (1000 МЕ/кг);
5. Гепарин (2500 МЕ/кг); 6. Гепарин (3000 МЕ/кг);
7. Гепарин (5000 МЕ/кг); 8. Этанол (12 %, 0,5 мл/200 г);
9. Этанол (20 %, 0,5 мл/200г); 10. Гепарин(500 МЕ/кг)→ Этанол(12 %); 11. Гепарин(1000 МЕ/кг) →Этанол(12%, 0,5 мл/200г);
12. Гепарин (2500 МЕ/кг) →Этанол(12%, 0,5 мл/200г)
13. Гепарин(2500 МЕ/кг) → Этанол(20%, 0,5 мл/200г)
14. Гепарин(2500 МЕ/кг) + Этанол(20%, 0,5 мл/200г)
15. Гепарин (5000 МЕ/кг) → Этанол(12%, 0,5 мл/200г)
16. Этанол (12 %, 0,5 мл/200 г)→ Гепарин(500 МЕ/кг)
17. Этанол(12 %, 0,5 мл/200 г) → Гепарин(2500 МЕ/кг)
18. Протамин сульфат(1 мг/кг) → Этанол (12 %,0,5 мл/200 г)
* Различия между контрольными и экспериментальными группами статически значимы (p<0.05)
Таким образом, 12 % этанол в объеме 0,5 мл/200 г достоверно повышает активность АлАТ и АсАТ. При использовании 20 % спирта в том же объёме активность АлАТ остаётся достоверно высокой, а активность АсАТ резко уменьшается и достоверно не отличается от контрольных величин.
Гепарин повышает активность АлАТ и АсАТ, однако следует сказать, что активность АсАТ при введении высокой дозы (5000 МЕ/кг) гепарина резко снижается. Гепарин, вероятно, воздействует на состояние дисферментемии применительно к АсАТ, что, возможно, связано с влиянием гепарина на конститутивный или индуктивный синтез АсАТ в печени или других органах и тканях, а также с образованием биокомплекса гепарин + трансаминазы [5].
Известно, что гепарин образует с этанолом нестойкие соединения, распадающиеся при небольшом изменении условий, особенно in vivo. Видимо поэтому активность трансаминаз при различных сочетаниях введения этанола с гепарином не даёт четкой картины протекторного действия гепарина в отношении этанола, какую мы наблюдаем при оценке влияния протеогликана на продолжительность этанолового сна [4].
Список литературы:
- Гланц Стентон. Медико-биологическая статистика. Пер. с англ. — М.: Практика, 1999. — 459 с.
- Комаров Ф.И., Коровкин Б.Ф., Меньшиков В.В. Биохимические исследования в клинике.- Элиста: АПП «Джангар», 2001. — 216 с.
- Кудряшов Б.А. Биологические проблемы регуляции жидкого состояния крови и ее свертывания. М.: Медицина, 1975. — 488 с.
- Пурсанов К.А., Хомутов А.Е., Бутылин А.Г., Слободянюк В.С. Влияние гепарина, протамин сульфата, этанола и их сочетанного применения на показатели сна экспериментальных животных // Медицинский альманах, 2009. № 3(8). С. 136—137.
- Федянин Ю.П., Патеюк В.Г. Влияние гепарина на некоторые ферменты переаминирования в сыворотке крови больных эпидемическим гепатитом // Гепарин. Физиология, биохимия, фармакология и клиническое применение. Тезисы III Всесоюзной конференции. М., 1973. — С. 312—314.
- Хомутов А.Е., Орлов Б.Н. Физиологическая роль гепарина. Горький: Изд-во ГГУ, 1987. — 77 с.
- Хомутов А.Е., Пурсанов К.А., Калашникова Л.М. Пчелы, пчелиный яд, апитоксинотерапия. — Н. Новгород: Изд-во НГМА, 2006. — 380 с.
- Jaques L.B. Physiology of heparin// Angeologie. 1983. V. 35, № 5. - P. 145—154.
дипломов

Оставить комментарий