Статья опубликована в рамках: V Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 06 марта 2012 г.)
Наука: Химия
Секция: Биоорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СИНТЕЗ ОКСИМЫ ФЛАВАНОНОВ И ИХ БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Исмаилова Гулзира Орынбаевна
канд. хим. наук, доцент, Институт биоорганической химии Академии наук Республики Узбекистан, г. Ташкент
Мавлянов Саидмухтар Максудович
д-р хим. наук, профессор, Институт биоорганической химии Академии наук Республики Узбекистан, г. Ташкент
Халконы и флаваноны, характеризующие широкие спектры физиологического действия, являются благодатным объектом для химической модификации [2, с. 5; 4, с. 68].
Синтезированные халконы и флаваноны были изучены авторами [2, с. 5; 3, с. 418; 4, с. 68; 5, с. 1017]как вещества, обладающие антитуберкулезной и гепатопротекторной активностью. Это указало на перспективность поиска биологически активных новых соединений в ряду синтетических аналогов флавоноидов- оксимы флаванонов 10-12, синтезированных из флаванонов (2-арилхроманонов) 4-6 и 4-тиоксифлаванонов 7-9.
Используя разработанные методы [1, с. 37; 2, с. 5], нами были получены 2-арилхроманоны 4-6 из 2'-гидроксихалконов 1-3 в присутствии спирта и каталитических количеств триэтиламина.
Найдено, что при перекристаллизации из уксусной кислоты халконы 1-3, имеющие в положении 5' заместители, независимо от природы заместителя изомеризуются в флаваноны 4-6, в отсутствие какого-либо катализатора. По-видимому, процесс отрыва протона от группы 2'-ОН, ускоряемый электроноакцепторными заместителями (Сl, ОСН3) в положении 5' халкона, и его атака на α-углеродный атом халкона протекает синхронно. Последующая атака атома кислорода феноксид-аниона на положительно заряженный β-углеродный атом халкона завершается образованием флаванона. Вероятно, немаловажное значение при такой изомеризации оказывает природа растворителя. Так, продолжительное кипячение 5'-замещенных халконов 1-3 в абсолютном спирте приводит к смеси халкона и незначительных количеств флаванона, в то время как при кристаллизации из обычного спирта в основном образуется флаванон. Последнее обстоятельство позволяет сделать вывод о том, что процесс изомеризации халконов во флаваноны в спирте катализируется молекулами воды. Ниже приводится предполагаемый механизм изомеризации халконов в флаваноны в спиртовом растворе:
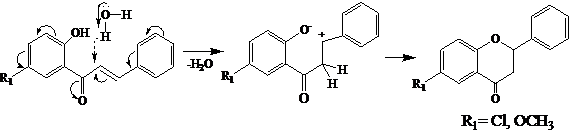
Отметим, что легкость изомеризации халконов в флаваноны зависит от природы заместителей в кольце А и В, протекающая как в кислой, так и в щелочной средах.
Наиболее высокие выходы флаванонов получены при изомеризации халконов, не имеющих заместителей или имеющих электронодонорные заместители в положении 3, 4 (46—80 %).
Циклизация халконов во флаваноны, имеющие в 4'-положений заместители, происходит очень медленно и выходы флаванонов при этом не превышают 45 %.
Строение полученных 2-арилхроманонов 4-6 подтверждается данными анализов, спектром ПМР и химическими превращениями. Спектры ПМР 2-арилхроманонов 4-6 имеют характеристические сигналы, химические сдвиги которых лежат в области 5.3—6.0 м. д. и 2.7—3.5 м. д. Значения КССВ (J2а, 3а=11.5-13.2; J2а, 3е=2.6-3.3; J3а, 3е=16.0-17.2 Гц) показывают, что протон Н2а ориентирован аксиально. Следовательно, конформация пиранового цикла-полукресло.
С целью подтверждения структуры и для изучения химических свойств 2-арилхроманонов 4-6, нами были получены их оксимы 10-12. В их спектрах ПМР (DMСO-d6) группа N-OHпроявляется в области 11.16—11.56 м. д. (в CDCl3при 7.27—7.81 м. д.), Н2а - при 4.48—5.38 м.д., Н3а – при 2.40—2.98 м. д. и Н3е – при 3.05—3.52 м. д. Значения КССВ (J2a, 3a=11.2-12.7 Гц; J2a, 3е =2.4-3.8 Гц; J3a, 3е = 16.6-17.72 Гц).
В качестве примера реакции, в которых участвует карбонильная группа, мы изучали взаимодействие 2-арилхроманонов 4-6 с пятисернистым фосфором в абсолютном толуоле, которые были превращены в соответствующие 4-тиоксофлаваноны 7-9.
4-Тиоксофлаваноны 7-9 – ярко окрашенные вещества оранжевого или фиолетового цвета. Их окраска обусловлена С=S– группой. В спектрах ПМР 4-тиоксофлаванонов сигналы протонов 3-Н и 5-Н при переходе от флаванонов к тиоксифлаванонам под влиянием атома серы смешаются в область слабого поля на 0.8 — 1.0 м. д. и 0.3 — 0.52 м. д.
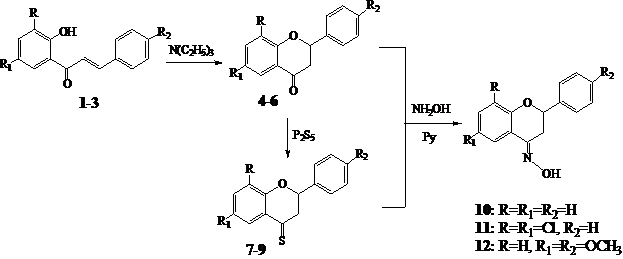
Взаимодействие 2-арилхроманонов 4-6 или4-тиоксофлаванонов 7-9 с солянокислым гидроксиламином в пиридиновом растворе при 1000С образуются оксимы флаванонов 10-12, из них новые соединения 11 и 12.
Таким образом, природа заместителей находящихся в кольце А и В халконов, существенно влияет на легкость их изомеризации в оксимы флаванонов. Изучены химические и спектральные особенности синтезированных флаванонов и продуктов их превращения.
Полученные нами синтетические производные продукты 10-12 были исследованы invitroна антимикобактериальную активность против M. TuberculosisH37Rvв BACTEC-12Bи ErdmanTuberculosisAntimicrobialAcquisitionandCoordinatingFacility(TAACF), SouthernResearchInstitute, USAв сравнений с изониазидом как стандартом (эффективная доза 6.25 мкг/мл).Результаты исследований представлены в таблице 1.
Таблица1
Противотуберкулезная активность производных оксимы флаванонов против M.TuberculosisH37Rvв BACTEC-12Bи Erdman(invitro)

|
Соединение |
R |
R1 |
R2 |
Минимальная ингибирующая концентрация, мкг/мл |
Ингибирование, % |
|
11 |
Cl |
Cl |
Н |
>6.25 |
48 |
|
12 |
OCH3 |
H |
OCH3 |
>6.25 |
38 |
|
контроль Изониазид |
|
>6.25 |
95 |
||
В результате исследований обнаружено, что соединение 11 с хлорзамещенными радикалами проявил 48% противотуберкулезную активность, соединение 12 сметоксизамещенными радикалами привело к уменьшению эффекта (38 %). Изменение природы заместителя не приводит к повышению значения противотуберкулезной активности, в частности OCH3- производное оказалось менее активным (38 %), чем соответствующее Cl-производное.
Таким образом, в данной группе веществ, наибольшую активность проявил соединение 11, но по величине фармакологического эффекта в изученной дозе не превосходит препарата «Изониазид».
Список литературы:
- Айтмамбетов А. Автореф. дисс. док. хим. наук. Киев. 1994. – С. 37—39.
- Кубжетерова А. Афтореф. дис… канд. хим. наук. Институт биоорганической химии АН РУз. Ташкент. 2002. – С 5, 10, 16.
- Кульмагамбетова Э. А., Ямовой В. И., Кусаинова Д. Д., Пак Р. Н., Кулыясов А. Т., Турдыбеков К. М., Адененов С. М., Гатилов Ю. В. // Химия природ. соедин. - 2002. - № 6. – С. 418—421.
- Тлегенов Р. Т. Дисс. докт. хим. наук. Институт биоорганической химии АН РУз. Ташкент. 2008. – С. 68, 110.
- Okunade A. L., Elvin-Lewis M. P. F., Lewis W. H. // Phytochemistry. - 2004. -№ 65. – С. 1017—1032.
дипломов

Комментарии (1)
Оставить комментарий