Статья опубликована в рамках: XXI Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 29 июля 2013 г.)
Наука: Медицина
Секция: Акушерство и гинекология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ МОЛОЧНЫХ ЖЕЛЕЗ ПРИ МЕТАБОЛИЧЕСКОМ СИНДРОМЕ
Татарчук Татьяна Феофановна
д-р мед. наук, профессор, заведующая отделом эндокринной гинекологии ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины», Украина, г. Киев
E-mail:
Вороненко Наталья Юрьевна
канд. мед. наук, доцент кафедры акушерства, гинекологии и перинатологии Национальной медицинской академии последипломного образования им. П.Л. Шупика, Украина, г. Киев,
,
Хоминская Зинаида Борисовна
д-р мед. наук, профессор, заведующая лабораторией эндокринологии с группой биохимии ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины»; Украина, г. Киев
,
Капшук Ирина Николаевна
отдел эндокринной гинекологии ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины»; Украина, г. Киев
Тонковид Олег Борисович
канд. мед. наук, доцент кафедры медицинской статистики Национальной медицинской академии последипломного образования им. П.Л. Шупика, Украина, г. Киев,
STATUS OF MAMMARY GLANDS IN THE METABOLIC SYNDROME
Tatiana Tatarchuk
dr. Sci., Professor, Head of Department of Endocrine Gynecology of Public Institution "Institute of Pediatrics, Obstetrics and Gynecology, NAMS of Ukraine";
Kiev, Ukraine
Nataliya Voronenko
md, Ph. D., Assistant of Professor of Obstetrics, Gynecology and Perinatology Department, Shupyk National Medical Academy of Postgraduate Education,
Kiev, Ukraine;
Zinaida Khominskaya
dr. Sci., Professor, Head of Department of Laboratory of Endocrinology with a group of Biochemistry of Public Institution "Institute of Pediatrics, Obstetrics and Gynecology, NAMS of Ukraine", Kiev, Ukraine
Irina Kapshuk
department of Endocrine Gynecology of Public Institution "Institute of Pediatrics, Obstetrics and Gynecology, NAMS of Ukraine", Kiev, Ukraine
Oleg Tonkovid
md, Ph. D., Assistant of Professor of Medical Statistics Department of Shupyk National Medical Academy of Postgraduate Education, Kiev, Ukraine;
АННОТАЦИЯ
В статье рассматриваются вопросы этиопатогонеза метаболического синдрома (МС). Показано, что при МС наблюдается нарушение секреции некоторых адипоцитокинов, и раскрыты возможные механизмы взаимосвязи МС с формированием дисгормональной патологии молочных желез. Приведены пороговые величины концентраций таких адипокинов, как адипонектин, липокалин, лептин и резистин, а также гормона инсулина, увеличивающие риск развития доброкачественной патологии груди.
ABSTRACT
The article is devoted to etiopathogonesis of metabolic syndrome (MS). It is shown that in MS there is a violation of some adipocytokines secretion, and disclosed the possible relationship mechanisms of MS with the formation of dyshormonal breast pathology. There are given thresholds concentrations of adipokines, such as adiponectin, lipocalin, resistin and leptin, as well as the hormone insulin, which increase the risk of benign breast disease.
Ключевые слова: метаболический синдром, ожирение, адипоцитокины, дисгормональные заболевания молочных желез.
Keywords: metabolic syndrome, obesity, adipocytokines, dishormonal breast disease.
Вступление. Метаболический синдром (МС) представляет собой набор кардиометаболических факторов риска, включающих ожирение, резистентность к инсулину, артериальную гипертензию и дислипидемию [9, 12—14]. Это состояние характеризуется наличием резистентности к инсулину, что предположительно является соединительным звеном между отсутствием физической активности и развитием МС [4, 7, 11]. Несмотря на значительные научные дискуссии о критериях и концепции этого синдрома, согласие найдено в том, что МС, как кластер факторов риска, однозначно связан с повышенным риском развития сахарного диабета второго типа и сердечно-сосудистых заболеваний [3, 6]. Независимо от определения, многочисленные исследования, основанные на оценке численности населения, декларируют, что около 100 миллионов человек в мире имеют МС.
Согласно критериев Международной федерации диабета [5, 12, 15], для постановки диагноза МС необходимо наличие основного критерия — абдоминального ожирения, а также двух из следующих:
· артериальная гипертензия;
· гипергликемия;
· дислипидемия.
Андроидный тип ожирения, характерный для МС, формируется вследствие большого количества рецепторов к кортизолу и незначительной экспрессии инсулиновых рецепторов на адипоцитах висцеальной жировой ткани [8, 9, 11]. Вследствие наблюдаемого при МС гиперкортицизме и гиперандрогении происходит увеличение адипоцитов в объеме, что, в свою очередь, еще больше способствует уменьшению плотности инсулиновых рецепторов на поверхности адипоцитов, увеличивая инсулинорезистентность и замыкая «порочный круг» [1, 12].
На сегодня установлено, что в адипоцитах происходит синтез биологически активных веществ — адипоцитокинов, в частности, липокалина, резистина, ретинол-связывающего протеина-4, адипонектина, лептина, которые носят название адипокины. Анализ литературы показывает, что сывороточные уровни адипокинов могут быть связаны с возникновением рака молочной железы [16, 18] вследствие их способности влиять на ароматазную активность и, как следствие, усиливать экстрагонадный синтез эстрогенов в жировой ткани [16].
Целью исследования стало изучение взаимосвязи адипоцитокинов с состоянием молочных желез у женщин репродуктивного возраста с метаболическим синдромом.
Материалы и методы исследований.
Исследование проводилось на клинических базах кафедры акушерства и перинатологии НМАПО им. П.Л. Шупика, отдела эндокринной гинекологии ГУ «Института педиатрии, акушерства и гинекологии НАМН Украины» и «Института эндокринологии и обмена веществ имени В.П. Комиссаренко АМН Украины».
На первом этапе исследования нами было проведено комплексное клиническое обследование состояния репродуктивного здоровья в 750 женщин с МС (по 250 женщин разных возрастных групп с МС). В результате проведенного скрининга была выявлена структура нарушений репродуктивной системы в каждом возрастном периоде. В качестве группы сравнения было обследовано 150 женщин репродуктивного возраста без признаков метаболического синдрома.
Для установления состояния репродуктивной системы проводилось гинекологическое обследование, а также ультразвуковое исследование органов малого таза. При этом оценивалось состояние, размеры и наличие структурных изменений матки, состояние эндометрия, его толщину, наличие включений с целью определения показаний для возможной биопсии, а также соответствие эндометрия фазе менструального цикла. Изучалась ультразвуковая структура и размеры яичников, наличие в них кист, а также имеющихся признаков овуляторного цикла или поликистоза.
Скрининг на выявление патологии молочной железы проводился согласно Приказу МЗ Украины № 676 от 2004 года «Об утверждении клинических протоколов по акушерской и гинекологической помощи». При выявлении патологии осуществлялось дальнейшее обследование состояния молочной железы, согласно алгоритма, предложенного Американским онкологическим обществом. В соответствии с ним выполнялся «тройной тест» включающий: клиническое обследование (пальпацию МЖ); визуализацию (ультразвуковое исследование (УЗИ) и билатеральную маммографию у женщин старше 40 лет) и патоморфологическое исследование ткани, полученные в результате аспирационной биопсия или пункционной трепан-биопсии.
Кроме того, отдельное внимание уделяли женщинам, которые предъявляли жалобы на циклическую масталгию и при этом у них не определялось объемных образований молочных желез, требующих проведения биопсии. При УЗИ у них отмечалось нарушение соотношения фиброзной и железистой ткани за счет увеличения фиброза, либо увеличение маммографической плотности, усиление фиброза при выполнении маммографии (у женщин старше 40 лет).
Женщины с симптомами галактореи не включались в данное исследование, их лечение проводилось в соответствии с принятым протоколом.
Для определения особенностей состояния аутокринно-паракринной системы жировой ткани определяли содержание адипоцитокинов в сыворотке крови, как маркеров метаболического синдрома, также иммуноферментным методом с помощью тест-систем фирм DSL и DRG (USA), а также фирмы IBL (Japan). Измерение оптической плотности выполнялось на фотометре MSR-1000 (Syntron, США, 1995).
Полученные цифровые данные обрабатывали с использованием программ Excel Microsoft Office 2003 и лицензионной версии Stata 12 с применением методов вариационной статистики. Анализ сопоставимости распределений качественных признаков в группах проводили с использованием критерия χ-квадрат. Сравнение количественных параметров базировалось на предварительной оценке нормальности распределения данных по критерию Шапиро-Уилка. Для сравнения показателей с нормальным характером распределением использовали t-критерий Стьюдента. При отклонении исходных характеристик от параметров нормального распределения использовали непараметрические критерии Манна-Уитни для попарного сравнения и Краскелла-Уоллиса при одновременном сравнении больше двух групп. Статистическая значимость различий оценивалась на уровне не ниже 95 % (риск ошибки р < 0,05). Оценка характера связи между показателями проводилась с помощью ранговых коэффициентов корреляции. Для прогностической оценки риска развития клинической патологии и определения пороговых уровней показателей применяли ROC-анализ с оценкой чувствительности, специфичности и прогностической эффективности пороговых значений.
Результаты исследований и их обсуждение.
На I этапе исследования было выявлено, что у пациенток с МС существенно чаще наблюдается патология репродуктивной системы (табл. 1), чем у женщин контрольной группы. Нами установлено также наличие возрастной зависимости распределения нарушений репродуктивной системы при МС (табл. 2).
Таблица 1.
Частота выявления патологии репродуктивной системы
у обследованных женщин, абс. (%)
|
Вариант патологии |
Здоровые, n=150 |
МС, n=750 |
p(χ2) |
|
|
Нарушения менструального цикла |
Аменорея |
7 (4,7) |
213 (28,4) |
0,0001 |
|
ДМК |
26 (17,3) |
361 (48,1) |
0,0001 |
|
|
СПКЯ |
17 (11,3) |
594 (79,2) |
0,0001 |
|
|
Гиперплазия эндометрия |
23 (15,3) |
354(47,2) |
0,0001 |
|
|
Лейомиома матки |
14 (9,3) |
131(17,5) |
0,003 |
|
|
Доброкачественные опухоли яичников |
23 (15,3) |
207 (27,6) |
0,0003 |
|
|
Эндометриоз |
20 (13,3) |
92(12,3) |
0,724 |
|
|
Патология шейки матки |
40 (26,3) |
217(28,9) |
0,568 |
|
|
Бесплодие |
38 (25,3) |
422(56,3) |
0,0001 |
|
|
Доброкачественные заболевания молочных желез |
41 (27,3) |
486(64,8) |
0,0001 |
|
Примечание: р — оценка значимости различий между здоровыми женщинами и женщинами с метаболическим синдромом (критерий хи-квадрат χ2)
Таблица 2.
Частота выявления патологии репродуктивной системы у женщин разных возрастных групп с метаболическим синдромом, абс. (%)
|
Вариант патологии |
Группы согласно репродуктивному возрасту |
p(χ2) |
||||
|
ранний |
активный |
поздний |
||||
|
Нарушения менструального цикла |
аменорея |
65(26,0) |
87 (34,8) |
61(24,4) |
0,021 |
|
|
ДМК |
92(36,8) |
156 (62,4) |
113(45,2) |
0,0001 |
||
|
СПКЯ |
197 (78,8) |
212 (84,8) |
185(74,0) |
0,011 |
||
|
Гиперплазия эндометрия |
7(2,8) |
122 (48,8) |
225 (90,0) |
0,0001 |
||
|
Лейомиома матки |
2(0,8) |
57(22,8) |
72 (28,8) |
0,0001 |
||
|
Доброкачественные опухоли яичников |
60(24,0) |
67(26,8) |
80 (32,0) |
0,12 |
||
|
Эндометриоз |
12(4,8) |
50(20,0) |
30 (12,0) |
0,0001 |
||
|
Патология шейки матки |
65(26,0) |
72(28,8) |
80 (32,0) |
0,33 |
||
|
Бесплодие |
40(16,0) |
185(74,0) |
197 (78,8) |
0,0001 |
||
|
Доброкачественные заболевания молочных желез |
масталгия |
36 (14,4) |
172 (68,8) |
160 (64,0) |
0,0001 |
|
|
в т. ч. доброкачественные заболевания молочных желез, требующие биопсии |
4 (1,6) |
44 (17,6) |
70 (28,0) |
0,0001 |
||
|
всего |
40 (16,0) |
216 (86,8) |
230 (92,0) |
0,0001 |
||
Примечание: р — оценка значимости различий между группами согласно репродуктивному возрасту по критерию хи-квадрат (χ2)
Учитывая высокую частоту выявления дисгормональных заболеваний молочных желез, все обследованные женщины подлежали более детальному изучению состояния молочных желез. При ультразвуковой визуализации объемного образования молочных желез, выполнялось несколько фотографий в разных плоскостях с увеличением и оценкой кровоснабжения с применением цветного или энергетического доплера с последующим принятием решения о необходимости выполнения биопсии.
Показания к выполнению биопсии были обнаружены у 118 (15,7 %) пациенток с МС (табл. 3). При анализе патоморфологических характеристик ДЗМЖ у женщин репродуктивного возраста с МС были выявлены определенные возрастные закономерности (табл. 3).
Таблица 3.
Структура доброкачественных заболеваний молочных желез у женщин разных возрастных групп с метаболическим синдромом
согласно результатов биопсии, абс.ч.(%)
|
|
|
Здоровые (n =11) |
||
|
ранний (n =4) |
активный (n =44) |
поздний (n =70) |
||
|
Фиброзно-кистозная болезнь |
3 (75) |
18 (40,9) |
43 (61,4) |
5 (45,5) |
|
Фиброз |
– |
5 (11,4) |
8 (11,4) |
3 (27,3) |
|
Фиброаденоматоз |
1 (25) |
11 (25,0) |
3 (4,3) |
2 (18,2) |
|
Фиброаденома |
- |
5 (11,4) |
10 (14,3) |
1 (9,1) |
|
Протоковая папиллярная гиперплазия |
– |
3 (6,8) |
2 (2,9) |
|
|
Гиперплазия долек |
|
2 (4,5) |
4 (5,7) |
|
|
Всего |
4 (100,0) |
44 (100,0) |
70 (100,0) |
11 (100) |
Так, если среди пациенток с МС в раннем репродуктивном возрасте ДЗМЖ, подлежащие проведению биопсии, выявлялись у 1,6 % женщин, то среди женщин активного репродуктивного возраста — почти у каждой пятой (17,6 %), а среди женщин позднего репродуктивного возраста — практически у каждой третей пациентки (28,0 %).
В структуре ДЗМЖ у женщин раннего репродуктивного возраста (табл. 3) превалировали непролиферативные формы ДЗМЖ (фиброзно-кистозная болезнь — 75 % и фиброаденоматоз — 25 %). В активном репродуктивном возрасте наряду с фиброзно-кистозной болезнью — 40,9 %, фиброзом — 11,4 % и фиброаденоматозом — 25,0 %, встречаются фиброаденомы — 11,4 %, а также пролиферативные формы ДЗМЖ: протоковая папиллярная гиперплазия — 6,8 %, и гиперплазия долек — 4,5 %. В позднем репродуктивном возрасте имеет место наибольшая частота доброкачественных заболеваний молочных желез (92,0 %, табл. 2), при этом растет удельный вес фиброаденом (14,3 % и фиброзно-кистозной болезни — 61,4 %. Пролиферативные формы ДЗМЖ в позднем репродуктивном возрасте встречались у 8,6 % пациенток: протоковая папиллярная гиперплазия — у 2 женщин (2,9 %) и гиперплазия долек — у 4 (5,7 %) пациенток.
На следующем этапе нашего исследования была выделена группа из 35 пациенток с МС для углубленного исследования особенностей функционирования аутокринно-паракринной системы жировой ткани на фоне МС. Контрольную группу составили 54 здоровые женщины без МС. В результате проведенного анализа мы выявили статистически значимое снижение уровня адипонектина (12,7±6,7 rg/ml при МС в сравнении с 16,2±6,2 rg/ml у здоровых; р=0,012), повышение уровней лептина (1032,4±345,2 ng/ml при МС в сравнении с 583,5±379,2 ng/ml у здоровых; p=0,0001) и инсулина (23,5±11,3 mIU/mL при МС в сравнении с 15,3±8,1 mIU/mL у здоровых; p=0,0001). При этом мы не обнаружили существенных отличий в сывороточных уровнях липокалина-2, ретинол-связывающего протеина-4 и резистина (табл. 4).
Таблица 4.
Уровни адипоцитокинов и инсулина у обследованных женщин, M±s
|
Уровни адипоципокинов |
Метаболический синдром n=35 |
Здоровые |
Р |
|
Адипонектин, rg/ml |
12,7±6,7 |
16,2±6,2 |
0,012 |
|
Лептин, ng/ml |
1032,4±345,2 |
583,5±379,2 |
0,0001 |
|
Липокалин-2, ng/ml |
36,1±25,4 |
36,0±20,5 |
0,98 |
|
Ретинол-связывающий протеин-4, mg/l |
49,8±16,6 |
51,7±18,5 |
0,62 |
|
Резистин, ng/ml |
5,5±2,5 |
6,7±3,0 |
0,07 |
|
Инсулин, mIU/mL |
23,5±11,3 |
15,3±8,1 |
0,0001 |
Учитывая существенно более высокий уровень ДЗМЖ у женщин с МС в сравнении со здоровыми пациентками группы контроля (22 (62,8 %) и 9 (16,7 %) соответственно р<0,05), а также наличие дисадипокинемии при МС (табл. 4), мы изучили зависимость наличия патологии молочной железы (ДЗМЖ) от сывороточных концентраций адипоцитокинов. С этой целью мы провели сравнительный анализ уровней адипокинов в группах пациенток с патологией и без патологии молочных желез (табл. 5).
Таблица 5.
Уровни адипоцитокинов и инсулина у обследованных женщин в зависимости от наличия или отсутствия доброкачественных заболеваний молочных желез, (Х±δ)
|
Показатели
|
Метаболический синдром, n=35 |
Контрольная группа, n=54 |
||||
|
с ДЗМЖ |
без ДЗМЖ |
р |
с ДЗМЖ |
без ДЗМЖ |
Р |
|
|
Инсулин, mIU/mL |
28,5±11,5 |
15,0±2,9 |
0,0001 |
24,9±6,5 |
11,5±4,8 |
0,0001 |
|
Лептин, ng/ml |
1122,6±329,1 |
879,7±38,5 |
0,02 |
918,5±488,6 |
454,6±213,5 |
0,0009 |
|
Липокалин, ng/ml |
27,4±12,4 |
50,7±34,4 |
0,006 |
37,8±12,1 |
35,2±23,1 |
0,68 |
|
Адипонектин, rg/ml |
9,6±3,5 |
17,9±7,5 |
0,0001 |
7,6±2,7 |
19,6±8,6 |
0,0001 |
|
Резистин, ng/ml |
5,8±2,4 |
5,4±2,5 |
0,66 |
5,1±3,9 |
7,3±3,1 |
0,09 |
|
РCП-4, mg/l |
47,4±15,2 |
53,8±18,7 |
0,28 |
55,4±19,0 |
50,3±18,1 |
0,36 |
В результате мы определили, что как для группы здоровых, так и для группы женщин с МС характерны общие закономерности по изменению уровней адипоцитокинов, связанных с развитием патологии молочных желез (табл. 4). Так, развитие ДЗМЖ ассоциируется со статистически значимым повышением концентраций инсулина (28,5±11,5 mIU/mL, р=0,0001 в группе с МС; 24,9±6,5 mIU/mL, р=0,0001 в группе здоровых) и лептина (1122,6±329,1 ng/ml, р=0,02 в группе с МС; 918,5±488,6 ng/ml, р=0,02 в группе здоровых), а также со статистически значимым снижением уровней адипонектина (9,6±3,5 rg/ml, р=0,0001 в группе с МС; 7,6±2,7 rg/ml, р=0,0001 в группе здоровых) и липокалина-2 в группе с МС (27,4±12,4 ng/ml, р=0,006).
При этом мы не выявили существенных изменений уровней резистина (5,8±2,4 ng/ml, р=0,66 в группе с МС; 5,1±3,9 ng/ml, р=0,09 в группе здоровых) и ретинол связывающего протеина-4 (47,4±15,2 mg/l, р=0,28 в группе с МС; 55,4±19,0 mg/l, р=0,36 в группе здоровых) при наличии ДЗМЖ.
Так как частота ДЗМЖ в контрольной группе здоровых женщин значительно ниже, чем при МС (р<0,001, табл. 1,4), а также вследствие того, что отклонение указанных показателей при МС в сторону неблагоприятного диапазона существенно более выражено, нами проведена прогностическая оценка концентраций адипокинов и инсулина в формировании риска ДЗМЖ у женщин с МС. У здоровых мы не определяли пороговых значений указанных показателей, так как частота ДЗМЖ у них в 2,4 раза реже выявляется, чем при МС.
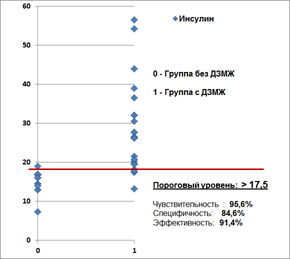
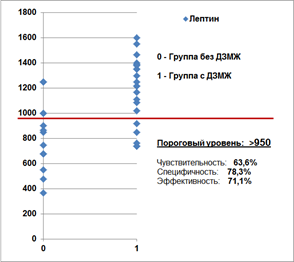
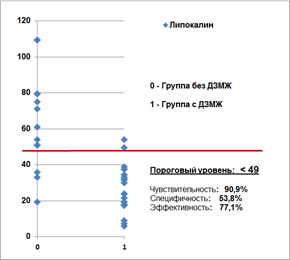
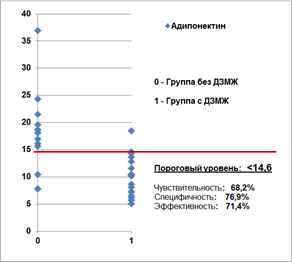
В связи с выявленными различиями уровней адипокинов при наличии или отсутствии ДЗМЖ следующим этапом нашего исследования было определение пороговых уровней адипокинов, которые имели бы прогностическое значение для определения риска развития ДЗМЖ. Для этого мы использовали методику ROC-анализа с расчётом параметров чувствительности и специфичности для отдельных уровней показателей. Полученная ROC-кривая отражает соотношение истинно положительного прогноза (чувствительность) к ложноположительному прогнозу (100 — специфичность) для всего диапазона значений изучаемого показателя. Оптимальным пороговым уровнем сывороточных концентраций адипоцитокинов для оценки формирования риска развития ДЗМЖ является значение показателя с оптимальным балансом чувствительности и специфичности (максимальная прогностическая эффективность). Результаты проведенного анализа с оценкой адекватности представленных моделей (согласно коэффициенту AUC) приведены в таблице 6.
Таблица 6.
Пороговые значения показателей для прогноза развития дисгормональных заболеваний молочных желез у пациенток с метаболическим синдромом
|
Пока-затели |
Пороговые значения |
Чувстви-тельность (%) |
Специ-фичность (%) |
Прогнос-тическая эффективность (%) |
Оценка адекватности модели (AUC, p) |
|
Инсулин |
> 17,5 mIU/mL |
95,6 (77,2—99,9) |
84,6 (54,6—98,1) |
91,4 (76,9—98,2) |
AUC=0,95; p=0,0001 |
|
Лептин |
> 950 ng/ml |
63,6 (40,7—82,8) |
78,3 (56,3—92,5) |
71,1 (55,7—83,6) |
AUC=0,79; p=0,001 |
|
Липокалин |
< 49,0 ng/ml |
90,9 (70,8—98,9) |
53,8 (25,1—80,8) |
77,1 (59,9—89,6) |
AUC=0,76; p=0,008 |
|
Адипонектин |
< 14,6 rg/ml |
68,2 (45,1—86,1) |
76,9 (46,2—95,0) |
71,4 (53,7—85,4) |
AUC=0,87; p=0,0007 |
|
Резистин |
> 6,0 ng/ml |
63,6 (40,7—82,8) |
61,5 (31,6—86,1) |
62,9 (44,9—78,5) |
AUC=0,61; p=0,21 |
|
Ретинол связывающий протеин-4 |
< 52,0 mg/l |
59,1 (36,4—79,3) |
38,5 (13,9—68,4) |
51,4 (34,0—68,6) |
AUC=0,56; p=0,34 |
Графическая характеристика пороговых уровней основных статистически значимых показателей относительно фактического распределения значений в группах в зависимости от наличия ДЗМЖ представлена на рисунке 1.
|
|
|
|
|
|
|
|
|
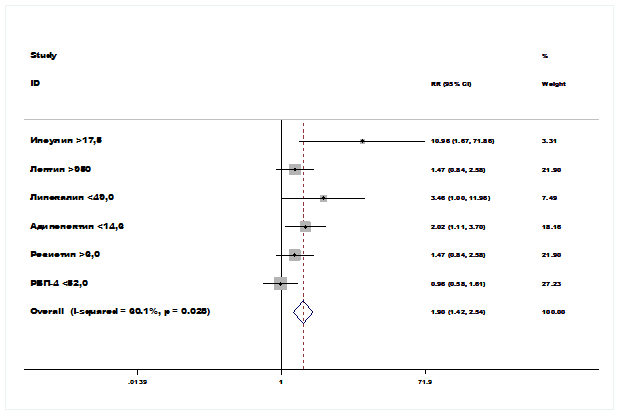
Базируясь на полученных пороговых значениях отдельных показателей, мы провели оценку относительного риска частоты ДЗМЖ для соответствующих диапазонов показателей — выше и ниже пороговых значений (рис. 2). Полученные результаты свидетельствуют о том, что статистически значимое повышение вероятности развития ДЗМЖ может быть обусловлено повышением уровня инсулина >17,5 mIU/mL (относительный риск 10,9; р<0,05), снижением уровня липокалина <49,0 ng/ml (относительный риск 3,46; р<0,05), а также снижением уровня адипонектина <14,6 rg/ml (относительный риск 2,0; р<0,05).
Повышение уровня лептина >950,0 ng/ml и уровня резистина >6,0 ng/ml (относительные риски соответствуют 1,47) формируют тенденцию к повышению риска ДЗМЖ (относительный риск 1,47; р>0,05).
Прогностическая оценка исследуемых факторов не является однородной — коэффициент гетерогенности относительных рисков изучаемых параметров І2=60,1 % (р=0,028), что является предпосылкой необходимости комплексного похода в оценке изучаемых показателей.
|
|
Заключение. Итак, результаты нашего исследования четко показали, что у женщин с МС существенно повышен риск развития доброкачественных заболеваний молочных желез. При этом влияние ожирения на этот риск реализуется за счет ассоциированного с гиперплазией адипоцитов нарушения концентраций некоторых адипоцитокинов (снижения уровней адипонектина и липокалина при повышении уровней лептина и резистина) на фоне гиперинсулинемии. При этом наибольшее влияние на формирование риска ДЗМЖ имеет гиперинсулинемия: при повышении сывороточный концентрации инсулина выше 17,5 mIU/mL вероятность развития доброкачественной патологии груди увеличивается почти в одиннадцать раз. В результате проведенных исследований выявлено, что наличие доброкачественных заболеваний молочных желез сопровождается существенным изменением уровней адипонектина и резистина на фоне гиперинсулинемии. Полученные нами результаты подтверждают гипотезу [2, 7, 10] о том, что инсулин, помимо метаболических, обладает еще и митогенными и антиапоптотическими свойствами. Известно, что гормонозависимые паренхиматозные клетки молочной железы физиологически окружены адипоцитами в своеобразную микросреду. При ожирении активно синтезируемые жировыми клетками цитокины могут оказывать непосредственное локальное влияние на процессы ангиогенеза и участвовать в местных провоспалительных механизмах, не только формируя дисгормональную гиперпролиферативную патологию груди в репродуктивном возрасте, но и существенно увеличивая риск канцерогенеза в постменопаузе [2, 16]. С этой точки зрения, модификация образа жизни у женщин репродуктивного возраста с МС (потеря веса, увеличение физической активности, диетические изменения) важна не только в свете предупреждения развития сахарного диабета второго типа, инсульта и кардиоваскулярных заболеваний, но и с целью профилактики рака молочных желез в постменопаузе.
Список литературы:
1.Broch M. Circulating retinol-binding protein-4, insulin sensiivity, insulin secretion, and insulin disposition index in obese and nonobese subjects / Broch M, Vendrell J, Ricart W, Richart C, Fernández-Real JM // Diabetes Care. — 2007. — № 30. — Р. 1802—1806.
2.Caldefie-Chézet F. Leptin: Involvement in the pathophysiology of breast cancer / Caldefie-Chézet F, Dubois V, Delort L, Rossary A, Vasson MP // Ann Endocrinol (Paris). — 2013. — № 74(2). — Р. 90—101.
3.Cavusoglu E. Adiponectin is an independent predictor of all-cause mortality, cardiac mortality, and myocardial infarction in patients presenting with chest pain / Cavusoglu E, Ruwende C, Chopra V, Yanamadala S, Eng C, Clark LT, Pinsky DJ, Marmur JD // Eur Heart J. — 2006 — № 27. — Р. 2300—2309.
4.Cho YM. Plasma retinol-binding protein-4 concentrations are elevated in human subjects with impaired glucose tolerance and type 2 diabetes / Cho YM, Youn BS, Lee H, Lee N, Min SS, Kwak SH, Lee HK, Park KS // Diabetes Care. — 2006. — № 29. — Р. 2457—2461.
5.Craig RL. Retinol binding protein 4 as a candidate gene for type 2 diabetes and prediabetic intermediate traits / Craig RL, Chu WS, Elbein SC Mol // Genet Metab. — 2007. — № 90. — Р. 338—344.
6.Duncan BB. Adiponectin and the development of type 2 diabetes: the Atherosclerosis Risk in Communities Study / Duncan BB, Schmidt MI, Pankow JS, Bang H, Couper D, Ballantyne CM, Hoogeveen RC, Heiss G // Diabetes 2004. — № 53. — Р. 2473—2478.
7.Fernández-Real JM. Innate immunity, insulin resistance and type 2 diabetes / Fernández-Real JM, Pickup JC // Trends Endocrinol Metab. — 2008. — № 19. — Р. 10—16.
8.Flo TH. Lipocalin 2 mediates an innate immune response to bacterial infection by sequestrating iron / Flo TH, Smith KD, Sato S, Rodriguez DJ, Holmes MA, Strong RK, Akira S, Aderem A // Nature. — 2004. — № 432. — Р. 917—921.
9.Graham TE. Retinol-binding protein 4 and insulin resistance in lean, obese, and diabetic subjects / Graham TE, Yang Q, Blüher M, Hammarstedt A, Ciaraldi TP, Henry RR, Wason CJ, Oberbach A, Jansson PA, Smith U, Kahn BB // N Engl J Med. — 2006; 354. — P. 2552—2563.
10.Gross A. Adipocytokines, Inflammation, and Breast Cancer Risk in Postmenopausal Women: A prospective study / Gross A, Newschaffer CJ, Hoffman Bolton JA, Rifai N, Visvanathan K // Cancer Epidemiol Biomarkers Prev. — 2013. — № 7. — Р.
11.Hou WK. Adipocytokines and breast cancer risk / Hou WK, Xu YX, Yu T, Zhang L, Zhang WW, Fu CL, Sun Y, Wu Q, Chen L // Chin Med J (Engl). — 2007. — № 120(18). — Р. 1592-6.
12.Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K.: Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Invest. — 2006. — № 116. — Р. 1784—1792.
13.Kim JY. Obesity-associated improvements in metabolic profile through expansion of adipose tissue / Kim JY, van de Wall E, Laplante M, Azzara A, Trujillo ME, Hofmann SM, Schraw T, Durand JL, Li H, Li G, Jelicks LA, Mehler MF, Hui DY, Deshaies Y, Shulman GI, Schwartz GJ, Scherer PE // J Clin Invest. — 2007. — № 117. — P. 2621—2637.
14.Kistorp C. Plasma adiponectin, body mass index, and mortality in patients with chronic heart failure / Kistorp C, Faber J, Galatius S, Gustafsson F, Frystyk J, Flyvbjerg A, Hildebrandt P // Circulation. — 2005; 112. — P. 1756—1762.
15.Lee JW. Visceral adiposity is associated with serum retinol binding protein-4 levels in healthy women / Lee JW, Im JA, Lee HR, Shim JY, Youn BS, Lee DC // Obesity (Silver Spring). — 2007. — № 15. — P. 2225—2232.
16.Ligibel JA. Obesity and its impact on breast cancer / Ligibel JA, Strickler HD // Am Soc Clin Oncol Educ Book. — 2013. — Р. 52—9.
дипломов


Комментарии (2)
Оставить комментарий