Статья опубликована в рамках: VIII Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 11 апреля 2012 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции, Сборник статей конференции часть II
- Условия публикаций
- Все статьи конференции
дипломов
ПАРОУГЛЕКИСЛОТНАЯ КОНВЕРСИЯ МЕТАНА КАК МЕТОД ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА ЗАДАННОГО СОСТАВА ДЛЯ МАЛОГАБАРИТНЫХ ПРОИЗВОДСТВ МЕТАНОЛА И СИНТЕТИЧЕСКИХ УГЛЕВОДОРОДОВ
Демидов Дмитрий Вячеславович
аспирант, кафедра технологии изотопов и водородной энергетики РХТУ им. Д. И. Менделеева г. Москва
Розенкевич Михаил Борисович
д-р хим наук, проф., кафедра технологии изотопов и водородной энергетики РХТУ им. Д. И. Менделеева г. Москва
Сахаровский Юрий Александрович
д-р хим наук, проф., кафедра технологии изотопов и водородной энергетики РХТУ им. Д. И. Менделеева г. Москва
E-mail: dmitriydemidov@rambler.ru
Разведанные запасы традиционного природного газа составляют около 150 трлн м3, потенциальные запасы оцениваются в пятикратном размере, нетрадиционные ресурсы природного газа огромны. Но расширение географических границ мирового топливно-энергетического комплекса приводит к значительному усложнению технологического оборудования добычи, транспорта и переработки углеводородного сырья, что, в свою очередь, приводит к заострению внимания на более полной выработке разработанных месторождений. В связи с этим уже не вызывает сомнения, что в ближайшем будущем важную роль будут играть природный газ и газохимические процессы. Проблема конверсии углеводородных газов в жидкие химические продукты за последнее десятилетие превратилась из ограниченной технологической задачи в одну из наиболее важных глобальных проблем мировой экономики.
В России утилизация низконапорных газов и попутных нефтяных газов, сжигаемых в основном на факелах, до сих пор не получила распространения. При этом Российская Федерация занимает лидирующее положение в мире по количеству сжигаемого углеводородного сырья. В настоящий момент доля перерабатываемого ПНГ составляет 70—75 %, а количество сжигаемого ежегодно только ПНГ, в зависимости от разных информационных источников, колеблется от 15 до 50 млрд м3 [2, c. 3]. В результате возникает ситуация, когда значительные территории, расположенные в непосредственной близости от энергоресурсов (например, Западная Сибирь), испытывают потребность в энергоносителях. Более того, газодобывающее предприятие выплачивает штрафы за выброс образующихся в процессе горения вредных веществ в атмосферу. Решение этой проблемы видится только в организации рационального использования этих запасов путем строительства малотоннажных установок химического или энергетического профиля, ориентированных на локального потребителя.
Существуют два принципиально различных способа преобразования газообразных углеводородов в жидкие углеводороды, метанол, аммиак и другие продукты. Первый — это одностадийный процесс прямого окисления углеводородных газов в синтетические углеводороды, метанол, формальдегид и другие оксигенаты. Эти процессы были разработаны в 30—40-е года, но до сих пор остается много вопросов, касающихся осуществления подобных процессов. НО несмотря на большой интерес к процессам прямого окисления, в виду сложившейся экономической обстановки, последний завод, использовавший технологию прямого окисления, был закрыт в середине 50-х годов.
Второй путь — это современные двухстадийные каталитические процессы получения целевых продуктов через стадию получения синтез-газа конверсией легких углеводородов. Развитие этих процессов не останавливалось с момента их открытия, несмотря на такие недостатки, как сложность технологической схемы и значительные энергозатраты. Классическое решение этих проблем — увеличение мощности производства, к сожалению, трудно совместимо с реальными условиями современной газо- и нефтедобывающей промышленности [1, с. 228—230].
Современное состояние дел в отечественной науке относительно вопросов переработки газообразных углеводородов в различные синтетические продукты таково, что значительная часть работ посвящена разработке процессов переработки уже готового синтез-газа в продукты, а также исследованиям свойств каталитических систем процессов окисления метана, синтеза углеводородов, метанола и т. д. В случае изучения процессов получения продуктов из синтез-газа, рабочие параметры процессов достаточно близки к промышленным. Так, например, при изучении синтеза Фишера-Тропша рабочие параметры колеблются в пределах 20 — 40 атм и 160—260 oС в зависимости от типа катализатора и необходимого состава продуктов. Рабочие параметры при изучении каталитической активности и селективности катализаторов также вполне могут быть осуществлены в данных пределах. При этом стадии получения синтез-газа должного внимания не уделяется, а эксперименты по изучению каталитических свойств ведутся в условиях, значительно отличающихся от рабочих ( T=900-1100 oC, P=5-30 атм). В результате возникает проблема несоответствия экспериментальных катализаторов конверсии практическим условиям проведения процесса. Тем не менее, стадия производства синтез-газа является самой дорогостоящей стадией всего процесса, внося 50—75 % вклад в себестоимость продукции.
Наиболее перспективным способом осуществления конверсии метана является сочетание процессов окисления метана кислородом, паровой и углекислотной конверсии метана. Комбинация двух или трех видов окислительной конверсии метана может привести к повышению эффективности использования сырья, улучшению теплового баланса и позволяет корректировать состав синтез газа. Добавка CO2 к смеси CH4+H2O позволяет оптимизировать состав получаемого синтез-газа в соответствии с составом, необходимым для дальнейшей переработки.
В условиях России наиболее близким процессом, который возможно использовать в малогабаритном исполнении, является хорошо известный процесс получения водорода методом паровой конверсии метана, в ходе которого образуется синтез-газ с соотношением H2/CO=3—7. Варьирование этого соотношения возможно путем добавления к углеводородному сырью диоксида углерода. Важным достоинством этого метода является отсутствие кислорода в процессе, требующего отдельного кислородного производства, значительно увеличивающего капиталовложения. Аппаратное оснащение такого процесса в незначительной мере отличается от классической схемы, а в качестве каталитической системы возможно использование уже существующих катализаторов. Кроме того, в настоящее время компанией BP на Аляске осуществлен запуск пилотной установки, в которой применен аппарат паровой конверсии метана металлоемкостью на 75 % меньшей, по сравнению с аналогичными.
В случае синтеза метанола или углеводородов, необходимое соотношение H2/CO=2 достигается, если CH4/CO2=3 в соответствии со стехиометрией реакции:
3CH4+СO2+2Н2О↔4CO+8H2 +57 ккал/моль (1)
Условия проведения процесса пароуглекислотной конверсии с получением синтез-газа, пригодного для использования, должны удовлетворять следующим требованиям:
- отсутствие коксообразования;
- остаточное содержание метана и диоксида углерода в синтез-газе не должно превышать 7—8 %;
- модуль синтез газа должен лежать в пределах 2.1—2.2.
Отсутствие коксообразования имеет особое значение с точки зрения сохранения активности и стабильности катализатора пароуглекислотной конверсии. Отложение углерода на поверхности катализатора может приводить к блокированию активных центров и уменьшению каталитической активности, вплоть до полной дезактивации катализатора. Кроме того, образование углеродных волокон при разложении метана может приводить к разрушению поверхности катализатора и ухудшению теплообмена. Поэтому в литературе большое внимание уделено улучшению устойчивости катализаторов к коксообразованию в процессе конверсии метана. Также в последние годы в литературе появилось много работ, посвященных расчету термодинамического равновесия методом минимизации энергии Гиббса для процессов реформинга.
К сожалению, до настоящего момента работы по экспериментальному подтверждению результатов рассчитанных условий проведения процесса пароуглекислотной конверсии в литературе отсутствовали. Поэтому в данной работе было осуществлено сравнение результатов расчетных данных с экспериментальными результатами, полученными на промышленном катализаторе ГИАП-19, применяемом в производстве водорода. Использование уже разработанных катализаторов в процессе получения синтез-газа может в значительной мере облегчить создание технологии производства синтетических топлив и ускорить их применение в промышленности.
Основными газообразными веществами, образующимися в процессе пароуглекислотной конверсии, являются H2, CO, CO2, H2O, CH4 и твердые отложения углерода. Кроме реакций паровой и углекислотной конверсий метана, пароуглекислотный реформинг метана на Ni-, Co-, Rh-, Ru- и Pt- катализаторах сопровождается реакцией водяного сдвига и различными процессами образования кокса [3, 5, 6, 7]. Реакции, протекающие в ходе пароуглекислотной конверсии метана, можно представить следующими уравнениями:
Паровой реформинг метана:
CH4+Н2О↔CO+3H2 (2)
CH4+2Н2О↔CO2+4H2 (3)
Углекислотный реформинг метана:
CH4+СО2↔CO+H2 (4)
Реакция водяного сдвига:
CO+Н2О↔CO2+H2 (5)
Реакции коксообразования:
2CO↔CO2+С (6)
CH4↔C+2H2 (7)
CO+Н2↔C+H2O (8)
CO2+2Н2↔C+2H2O (9)
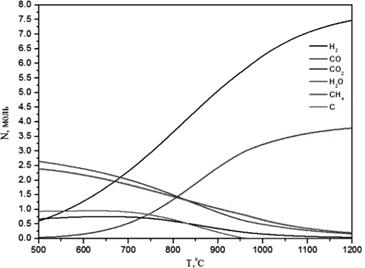
Рис. 1. Равновесный состав смеси, получаемый в процессе пароуглекислотной конверсии метана (СН4:СО2:Н2О=3:1:2, р=20 атм.)
На рисунке 1 показан равновесный состав смеси, получаемый в процессе пароуглекислотной конверсии (1) при давлении 20 атм. Необходимый для синтеза метанола или синтеза Фишера — Тропша модуль синтез-газа 2.1—2.2 достигается при температурах 870—890 ˚С. Однако при этих условиях велика доля коксовых отложений 6.3—8.5 % и синтез-газ содержит значительные количества метана 12.2—13.7 %, при этом содержание CO2 не превышает 5 %.
Вклад каждой из реакций (6) — (9) в процесс коксообразования приведен на рисунке 2. При температурах 850—900 ˚С наибольшее количество углеродных отложений дают реакции диспропорционирования моноксида углерода (6) и пиролиза метана.
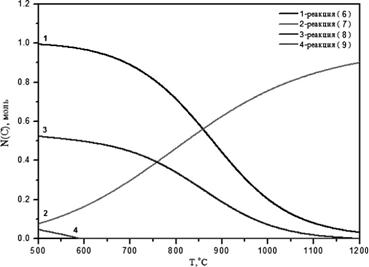
Рис. 2. Вклад различных реакций в коксообразование при давлении 20 атм.
Заметно меньший вклад вносит реакция (8), а углерод, образующийся по уравнению (9), исчезает при температурах выше 600 ˚С. Увеличение температуры процесса приводит к возрастанию количества кокса, полученного при пиролизе метана (7), а вклад в коксообразование реакций (6) и (8) напротив, снижается. Подавить коксообразование и минимизировать количество примесей в синтез-газе можно путем оптимизации соотношений CO2/CH4 и H2O/CH4 в исходной смеси. С этой целью были рассчитаны зависимости содержания кокса, метана и диоксида углерода в синтез-газе и модуля синтез газа от мольных соотношений CO2/CH4 и H2O/CH4 в исходной смеси при различных температурах. Содержание кокса определяется как отношение мольной доли углерода в коксе к общему количеству молей углерода в системе. Содержания метана и диоксида углерода в синтез-газе рассчитывается без учета водяных паров. Точки на графиках обозначаются как пара чисел (x,y), где: x — мольное соотношение CO2/CH4 в исходной смеси, а y — мольное соотношение H2O/CH4.
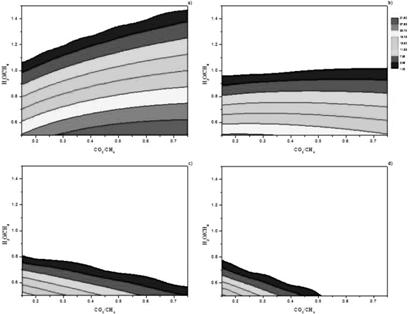
Рис. 3. Зависимость содержания кокса (%) от мольных соотношений СО2/СН4 и Н2О/ СН4 при давлении 20 атм и температурах 700 ºС (a), 800 ºС (b), 900 ºС (c) и 1000 ºС (d).
На рисунке 3 приведены зависимости содержания кокса от мольных соотношений CO2/CH4 и H2O/CH4 при давлении 20 атм и температурах 700—1000°С. При температуре 700°С почти во всем диапазоне мольных соотношений CO2/CH4 и H2O/CH4 наблюдается коксообразование за исключением небольшой области, лежащей выше прямой (0.15,1.1; 0.75,1.5). Увеличение температуры приводит к последовательному уменьшению зоны коксообразования. Для температуры 800°С эта зона ограничена прямой (0.15,1.0; 0.75,1.05), для 900°С — прямой (0.15,0.85; 0.75,0.6) и для 1000°С — прямой (0.15,0.8; 0.55,0.55).
Для температуры 700°С во всем диапазоне значений мольных соотношений CO2/CH4 и H2O/CH4 значения модуля 2.1—2.2 не достигаются. При переходе к более высоким температурам, с учетом ограничений, налагаемых процессом коксообразования, области значений мольных соотношений CO2/CH4 и H2O/CH4, для которой модуль синтез-газа составляет 2.1—2.2, ограничиваются следующими четырехугольниками. Для температуры 800°С — четырехугольник (0.46,1.05; 0.52,1.1; 0.65,1.5; 0.74,1.5), для 900°С — (0.25,0.79; 0.3,0.83; 0.48,1.5; 0.55,1.5) и для 1000°С — (0.22,0.75; 0.26,0.71; 0.4,1.5; 0.49,1.5). Как видно, при увеличении температуры оптимальное мольное соотношение CO2/CH4 смещается в сторону более низких значений.
Области, соответствующие максимальной степени конверсии исходных реагентов при отсутствии коксообразования, характеризуются следующими координатами: 800°С — (0.53,1.22; 0.57,1.18; 0.66,1.32; 0.61,1.4), 900°С — (0.35,1.1; 0.4,1.05; 0.49,1.3; 0.45,1.4), 1000°С — (0.26,0.95; 0.31,0.9; 0.42,1.23; 0.36,1.38).
Аналогично были выбраны оптимизированные диапазоны мольных соотношений CH4/CO2/H2O для процесса пароуглекислотной конверсии при различных температурах в диапазоне давлений 1—40 атм, представленые в таблице 1. Для каждой области найдены мольные соотношения CH4/CO2/H2O, при которых содержание примесей в синтез газе достигает минимальных значений при данных температуре и давлении.
Таблица 1.
Оптимизированные диапазоны мольных соотношений CH4/CO2/H2O для процесса пароуглекислотной конверсии метана.
|
T, °С |
p, атм |
CH4/CO2/H2O |
|
800 |
1 |
1/0.28–0.45/0.75–1.13 |
|
5 |
1/0.42–0.53/1.05–1.3 |
|
|
10 |
1/0.45–0.67/1.00–1.45 |
|
|
15 |
1/0.45–0.59/1.05–1.35 |
|
|
20 |
1/0.53–0.66/1.18–1.4 |
|
|
40 |
1/0.57–0.75/1.22–1.50 |
|
|
900 |
1 |
1/0.27–0.37/0.75–1.04 |
|
5 |
1/0.25–0.4/0.8–1.18 |
|
|
10 |
1/0.32–0.53/0.95–1.34 |
|
|
15 |
1/0.35–0.55/1.00–1.35 |
|
|
20 |
1/0.35–0.49/1.05–1.4 |
|
|
40 |
1/0.32–0.55/0.95–1.5 |
|
|
1000 |
1 |
1/0.27–0.33/0.7–0.91 |
|
5 |
1/0.26–0.36/0.8–1.05 |
|
|
10 |
1/0.25–0.4/0.8–1.17 |
|
|
15 |
1/0.31–0.39/0.93–1.25 |
|
|
20 |
1/0.26–0.42/0.9–1.38 |
|
|
40 |
1/0.36–0.43/1.15–1.3 |
Полученные оптимизированные мольные соотношения для процесса пароуглекислотной конверсии метана и соответствующие им параметры синтез-газа приведены в таблице 2.
Таблица 2.
Оптимизированные мольные соотношения CH4/CO2/H2O для процесса пароуглекислотной конверсии метана и соответствующие им параметры синтез-газа
|
T, °С |
p, атм |
CH4/CO2/H2O |
CO2,% |
CH4,% |
H2/CO |
ΔH, ккал/моль |
|
800 |
1 |
1/0.31/0.83 |
1.68 |
1.46 |
2.18 |
52.81 |
|
5 |
1/0.42/1.03 |
6.08 |
5.85 |
2.19 |
44.22 |
|
|
10 |
1/0.49/1.14 |
9.43 |
9.62 |
2.18 |
37.95 |
|
|
15 |
1/0.54/1.23 |
11.95 |
12.12 |
2.19 |
34.15 |
|
|
20 |
1/0.58/1.30 |
13.96 |
14.00 |
2.19 |
31.48 |
|
|
40 |
1/0.67/1.45 |
19.13 |
19.04 |
2.18 |
25.08 |
|
|
900 |
1 |
1/0.27/0.78 |
0.46 |
0.53 |
2.18 |
54.93 |
|
5 |
1/0.32/0.91 |
2.16 |
2.17 |
2.18 |
51.41 |
|
|
10 |
1/0.36/1.03 |
3.81 |
3.90 |
2.18 |
47.93 |
|
|
15 |
1/0.40/1.14 |
5.31 |
5.18 |
2.19 |
45.49 |
|
|
20 |
1/0.43/1.22 |
6.51 |
6.35 |
2.18 |
43.38 |
|
|
40 |
1/0.51/1.44 |
10.12 |
9.89 |
2.18 |
37.50 |
|
|
1000 |
1 |
1/0.26/0.76 |
0.15 |
0.2 |
2.18 |
55.58 |
|
5 |
1/0.28/0.84 |
0.84 |
0.82 |
2.19 |
54.21 |
|
|
10 |
1/0.30/0.91 |
1.53 |
1.62 |
2.18 |
52.52 |
|
|
15 |
1/0.32/0.99 |
2.24 |
2.24 |
2.18 |
51.23 |
|
|
20 |
1/0.34/1.07 |
2.93 |
2.75 |
2.18 |
50.16 |
|
|
40 |
1/0.39/1.27 |
4.95 |
4.81 |
2.19 |
46.16 |
Расчет оптимизированных мольных соотношений был осуществлен методом минимизации энергии Гиббса [4].
Эксперименты, подтверждающие правильность термодинамических расчетов, проводились при давлении 5 атм. Выбор этого давления обусловлен тем, что при давлении 5 атм во всем диапазоне температур рассчитанное содержание метана и диоксида углерода в получаемом синтез-газе составляет менее 7 %. Кроме того с увеличением давления эксперимент в значительной мере усложняется, так как используемое оборудование требует более высоких механических характеристик, а также возрастает вероятность неконтролируемого коксообразования в нижних слоях каталитического слоя, где эндотермическая реакция протекает наиболее интенсивно.
В качестве модельной каталитической системы был выбран катализатор ГИАП-19, применяемый в промышленном процессе получения водорода конверсией газообразных углеводородов. Этот катализатор состоит из оксидов никеля (~26.5±1.5 %масс.) и кальция (10±2 %масс.) на основе оксида алюминия (>57 %масс.).
Экспериментальный стенд представлял собой проточную систему, центральной частью которой является трубка из термостойкого сплава ХН45Ю диаметром 16×2 мм и длиной 300 мм. Трубка была помещена в однозонную электрическую печь, позволяющую работать при температурах до 1400°C включительно. В верхнюю зону трубки помещали 5 мл катализатора, предварительно измельченного до гранул размером 0.4—0.5 мм. В начальной зоне, середине и на верхней границе устанавливались три термопары. Сравнение рассчитанного и экспериментально полученного составов производилось по показаниям термопары регистрирующей температуру на верхней границе катализатора.
На каталитический слой подавалась смесь газов CH4/CO2 с объемной скоростью по метану 4800 ч-1. Так как при температурах свыше 500 °C возможен пиролиз метана, газовая смесь подавалась непосредственно на каталитический слой, смешиваясь с перегретым водяным паром. Расход полученного в ходе эксперимента синтез-газа регистрировался по откалиброванным газовым часам после конденсации непрореагировавшего водяного пара. Количественный состав исходной газовой смеси и синтез-газа регистрировался с помощью хроматографа «Кристаллюкс 4000» с погрешностью 0.1 % об. по каждому из компонентов, за исключением водорода, во всем измеряемом диапазоне концентраций. Расчет концентрации водорода осуществлялся по формуле:
СH2=100% — ∑СCH4,CO2,N2,СО (10)
Степень конверсии исходных реагентов определялась как:
KCH4, CO2=(1—![]() ) 100% (11)
) 100% (11)
Количественная оценка осуществлялась по азоту, расход которого составлял 60 л/ч.
Обсуждение результатов
В ходе эксперимента наблюдалась сильная эндотермическая реакция, в результате чего в нижней зоне каталитического слоя температура процесса была значительно ниже температуры верхнего слоя катализатора. Процесс контролировался по температуре верхней точки каталитического слоя с температурой 900 °С. Таким образом температура на всем каталитическом слое находилась в пределах 700—900 °С. Результаты полученные в ходе эксперимента в сравнении с параметрами, соответствующими термодинамическому равновесию при температуре 900 °С приведены в таблице 3.
Таблица 3.
Сравнение экспериментальных данных с параметрами процесса пароуглекислотной конверсии метана в условиях термодинамического равновесия при 900 0С
|
Сырьевой состав CH4/H2O/CO2 |
Содержание метана в синтез-газе CH4,% |
К СН4, % |
Содержание диоксида углерода в синтез-газе CO2,% |
К СО2, % |
Модуль синтез-газа H2/CO |
|||||
|
Эксп. |
Расч. |
Эксп. |
Расч. |
Эксп. |
Расч. |
Эксп. |
Расч. |
Эксп. |
Расч. |
|
|
1.0/1.5/2.0 |
4.47 |
0.09 |
77.9 |
99.5 |
29.75 |
21.08 |
28.0 |
46.8 |
1.34 |
1.06 |
|
1.0/1.5/1.5 |
5.83 |
0.16 |
74.4 |
99.3 |
25.21 |
16.03 |
27.5 |
49.4 |
1.54 |
1.29 |
|
1.0/1.5/1.0 |
7.55 |
0.28 |
69.7 |
98.7 |
19.25 |
11.00 |
23.9 |
51.0 |
2.04 |
1.64 |
|
1.0/1.5/0.5 |
10.22 |
0.53 |
64.6 |
97.8 |
13.17 |
6.34 |
8.2 |
46.8 |
2.79 |
2.23 |
|
1.0/1.5/0.0 |
13.15 |
1.12 |
60.1 |
95.6 |
7.08 |
2.53 |
0.0 |
— |
4.97 |
3.47 |
|
1.0/1.3/2.0 |
4.53 |
0.11 |
78.2 |
99.5 |
28.83 |
20.24 |
31.5 |
49.0 |
1.20 |
1.01 |
|
1.0/1.3/1.5 |
5.73 |
0.18 |
75.0 |
99.1 |
23.93 |
15.11 |
31.5 |
52.9 |
1.43 |
1.22 |
|
1.0/1.3/1.0 |
7.95 |
0.34 |
70.2 |
98.4 |
18.96 |
10.05 |
28.6 |
55.8 |
1.72 |
1.55 |
|
1.0/1.3/0.5 |
10.19 |
0.70 |
65.5 |
97.1 |
12.01 |
5.42 |
18.9 |
55.2 |
2.45 |
2.11 |
|
1.0/1.3/0.0 |
13.93 |
1.75 |
58.5 |
93.2 |
5.37 |
1.82 |
0.00 |
— |
4.50 |
3.32 |
|
1.0/1.1/2.0 |
3.13 |
0.12 |
85.6 |
99.4 |
30.38 |
19.32 |
31.2 |
52.4 |
1.02 |
0.95 |
|
1.0/1.1/1.5 |
4.41 |
0.22 |
81.3 |
99.0 |
21.95 |
14.10 |
39.3 |
56.5 |
1.17 |
1.15 |
|
1.0/1.1/1.0 |
6.22 |
0.43 |
76.8 |
98.1 |
16.35 |
9.00 |
40.3 |
60.9 |
1.42 |
1.47 |
|
1.0/1.1/0.5 |
8.95 |
0.97 |
71.0 |
96.0 |
10.02 |
4.40 |
35.0 |
64.0 |
1.94 |
2.00 |
|
1.0/1.1/0.0 |
13.51 |
3.03 |
63.3 |
88.8 |
4.76 |
1.13 |
0.0 |
— |
3.43 |
3.19 |
|
1.0/0.9/2.0 |
3.47 |
0.14 |
83.8 |
99.3 |
25.74 |
18.30 |
40.6 |
55.4 |
0.95 |
0.89 |
|
1.0/0.9/1.5 |
4.65 |
0.26 |
80.8 |
98.8 |
20.99 |
13.00 |
43.2 |
60.5 |
1.05 |
1.09 |
|
1.0/0.9/1.0 |
6.49 |
0.55 |
76.3 |
97.6 |
14.81 |
7.85 |
46.7 |
66.5 |
1.40 |
1.38 |
|
1.0/0.9/0.5 |
10.10 |
1.44 |
68.9 |
94.3 |
9.06 |
3.39 |
44.5 |
73.2 |
1.96 |
1.88 |
|
1.0/0.9/0.0 |
17.81 |
4.92 |
53.8 |
83.2 |
3.93 |
0.67 |
0.0 |
— |
3.95 |
3.25 |
В соответствии с представленными данными экспериментальная кривая модуля синтез-газа лежит выше линии соответствующей модулю синтез-газа обусловленному термодинамическим равновесием. Степень конверсии метана и диоксида углерода в значительной мере ниже термодинамически рассчитанной. Это может быть обусловлено недостаточной активностью катализатора, влиянием реакции водяного сдвига, наличием процесса коксообразования, а также возможной неточностью задачи расходов реагентов и хроматографического анализа. Результаты сранвнения в диапазоне температур 700—900 оС приведены на Рис. 4.
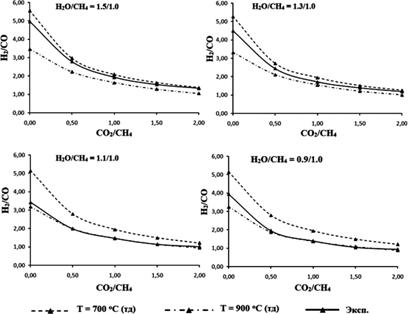
Рис. 4. Зависимость модуля синтез-газа от концентрации диоксида углерода при различных соотношениях H2O/CH4 в сравнении с зависимостями соответствующими термодинамическому равновесию при давлении 5 атм для температур 700 и 900 ОС.
При этом во время экспериментов с соотношением CH4/H2O=1/0.9 наблюдалось коксообразование, усиливающееся со снижением концентрации диоксида углерода в исходной смеси.
Уменьшение концентрации водяного пара в сырьевой смеси приводит к снижению модуля синтез-газа приближая показатели к показателям соответствующим термодинамическому равновесию, что свидетельствует о снижении влияния реакции водяного сдвига. При сохранении концентрации водяного пара не ниже соотношения CH4/H2O=1/1.05 образования кокса на катализаторе не наблюдалось.
В ходе работы удалось смоделировать процесс получения синтез-газа с модулем H2/CO=1.0—5.0, что подтверждает возможность использования стандартных катализаторов паровой конверсии в процессе получения синтез-газа варьируемого состава. Полученные зависимости соотношения водорода к моноксиду углерода хорошо соотносились с рассчитанными данными, что позволяет сделать вывод о достаточной точности термодинамических расчетов и возможности использования выбранных оптимальных сырьевых составов для получения синтез-газа для производств метанола и синтетических углеводородов. Низкие степени конверсии метана и диоксида углерода свидетельствуют о недостаточной каталитической активности катализатора, что могло быть вызвано высокой долей инерта в реакционной смеси, а также высокой объемной скоростью подачи реагентов. Снижение концентрации азота до 5 % по исходной газовой смеси с одновременным снижением объемной скорости подачи сырья по метану до 2000 ч-1 привело к значительному повышению степени конверсии метана до 96% и снижению доли примесей до 12 % об. при соотношении H2/CO=2.24.
Полученные данные позволяют сделать вывод о возможности использования стандартного промышленного катализатора как катализатора процесса пароуглекислотной конверсии метана при давлении 5 атм. и температуре не ниже 800 OС в процессе получения синтез-газа для производств метанола и синтетических углеводородов. Такие параметры процесса обеспечивают возможность проведения пароуглекислотной конверсии газообразных углеводородов низкого давления в синтез-газ с его дальнейшим компримированием перед стадией получения синтетических топлив.
Список литературы:
1. Арутюнов В. С. Прямое окисление углеводородных газов в оксигенаты: современное состояние и перспективы промышленной реализации // Газохимия в XXI веке.Проблемы и перспективы под. ред. проф. А. И. Владимирова ичл.-корр. РАН А. Л. Лапидуса: сб. научн. тр. M.:Нефть и газ, 2003. 288 с.
2. Книжников А., Пусенкова Н. Проблемы и перспективы использования нефтяного попутного газа в Росии// Экология и энергетика. Международный контекст. 2009. № 1. [электронный ресурс] - режим доступа — www.wwf.ru/data/news/5450/poputnygaz.pdf
3. Choudhary V. R, Mondal K. C. // Appl. Energy 2006. V. 83. P. 1024.
4. Demidov D. V., Mishin I. V., Mikhailov M. N. // International Journal of Hydrogen Energy, May 2011, P. 5941—5950.
5. Jeong J. H., Lee J. W., Seo D. J., Seo Y. K., Yoon W. L., Lee D. K. et al. // Appl. Catal A. 2006. V. 302. P. 151.
6. Li D., Atake I., Shishido T., Oumi Y., Sano T., Takehira K. // J. Catal. 2007. V. 250. P. 299.
7. Li D., Shishido T., Oumi Y., Sano T., Takehira K. // Appl. Catal A. 2007. V. 332. P. 98.
дипломов


Оставить комментарий