Статья опубликована в рамках: III Международной научно-практической конференции «Научное сообщество студентов: МЕЖДИСЦИПЛИНАРНЫЕ ИССЛЕДОВАНИЯ» (Россия, г. Новосибирск, 23 мая 2012 г.)
Наука: Технические науки
Секция: Ресурсосбережение
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
РАЗРАБОТКА ТЕХНОЛОГИИ ПОЛУЧЕНИЯ ФТОРИДА ВОДОРОДА ИЗ КРИОЛИТСОДЕРЖАЩИХ ОТВАЛОВ АЛЮМИНИЕВЫХ ПРОИЗВОДСТВ
Асанов Эльдар Булатович
студент 5 курса, кафедра ХТРЭ НИ ТПУ, г. Томск
E-mail: eldarasanov@mail.ru
Кривицкий Павел Евгеньевич
студент 5 курса, кафедра ХТРЭ НИ ТПУ, г. Томск
E-mail: gunsfavorite@mail.ru
Петлин Илья Владимирович
научный руководитель, ассистент, кафедра ХТРЭ НИ ТПУ, г. Томск
E-mail: ilya-petlin@yandex.ru
Введение
Во всем мире существуют различные сферы использования фторида водорода. Большие количества фторида водорода потребляет алюминиевая промышленность при производстве фторида алюминия, необходимого для получения металлического алюминия [1].
Алюминий получают путем электролитического восстановления глинозема в ванне из расплавленного криолита (Na3AlF6), фторида алюминия, фторида кальция и фторида магния [2]. Реакцию проводят в специальном электролизере, получаемый алюминий тяжелее используемого электролита и образует расплавленный слой на дне электролизера [4]. В ванну помещены угольные аноды и образующийся на аноде кислород приводит к его разрушению. Также в процессе электролиза алюминия, за счёт связывания находящегося в глинозёме натрия с фторидом алюминия образуется криолит. Весь фторид алюминия, который поступает на алюминиевые заводы в процессе электролиза, связывается в криолит и идёт в отвал. Это приводит к образованию большого количества твердых отходов (шламов), содержащих дорогостоящий фтор-ион, который выходит из оборота.
Кроме того отходы содержат ценные сырьевые вещества, как углерод, глинозем, криолит, фторид, сульфат и карбонат натрия, которые при их извлечении и переработке могут быть использованы в качестве сырья для производства фторида водорода, алюминия, жидкого стекла, коагулянтов и т.п. Поэтому исследования, направленные на разработку научных основ и технологии комплексной переработки этих отходов, представляют не только значительный экологический, но и большой экономический интерес.
Физико-химические основы процесса получения фторида водорода с использованием криолита.
Предлагается использовать криолит, содержащийся в составе твердых отходов производства алюминия для получения HF, путем взаимодействия Na3AlF6 c серной кислотой, которое выражается уравнением реакции:
2Na3AlF6+6H2SO4=12HF+3Na2SO4+Al2(SO4)3
Сульфатизация криолита возможна в барабанных вращающихся печах с дальнейшей нейтрализацией растворов и параллельным получением оксида алюминия.
Процесс получения фторида водорода с использованием криолита включает следующие основные стадии:
1. Сульфатизация криолита в барабанных вращающихся печах
2. Улавливание, конденсация и ректификация фторида водорода
3. Растворение сульфатных отвалов
4. Осаждение гидроксида алюминия
5. Фильтрация суспензии
6. Сушка и прокаливание пульпы до Al2O3.
Процесс может быть осуществлен на существующей аппаратурной базе заводов, без существенной ее модернизации.
Принципиальная схема процесса получения фторида водорода с использованием криолита представлена на рисунке 1.
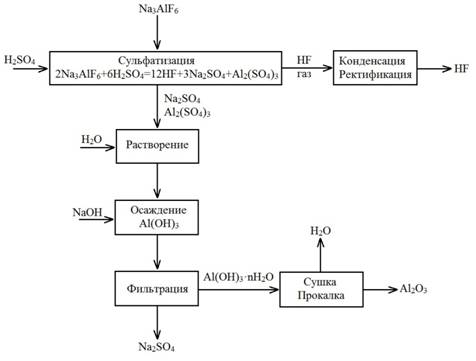
Рисунок 1 Схема переработки криолита
В результате процесса продуцируется HF, который при улавливании переводиться в фтористоводородную кислоту, используемую в производстве фторида алюминия, а так же для получения безводного фторида водорода.
Кроме того еще одним продуктом технологии является оксид алюминия, который может быть использован как в процессе получения алюминия, так и в других областях промышленности.
Термодинамический расчет реакции взаимодействия криолита с серной кислотой
Для исследования механизма реакции сульфатизации криолита был проведен термодинамический расчет возможности протекания реакции взаимодействия криолита с серной кислотой.
Определение равновесия химической реакции производили методом Темкина – Шварцмана, с учетом, что теплоемкость веществ не зависит от температуры:
![]() ,
,
где ΔН0298 определяют по стандартным теплотам образования, ΔS0298 определяют по стандартным абсолютным энтропиям компонентов.
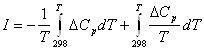 ,
,
где ΔСр – изменение молярной теплоемкости в результате протекания процесса при p = const.
![]() ,
,
где М0, М1, М2, М-2 – функции температуры.
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
Сведя выше указанные уравнения получили:
![]() ;
;
Результаты термодинамических расчетов реакции сульфатизации криолита представлены в таблице 1.
Таблица 1 Энергия Гиббса и константа равновесия реакции сернокислотного разложения криолита.
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Термодинамические расчеты сернокислотного разложения криолита показали возможность проведениям реакции, в сторону образования продуктов, при температуре выше 216°С.
Определение кинетических характеристик процесса сульфатизации криолитсодержащих отвалов
В ходе взаимодействия криолитсодержащих отвалов с серной кислотой, при нагревании, образуется газообразный фторид водорода.
В данной работе изучалось влияние температуры на скорость взаимодействия криолитсодержащих отвалов с серной кислотой.
Кинетические исследования проводили методом непрерывного взвешивания реагирующей смеси с автоматической регистрацией массы (рисунок 2).
В ходе эксперимента использовались смесь, состоящая из 5 г криолитсодержащих отвалов и 4,2 г серной кислоты, избыток 10 % от стехиометрически необходимого для образования фторида водорода. Степень превращения определяли по потере массы, которая обусловлена образованием газообразных HF и H2O.
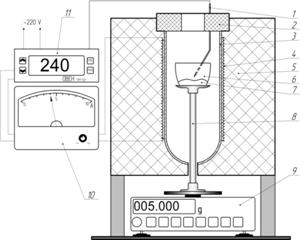
Рисунок 2 Схема кинетической установки.
1 – термопара; 2 – крышка; 3 – кварцевая трубка; 4 – ТЭН; 5 – теплоизоляция; 6 – платиновый тигель; 7 – навеска исследуемой смеси; 8 – подставка; 9 – электронные весы; 10 – амперметр; 11 –программный терморегулятор «ОВЕН».
Из результатов исследований была получена зависимость степени превращения от времени, представленная на рисунке 3
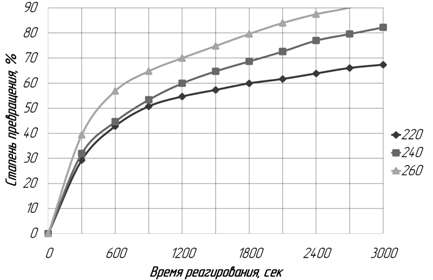
Рисунок 3 Зависимость степени превращения от времени.
Наиболее подходящим является уравнение Кранка-Гистлинга-Броунштейна:
1 – ⅔α – ( 1-α) 1/3 = k·t.
Это уравнение описывает модель нарастания на частице толстого слоя золы [3]. Именно по этому уравнению наблюдалась наибольшая линеаризация кинетических кривых.
По полученным температурным константам скорости был построен график в координатах уравнения Аррениуса: 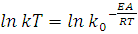 . Рисунок 4.
. Рисунок 4.
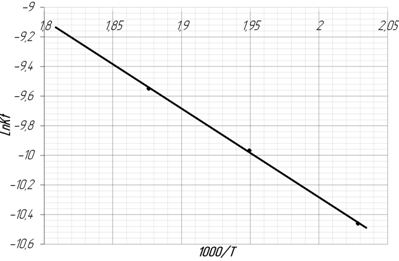
Рисунок 4. график в координатах уравнения Аррениуса
Из графика следует, что lnk0 = 1,8 , тогда k0= 6,05 с-1. Энергию активации находим по тангенсу угла наклона прямой линии E/R= tgφ=12,26/2,028·10-3 = 6045. Отсюда находим величину энергии активации E =6045·R= 50,2 кДж/моль.
Полученные значения константы скорости и энергии активации подставляем в исходное уравнение:
1 – ⅔α – ( 1-α) 1/3 =6,5 ·exp(-50258/ RT)·t.
В температурном интервале 220–260 °С кажущаяся энергия активации процесса составила около 50,2 кДж/моль. Процесс протекает во внешнекинетической области реагирования. Лимитирующей стадией процесса является взаимодействие реагентов. Способ ускорения процесса – повышение температуры.
Экспериментальная часть
Для определения оптимальных условий процесса сульфатизации криолитсодержащих отвалов алюминиевых производств была собрана лабораторная установка, представленная на рисунке 5.
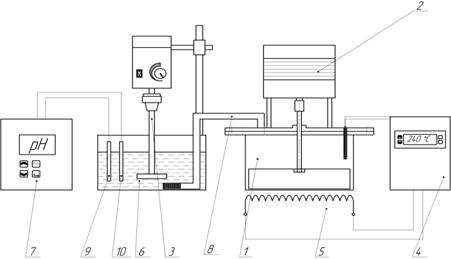
Рисунок 5. Лабораторная установка сульфатизации криолита: 1 – реактор; 2 – двигатель; 3 – мешалка; 4 - микропроцессорный программный регулятор температуры; 5 – теплоэлектронагреватель; 6 – улавливающий раствор; 7 – рН метр; 8 - трубка для отвода газа; 9- фторселективный электрод; 10 – электрод сравнения.
В результате процесса продуцируется фтороводород, который при улавливании водой переводится во фтористоводородную кислоту.
За ходом эксперимента следили по средствам определения концентрации образующейся фтористоводородной кислоты с помощью pH-метра. Для этого предварительно была проведена калибровка фтор-селективного электрода 0,1 N раствором NaF с последующим построением градуировочного графика зависимости значений pH-метра (мВ) и концентрации фтористоводородной кислоты.
Навеска массой 300 г помещалась в реактор и заливалась серной кислотой. Далее закрывалась крышка и включался двигатель перемешивающего устройства. Далее реакционная смесь нагревалась до заданной температуры. Диапазон температур 220-260˚С. Время процесса 1 – 1,5 часа.
Расход серной кислоты задавался до 15 % выше стехиометрического соотношения для более полного проведения реакции сульфатизации криолитсодержащих отвалов и для получения подвижной реакционной массы.
В результате экспериментов было достигнуто 99 % реагирование содержащегося в отвалах криолита при 84 % улавливании фтороводорода. Оптимальной температурой процесса принята температура – 240˚С.
Заключение
Предложено использование криолитсодержащих отвалов алюминиевых производств в процессе получения фторида водорода.
Разработана принципиальная схема процесса сульфатизации криолитсодержащих отвалов, с целью получения фторида водорода.
Термодинамические расчеты реакции сульфатизации криолита показали возможность проведения реакции сернокислотного разложения выше 216°С. При этом тепловой эффект составил около 65 кДж/моль.
В свою очередь кинетические расчеты определили, что лимитирующей стадией процесса является взаимодействие реагентов. Способ ускорения процесса – повышение температуры. Оптимальной температурой процесса принята температура – 240˚С.
Список литературы:
1. Тураев Н. С. Химия и технология урана / Н. С. Тураев, И. И. Жерин ; Томский политехнический университет. — М. : Руда и металлы, 2006. — 396 с.: ил. — Библиогр.: с. 390-393.
2. Химическая энциклопедия. В 5-ти тт. / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1. — С. 116. — 623 с.
3. Численные методы решения задач теплообмена и динамики жидкости/ С. Патанкар; – М.: Энергоатомиздат, 1984. – 152 с.
4. Электролиз в металлургии / Федотьев П. П.; - М.— Л., 1935.
дипломов


Оставить комментарий