Статья опубликована в рамках: XXXVIII Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 09 февраля 2016 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
дипломов
ПОЛУЧЕНИЕ ШТАММА МЕТИЛОТРОФНЫХ ДРОЖЖЕЙ PICHIA PASTORIS GS115,
ПРОДУЦИРУЮЩЕГО РЕКОМБИНАНТНУЮ β-ГАЛАКТОЗИДАЗУ
Асраркулова Анжелла Саидкаримовна
магистрант 2 курса, кафедра физиологии и биофизики НУУз, г. Ташкент
Азимова Шахноза Садыковна
научный руководитель, доктор биологических наук, зав. лаб. молекулярной генетики ИХРВ АН РУз, г. Ташкент
Левицкая Юлия Владимировна
научный руководитель, кандидат биологических наук, доцент НУУз,
г. Ташкент
С целью получения рекомбинантных ферментных препаратов используется дрожжевая система экспрессии, в частности дрожжи P.pastoris [6, с. 169]. Являясь эукариотическим организмом, P.pastoris имеет ряд преимуществ среди высших эукариотических систем экспрессии. К ним относятся процессинг и фолдинг белков, а также посттрансляционные модификации [8, с. 118].
В ходе получения нового штамма дрожжей используются молекулярные маркеры. Одним из таких маркеров является фермент β-галактозидаза [3, c. 601]. Данный фермент относится к классу гидролаз, отщепляющих концевой нередуцированный остаток β-D-галактозы в β-галактозидах с образованием свободных моносахаридов, либо переносящих остаток β-D-галактозы на молекулу лактозы с образованием галактоолигосахаридов [1, c. 52].
Целью работы являлось получение нового штамма метилотрофных дрожжей GS115 с использованием гена β-галактозидазы, как маркера экспрессии генов.
Материалы и методы. В работе были использованы бактериальный штамм E.coli TOP10F’, содержащий в себе плазмиду pPIC3.5/lacZ, и коммерческий штамм дрожжей P.pastoris GS115 (Invitrogen). Векторная конструкция pPIC3.5/lacZ была получена сотрудниками лаборатории молекулярной генетики ИХРВ АН РУз Сасмаковым С.А., Махневым А.А.
С целью трансформации дрожжевого штамма GS115 вектор pPIC3.5/lacZ выделяли из бактериального штамма методом щелочного лизиса [7, c. 55]. Для этого клетки E.coli инкубировали в жидкой LB среде (1% триптон, 0.5% дрожжевой экстракт, 1% NaCl, pH 7.0, ампициллин 100 мкг/мл) на орбитальном шейкере 14-16 ч., +37оС, 180 об/мин. Полученный осадок клеток последовательно обрабатывали: раствором I (50 мМ глюкоза, 25 мМ трис-HCl, pH 8.0, 10 мМ ЭДТА), раствором II (0.2Н NaOH, 1% SDS) и раствором III (5М ацетат калия pH 5.0). Далее разрушенные клетки центрифугировали, а в полученный супернатант добавляли 2.5V 96% этилового спирта. После осаждения пДНК в спирте, пробу вновь центрифугировали при 4500 rpm 30 мин +4оС, а осадок промывали 70% спиртом. Осадок высушили и растворили в TE буфере (10мМ трис-HCl рН 8.0, 1мМ ЭДТА).
Очистку пДНК проводили методом электроэлюирования в ванночку [2, c. 171]. Полученные образцы осаждали в 2.5V 96% этилового спирта по вышеописанной методике. Концентрацию очищенной пДНК определяли на спектрофотометре GeneQuant II, которая составила 1 мкг/мкл.
Трансформацию дрожжевых клеток проводили методом электропорации [6, c. 176]. В работе использовался штамм GS115 Pichia pastoris, который имеет мутацию в гене гистидинол дегидрогеназа (his4). С целью получения электрокомпетентных дрожжевых клеток производили посев штамма GS115 на твердую YPD среду (1% дрожжевой экстракт, 2% пептон, 2% глюкоза, 2% агар-агар). Затем вырастили 5 мл культуры клеток дрожжей в жидкой YPD среде (1% дрожжевой экстракт, 2% пептон, 2% глюкоза) при 30°C в течение ночи. Далее инокулировали свежую YPD среду в объеме 500 мл 0,1-0,5 мл полученной суспензией клеток и инкубировали по достижении значений OD600 = 1.3–1.5. Полученную культуру клеток осаждали и последовательно промывали в ледяной стерил. воде и 1 М сорбитоле, сокращая объем суспензии клеток. Конечный объем суспензии составил 1.5 мл [5, c. 77].
Непосредственно перед трансформацией проводили линеаризацию пДНК по сайту рестрикции SalI (рис. 1) [5, c. 34]. Для данной реакции использовали 1 мкг пДНК и 1 ед. рестриктазы SalI. Реакцию проводили при 37оС. Процесс контролировали нанесением образца в агарозный гель. Данную процедуру выполняли до тех пор, пока вся пДНК не расщепилась. Реакцию останавливали добавлением 0.5 М ЭДТА (рН 7.5). пДНК эксрагировали смесью фенол-хлорофрм-изоамиловый спирт (25:24:1) и далее осаждали в 96% этиловом спирте. Осадок пДНК ресуспендировали в ТЕ буфере [2, c. 116].
Для трансформации 80 мкл суспензии электрокомпетентных клеток и линеаризованную пДНК в объемах 2, 3 и 5 мкл с концентрацией 1мкг/мкл переносили в ледяные 0.2 см кюветы для электропорации. Инкубировали кюветы на льду 5 минут и далее вносили их в Eppendorf Electroporator 2510. Электрический импульс подавали в течение 6 мс при 1500 В. После этого в смесь добавляли 1 мл ледяного 1 М сорбитола и переносили содержимое кюветы в стерильные микроцентрифужные пробирки. На селективные среды RDB (1 M сорбитол, 2% глюкоза, 1.34% YNB, 4 × 10-5% биотин, 0.005% аминокислоты, 2% агар) переносили по 200 мкл каждой пробы и инкубировали при 30°C. Селекцию трансформантов проводили по способности расти на среде без добавления гистидина, т.к. клонируемый вектор несет в себе ген HIS4. Контролем служила среда RDBH с добавлением гистидина (0.004%). Одиночные колонии на опытных и контрольных средах появлялись на 5 день после трансформации.
Для оценки уровня экспрессии рекомбинантного белка трансформанты культивировали при 30°C на орбитальном шейкере Incubator ES-20 по достижении OD600=2-6. Из полученных культур клеток готовили клеточные лизаты дрожжей. Клетки осаждали центрифугированием, а затем отмывали от среды с помощью Breaking buffer (7.8 г/л NaH2PO4 · 2H2O; 0.372 г/л ЭДТА; 50 мл/л глицерол) с добавлением PMSF (0.087г/мл). Отмытые клетки ресуспендировали в том же растворе до ОD600=200. Клетки лизировали методом стеклянных шариков (Sigma, 0,2µm) [5, c. 61].
Полученные лизаты клеток проверяли на β-галактозидазную активность по реакции гидролиза о-нитрофенил-β-D-галактопиранозида (ONPG) β-галактозидазой в Z-буфере (60 мМ Na2HPO4·7H2O, 40 мМ NaH2PO4·H2O, 10 мМ KCl, 1 мМ MgSO4·7H2O, 50 мМ β-меркаптоэтанол), при pH 7.0 и температуре 28оС. Реакцию завершили путем добавления 1 М Na2CO3. Продукт реакции, о-нитрофенол, определяли спектрофотометрически при λ=420 нм на спектрофотометре Specol 1300 UV, Analitic Jena [9, c. 344]. По данным зарубежных авторов активность очищенного фермента β-галактозидазы составляет 300000 единиц/мг белка [5, c. 91].
Результаты и их обсуждение.
В результате проведенных исследований были получены три культуры клеток P.pastoris (таб. 1). Эффективность трансформации определяли по формуле [4, с. 335]:
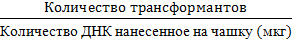 [2]
[2]
Таблица 1.
Данные по расчету эффективности трансформации.
|
|
Концентрация пДНК, нанесенная на селективную среду (мкг/мкл) |
||
|
0,4 |
0,55 |
0,9 |
|
|
Количество полученных трансформантов |
75 |
135 |
250 |
|
Эффективность трансформации (количество трансформантов/мкг пДНК) |
188 |
245 |
277 |
По данным расчётов установлено, что наиболее эффективной является трансформация с концентрацией пДНК 0,9 мкг. Эффективность при этом составила 277 трансформантов/мкг плазмидной ДНК.
Уровень экспрессии рекомбинантного белка определяли по реакции гидролиза субстрата ONPG β-галактозидазой. С этой целью использовались клоны, трансформированные пДНК в концентрации 0,9 мкг. Среднее значение активности фермента β-галактозидазы составило 133300 ед/мг белка.
Таким образом, в ходе проведенных исследований был получен новый штамм метилотрофных дрожжей P.pastoris GS115, экспрессирующий рекомбинантную β-галактозидазу. Оптимальными условиями проведения трансформации оказались: концентрация пДНК 0,9 мкг, время прохождения электрического импульса 6 мс при 1500 В. Активность рекомбинантной β-галактозидазы составила 133300 ед/мг белка. Последующие этапы работ будут связаны с экспрессией других белков.
Список литературы:
- Костеневич А.А., Сапунова Л.И. Бактериальные β-галактозидазы: биохимическое и генетическое разнообразие / Труды БГУ Обзоры. – 2013. - Том 8. Часть 1. - С. 52-63;
- Маниатис Т. и др. Методы генетической инженерии. Молекулярное клонирование: Пер. с англ. / Маниатис Т., Фрич Э., Сэмбрук Дж. – М.: Мир. - 1984, - 480 с., ил;
- Carla O. Recombinant microbial systems for improved β-galactosidase production and biotechnological applications / Carla O., Pedro M.R., Lucília D. // Biotechnology Advances. – 2011. №29. - P. 600–609;
- Frank H. S. Calculations for Molecular Biology and Biotechnology: A Guide to Mathematics in the Laboratory / Academic Press. – 2010. Second Edition. – P. 335-336;
- Invitrogen Pichia Expression Kit. For expression of recombinant proteins in Pichia pastoris: user guide / Life Technologies Corp. – 2014;
- James M. C. Expression in the Yeast Pichia pastoris / James M. Cregg, Ilya T., Anasua K., Jay S., Knut M., Thomas Ch. // Methods in Enzymology. – 2009. Vol. 463. - P. 169-189;
- Joseph S., David W. R. Molecular Cloning: a laboratory manual / Cold Spring Harbor Laboratory Press. – 2001. Third Edition. – P. 55-65;
- Pingzuo Li et. al. Expression of Recombinant Proteins in Pichia Pastoris / Applied Biochemistry and Biotechnology. – 2007. № 142. – P. 105–124;
- Rezaee A. et. al. A rapid and sensitive assay of β-galactosidase in yeast cells / Anals of Microbiology. – 2003. Vol. 53 №3. - P. 343–347.
дипломов


Оставить комментарий