Статья опубликована в рамках: XXV Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 25 ноября 2014 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
ИССЛЕДОВАНИЕ ПРОЦЕССОВ ВЗАИМОДЕЙСТВИЯ АМОКСИЦИЛЛИНА С ИОНАМИ МЕДИ (II )
Мкртычян Артур Геннадиевич
Горбачевская Лидия Альбертовна
Нюничкина Татьяна Андреевна
магистранты, химический факультет, Астраханский Государственный университет, РФ, г. Астрахань
E -mail: artur.bubnov@list.ru
Глинина Антонина Григорьевна
научный руководитель, канд. хим. наук, профессор, Астраханский Государственный университет, химический факультет, РФ, г. Астрахань
Глинина Елена Геннадиевна
научный руководитель, старший преподаватель, кафедра общей химии, химический факультет, Астраханский Государственный Технический Университет, РФ, г. Астрахань
Как известно, антибиотики (от греческих слов «анти» — против и «биос» — жизнь) — вещества, избирательно подавляющие жизненные функции некоторых микроорганизмов. Антибиотики кардинально изменили медицину: они позволили успешно бороться со многими опасными инфекциями, благодаря чему резко уменьшилась смертность и возросла продолжительность жизни людей. За многие годы развития фармацевтической промышленности, были изобретены сотни новых видов антибиотиков, соответствующих самым различным целям и задачам. Роль антибиотиков в процессах лечения различных заболеваний велика, передозировка любого препарата негативно влияет на процессы, происходящие в организме, и может вызывать отравление вследствие аллергической реакции [1].
В данной работе речь пойдёт об одном из антибиотиков пенициллиновой группы — амоксициллине. Амоксициллина тригидрат — антибиотик широкого спектра действия из группы полусинтетических пенициллинов, кристаллический порошок белого цвета, Тпл. 160—180 °С, малорастворим в воде и этиловом спирте, практически не растворим в эфире и жировых маслах, растворим в разбавленных кислотах и разбавленных гидроксидах щелочных металлов, растворим в смеси ацетонитрила и воды при рН 5 (элюенте). Относится к подгруппе аминопенициллинов. Нами были изучены процессы взаимодействия этого вещества с ионами меди в различных условиях [4].
Амоксициллин применяется для борьбы с разного рода инфекциями, такими как тонзиллит, воспаление легких, ушные воспаления, бронхит, воспаления мочеполовой системы, гонорея и кожные инфекции. При курсовом лечении необходимо проводить контроль над состоянием функции органов кроветворения, печени и почек [2].
Медь относят к так называемым «биометаллам», так как она входит в состав некоторых металлоферментов, необходимых для нормального протекания биохимических процессов. В небольших количествах соединения меди (II) должны постоянно поступать с пищей в организм человека. [24]Суточная потребность меди составляет ~2 мг. Недостаток меди так же вреден для человека, как и её избыток. Неслучайно соли меди(II) всё чаще вводят в состав поливитаминных препаратов. В связи с этим возникает вопрос об исследовании возможности взаимодействия ионов Cu2+ с лекарственными веществами, тем более что медь(II) известна как активный комплексообразователь.
Путём спектрофотомерии установили закономерности протекания реакций комплексообразования в системах, содержащих амоксициллин, ионы меди и ионы кобальта. Изучили устойчивость полученных растворов, путём анализа временных промежутков через которые происходит изменение окраски полученных комплексов. На основании данных об оптической плотности и путём построения графиков выявили пиковые области светопоглащения полученных соединений с дальнейшей математической обработкой результатов.
Изучение процессов взаимодействия амоксициллина с ионами Cu2+и Co2+ проводили спектрофотометрическим методом. Нами применялись ацетатно-аммонийный и глициновый буферные растворы, pH, которых, был равен 10, и аммиак с pH=12.
В результате исследований взаимодействия амоксициллина тригидрата с ионами кобальта и меди были выявлены следующие результаты. При использовании глицинового буферного раствора полученный комплекс оказался наиболее устойчив по сравнению с теми пробами, в которых содержались ацетатно-аммонийный буфер и аммиак. Это проявляется в том, что по-прошествии нескольких суток растворы в пробирках не выпадают в осадок. Это свидетельствует о том, что в этом случае реакция разложения не идёт. В случае с аммиаком и ацетатно-аммонийным буферным раствором окраска комплекса по-прошествии 16—18 часов начинает всячески изменяться, что свидетельствует о меньшей устойчивости комплекса.
На графике 1.1 представлены спектры поглощения растворов в системе Cu2+-R1(амоксициллина тригидрат).Ccu2+=CR1=5*10-3, pH10 (глициновый)

График 1.1. Спектры поглощения растворов в системе Cu 2+-R1
Далее проводили метод молярных отношений, всё в той же системе. Метод молярных отношений является наиболее общим приёмом исследования прочных комплексов. Сущность метода заключается в установлении зависимости A от концентрации второго компонента и наоборот [3].
На графике 1.2 представлены измерения метода молярного отношения в системе Cu2+-R1(амоксициллина тригидрат) при λ=500 нм. Ccu2+=CR1=5*10-3, pH10 (глициновый)

График 1.2. Измерения метода молярного отношения в системе Cu 2+-R1
На графике 1.3 представлен градуировочный график в системе Cu2+-R1(амоксициллина тригидрат) при λ=500 нм. Ccu2+=CR1=5*10-3, pH10 (глициновый)
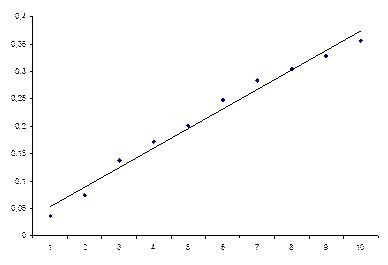
График 1.3. Градуировочный график в системе Cu 2+-R1
Исследуемое соединение может выступать в качестве лиганда, который входит в координационную сферу комплексообразователя. В роли комплексообразователей использовались ионы меди двухвалентные. Взаимодействие компонентов происходит при определённых условиях.
На основании полученных данных можно разработать комплексный метод количественного определения амоксициллина в растворах лекарственных препаратов и продуктов жизнедеятельности.
Список литературы:
1.Алексеев В.Г, Лямцева О.И., Самуйлова И.С. Комплексообразование амоксициллина с катионами марганца (II), кобальта (II), никеля (II). Журн.неорганич. химии — Т. 52 — № 3 — С. 433—435 (2007).
2.Алексеев В.Г., Демская Е.В., Милашс Е.А, Иголкин В.В Кислотно-основные свойства амоксициллина Журнал общей химии — Т. 75 — № 7 — С. 1211—1214 (2005).
3.Васильев В.П., Кочергина Л.А, Журн.физ.химии — Т. 79. — № 2 — с. 445 (2005)
4.Глинина А.Г., Глинина Е.Г. Процессы комплексообразования в контроле качества лекарственных средств — С. 87—90 (2012).
5.Кулапина Е.Г., Барагузина В.В., Кулапина О.И. Журн. Аналит. Химии. — Т. 59 — № 9 — с. 1208—1213 (2004).
6.Ланчини Д, Паренти Ф, Антибиотики. — С. 272. (1985).
отправлен участнику


Оставить комментарий