Статья опубликована в рамках: XXV Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 25 ноября 2014 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
МОРФОФИЗИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ СУСПЕНЗИОННОЙ КУЛЬТУРЫ ПАЖИТНИКА ГРЕЧЕСКОГО
Драгун Полина Алексеевна
студент 5 курса, кафедра клеточной биологии и биоинженерии растений БГУ, Республика Беларусь, г. Минск
E-mail:
Логвина Анна Олеговна
научный руководитель, ассистент кафедры клеточной биологии и биоинженерии растений БГУ, Республика Беларусь, г. Минск
Пажитник греческий (Trigonella foenum-graecum L.) — однолетнее растение, перспективность применения которого в профилактике и лечении многих заболеваний, в том числе диабета 2 типа и различных форм рака, является установленной [4, c. 500; 9, c. 50—55]. Многочисленные исследования свидетельствуют о высоком содержании фенольных соединений в экстрактах листьев и семян пажитника [10, с. 695—705; 6, с. 143—147], что создает предпосылки для применения этого растения в фармацевтической промышленности для получения данных метаболитов. Актуальной задачей является разработка и внедрение альтернативных способов получения ценного сырья пажитника, среди которых применение биотехнологического метода культуры клеток и тканей растений видится многообещающим. Перспективность широкого использования данной технологии в будущем определяется преимуществами, которые может дать производителям выращивание клеточных культур по сравнению с классическими способами получения фитомассы. Наиболее значимыми из таких преимуществ являются полная независимость культивирования от климатических условий и возможность контролировать все этапы производственного процесса, что позволит решить проблему дефицита исходного сырья для фармацевтической промышленности и увеличить масштабы производства лекарственных препаратов [5, с. 300—350]. В промышленной биотехнологии преимущественно используются суспензионные культуры, важным этапом исследования которых является определение характеристик, отражающих их физиологическое состояние.
В связи с этим целью данной работы было определение морфофизиологических характеристик суспензионной культуры пажитника греческого — динамики накопления биомассы, степени агрегированности и жизнеспособности на разных этапах роста.
Объектом изучения служила суспензионная культура пажитника греческого, инициированная из гетеротрофного каллуса листового происхождения пажитника ярового сорта Ovari 4 [7, с. 29—37]. Для инициации суспензионной культуры помещали 6—7 г свежей рыхлой массы каллусных клеток в колбу на 500 мл с 200 мл стерильной жидкой питательной среды [1, с. 22], соответствующей по составу среде, используемой для выращивания данной каллусной ткани. Среду, минеральная основа которой соответствовала среде Мурасиге и Скуга, дополняли регуляторами роста: 1,0 мг/л 2,4-дихлорфеноксиуксусной кислоты, 2,0 мг/л кинетина и 2,0 мг/л индолил-3-уксусной кислоты [7, с. 29—37]. Суспензию культивировали в темноте при комнатной температуре на круговой качалке со скоростью 100—120 об/мин. [1, с. 22].
Для получения кривой роста суспензионной культуры пажитника греческого определяли индекс роста [2, c. 100]. С этой целью в колбы на 250 мл с 50 мл свежей питательной среды вносили по 5 мл суспензии клеток. Культивировали в течение заданного промежутка времени — 4-е, 7-е , 11-е, 14-е, 18-е, 21-е, 24-е, 28-е сут., после чего суспензию фильтровали через бумажный фильтр, сушили в течение 3 суток при 60 °C и взвешивали. Для определения начальной массы культуры отбирали 5 мл этой же суспензии, фильтровали через бумажный фильтр, сушили в течение 3 суток при 60 °C и взвешивали. Определение степени агрегированности и жизнеспособности суспензии на разных этапах роста проводили после ее окрашивания нейтральным красным [1, с. 22].
Измерения проводили на протяжении трех пассажей. Данные на графиках представлены в виде средних значений ± стандартная ошибка средней.
Модельная кривая роста суспензии клеток имеет S-образную форму и включает: лаг-фазу, экспоненциальную фазу, фазу замедления роста, стационарную фазу и фазу деградации. Форма реальных ростовых кривых отличается продолжительностью фаз. Скорость нарастания биомассы колеблется от 15 до 70 суток. Это зависит от генетики популяции, количества инокулюма и состава питательной среды [3, c. 45].
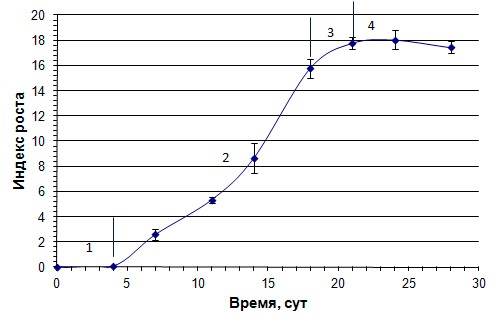
Рисунок 1. Кривая роста суспензионной культуры пажитника греческого. Фазы роста: 1 — латентная, 2 — логарифмическая, 3 — замедления, 4 — стационарная
Из графика, представленного на рисунке 1, видно, что латентная фаза ростового цикла культуры продолжается до 4 суток выращивания. С 5 суток наблюдается резкое увеличение ростовой активности культуры, что свидетельствует о ее переходе в логарифмическую фазу роста, продолжающуюся вплоть до 18 суток, после чего рост суспендированных клеток замедляется. Следом за фазой замедления роста (18—21сутки) начинается стационарная фаза роста, где дальнейшие изменения массы клеток незначительны и рост культуры стабилен. Начиная с 24 суток, отмечается тенденция к деградации культуры.
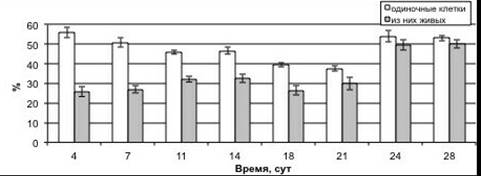
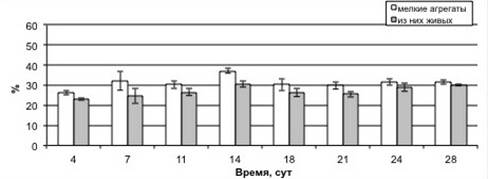
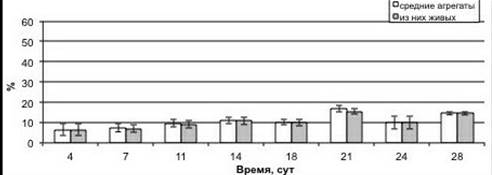
Изучение изменения степени агрегированности, жизнеспособности и морфологии суспендированных клеток в процессе культивирования показало, что на протяжении роста суспензионной культуры в основном преобладали одиночные клетки и мелкие агрегаты (рисунок 2). Процентное содержание одиночных клеток от общего числа фракций составило 56 % в начале ростового цикла (4 сут.). К 21 сут. культивирования одиночных клеток количество уменьшилось до 37 %, но уже на 24—28 сут. количество одиночных клеток было равным с исходным уровнем, наблюдаемым в ходе лаг-фазы. Процентное содержание мелких агрегатов от суммы всех типов фракций в ходе ростового цикла варьировало в относительно меньших пределах: возрастало от 26 % на 4 сутки до 37 % на 14 сутки культивирования. После чего снизилось до 31 %. Что касается более крупных агрегатов, то содержание средних скоплений клеток возрастало от 6 % на 4 сут. до 18 % на 21 сут., после чего вплоть до 28 сут. выращивания изменялось несущественно. Тогда как процент крупных агрегатов от общего числа фракций повышался от 1,5 % в ходе лаг-фазы роста (4 сут.) до 7 % к 18 сут., но далее снижался до 0,4 % (28 сут.).
Анализ жизнеспособности культуры показал, что количество живых одиночных клеток в ходе лаг-фазы (4 сут.) ростового цикла составляло менее половины от их общего числа. Однако в процессе роста культуры процентное содержание живых одиночных клеток возрастало, что связано с их активным размножением клеток в ходе экспоненциальной фазы. В итоге во время стационарной фазы роста (24—28 сут.) практически все одиночные клетки, присутствующие на тот момент в культуре, были живыми. Жизнеспособность всех типов агрегатов на протяжении всего роста культуры была очень высокой и изменялась незначительно.
 А
А
 Б
Б
 В
В
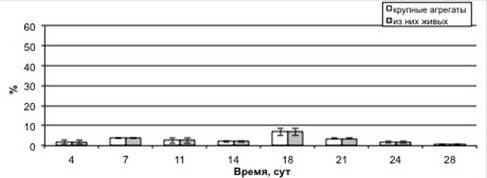 Г
Г
Рисунок 2. Процентное содержание различных фракций клеток в ходе ростового цикла суспензионной культуры пажитника греческого. А — одиночные клетки, Б — мелкие агрегаты, В — средние агрегаты, Г — крупные агрегаты
Таким образом, можно заключить, что ростовая кривая суспензионной культуры пажитника греческого имеет стандартную S-образную форму. Оптимальный срок выращивания данной культуры составляет от 21 до 24 суток. В ходе ростового цикла суспензионной культуры пажитника греческого преобладающими фракциями являются одиночные клетки и мелкие агрегаты. Жизнеспособность суспензии высокая и возрастает к стационарной фазе ростового цикла.
Список литературы:
1.Дитченко Т.И. Культура клеток, тканей и органов растений: методические рекомендации к лабораторным занятиям / Мн. БГУ. 2007. — 22 c.
2.Загребельный С.Н. Биотехнология. Часть 1. Культивирование продуцентов и очистка продуктов. Новосибирск.: Новосиб. гос. ун-т, 2000. — 108 с.
3.Сорокина И.К., Старичкова Н.И., Решетникова Т.Б., Гринь Н.А. Основы биотехнологии растений. Культура клеток и тканей: Учебное пособие. Новосибирск: НГУ, 2002. — 45 с.
4.Barnes J., Anderson L.A., Philipson J.D. Herbal medicines (3rd ed). London: Pharmaceutical Press, 2007, — 710 p.
5.Chawla H.S. Introduction to plant biotechnology (2nd ed.). Enfield: Science Publishers, 2002, — 538 p.
6.Kaviarasan S., Vijayalakshmi K., Anuradha C.V. Polyphenol-rich extract of Fenugreek seeds protect erythrocytes from oxidative damage. Plant Foods for Human Nutrition, — 2004, — vol. 59, — p. 143—147.
7.Lohvina H.O., Makai S., Ditchenko T.I., Reshetnikov v.N., Spiridovich E.v., Yurin v.M. Induction of callus from leaves and stems of Trigonella foenum-graecum varieties // Acta Agronomica Óváriensis. — 2012. — v. 54 (2). — P. 29—37.
8.Morton J.F. Mucilaginous plants and their uses in medicine. J. Ethnopharm, — 1990, — vol. 29, — p. 215—266.
9.Phadnis M., Malhosia A., Singh S.M., Malhosia A. Therapeutic effect of Fenugreek seed on the patients suffering from diabetes mellitus type II. Journal of Biology, Agriculture and Healthcare, — 2011, — vol. 1, — № 2, — p. 50—55.
10.Premanath R., Sudisha J., Lakshmi Devi N., Aradhya S.M. Antibacterial and anti-oxidant activities of Fenugreek (Trigonella foenum-graecum L.) leaves. Res. J. Med. Plant, — 2011, — vol. 5, — № 6, — p. 695—705.
дипломов


Оставить комментарий