Статья опубликована в рамках: XXIX Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 10 марта 2015 г.)
Наука: Биология
Секция: Экология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНЫХ УСЛОВИЙ ДЛЯ ВОЗМОЖНОГО ПРИМЕНЕНИЯ ЭКСТРАКЦИОННОГО ИЗВЛЕЧЕНИЯ ИОНОВ ДВУХВАЛЕНТНОГО ЖЕЛЕЗА ИЗ ПРИРОДНЫХ ВОД
Макарова Екатерина Евгеньевна
студент 4 курса, экологии технологических процессов, ФГБОУ ВПО МГТУ «СТАНКИН» ЕТИ (филиал), РФ, г. Егорьевск
E -mail: e.makapova@mail.ru
Фастова Анна Борисовна
студент 4 курса, экологии технологических процессов, ФГБОУ ВПО МГТУ «СТАНКИН» ЕТИ (филиал), РФ, г. Егорьевск
E -mail: 18_af_21.01.2010@mail.ru
Мелехина Лариса Александровна
научный руководитель, канд. хим. наук, доцент, естественно научных дисциплин, ФГБОУ ВПО МГТУ «СТАНКИН» ЕТИ (филиал), РФ, г. Егорьевск
E -mail: melt.72@mail.ru
Подшивалова Марина Владимировна
научный руководитель, канд. хим. наук, доцент, естественно научных дисциплин, ФГБОУ ВПО МГТУ «СТАНКИН» ЕТИ (филиал), РФ, г. Егорьевск
E -mail: pmv.66@mail.ru
В природных водах железо часто встречается в виде двух- и трехвалентных ионов, а так же в виде органических и неорганических соединений, находящихся в коллоидном состоянии, или в виде тонкодисперсных взвесей [4]. Изначально вода с растворенными ионами двухвалентного железа, пребывающая в подземных источниках чиста и прозрачна, но извлекаясь на поверхность, она контактирует с кислородом воздуха и железо переходит в окисленную форму, что приводит к окрашиванию воды в желтовато-бурый цвет с характерным металлическим привкусом. Такая вода фактически не пригодна для питьевого и хозяйственно-бытового использования. Так же следует отметить, что в воде может образовываться бактериальное железо, которое часто сопутствует минеральным отложениям трехвалентного железа, и состоит из живых и мертвых бактерий, их оболочек и продуктов жизнедеятельности [5]. Железобактерии могут стать причиной язвенной коррозии трубопроводов из железа и стали, и сильно ускорить образование железных отложений. Таким образом, можно сделать вывод о том, что вода, содержащая в себе растворенное двухвалентное железо, претерпевает ряд изменений в своем составе на пути к потребителю и теряет изначальные качества. Поэтому, чтобы предотвратить ухудшение качества потребляемой природной воды, необходимо обеспечить её очистку от избыточного содержания ионов железа (II).
С целью обезжелезивания воды в настоящее время используется достаточное количество методов включающих в себя такие методы очистки как ионный обмен, обратный осмос, методы окисления и экстракции. Для проведения исследований был выбран экстракционный метод в связи с простотой его реализации, экологической безопасностью, доступностью материалов и оборудования. В данной работе был проведен подбор условий для проведения экстракционного извлечения ионов двухвалентного железа с использованием легкоплавких органических соединений.
Под экстракцией понимается перевод вещества из одной фазы (твердой или жидкой), в которой оно растворено, в другую жидкую фазу. Процесс проводится с помощью избирательных растворителей — экстрагентов [3]. Из числа известных экстрагентов был выбран расплав высшей алифатической монокарбоновой кислоты (стеариновая кислота). Применение данного экстрагента интересно тем, что в данном случае применяется экстракционная система «водный раствор — расплав органического вещества». Этот тип экстракции достаточно хорошо описан и примечателен тем, что органическая фаза существует в жидком состоянии только при повышенных температурах и при охлаждении до комнатной температуры застывает с образованием твердого экстракта содержащего извлекаемые ионы, что позволяет её легко отделить от жидкой фазы и хранить долгое время при необходимости [6]. Кроме того он, как уже было отмечено ранее, достаточно прост в аппаратурном оформлении.
На степень экстракции влияет ряд факторов: соотношение органической и водной фаз, разбавление, время контактирования, значение водородного показателя рН. Исходя из вышесказанного, суть данной работы сводилась к подбору оптимальных параметров по перечисленным показателям.
В качестве объекта исследования использовались модельные растворы содержащие ионы двухвалентного железа. Для приготовления модельных растворов была выбрана соль Мора (FeSO4·(NH4)2SO4·6H2O), искусственный аналог минерала морит. Выбор этой соли был обусловлен устойчивостью кристаллов при контакте с воздухом, и их хорошей растворимостью в водной среде [7].
Определение содержания ионов железа в модельных растворах до и после экстракции проводилось фотоколориметрическим методом с α,α-диметилглиоксимом [8].
Температура в условиях всех опытов поддерживалась порядка 800С, поскольку исходя из анализа ряда работ по экстракции расплавами высших алифатических кислот изменение температуры от 70 до 90 0С практически не влияет на степень экстракции [1; 2].
Исследование влияния соотношения водной и органической фаз на степень экстракции проводилось при температуре 80 ᵒC, времени контактирования — 2 минуты, рН = 1,78, концентрации ионов железа 0,28 мг/мл, объем водной фазы не изменялся и был равным 20 мл. Рассматривались следующие соотношения фаз О:В: 1:2, 1:3, 1:4, 1:5. В ходе работы было определено, что наиболее высокие показатели экстракции ионов железа (II) достигаются при отношении фаз О:В =1:3.
С целью определения концентрационного интервала предела извлечения были приготовлены модельные растворы с различным содержанием извлекаемого иона. Растворы готовились разбавлением стандартного раствора с концентрацией 0,28 мг/мл, в 10, 20, 30 и 50 раз. При этом экстракция проводилась в тех же условиях, что и при определении соотношения фаз, с выбором оптимального соотношения О:В=1:3. Результаты представлены в табл. 1.
Таблица 1.
|
Разбавление, раз |
C (Fe2+), мг/мл |
D |
R , % |
|
10 |
0,0255 |
0,042 |
95,99 |
|
20 |
0,013 |
0,035 |
93,38 |
|
30 |
0,00947 |
0,034 |
90,23 |
|
50 |
0,0055 |
0,036 |
82,63 |
Как видно из таблицы самые высокие показатели степени извлечения достигаются в первых трех случаях. Дальнейшие исследования проводились на модельных растворах с концентрацией 0,00947 мг/мл поскольку в этом случае концентрация ионов двухвалентного железа более близкая по содержанию в природных источниках.
Следующий фактор, влияющий на результаты экстракции это время контактирования фаз. В ходе работы был рассмотрен временной промежуток в пределах от 1 минуты до 4 минут 20 секунд. Исследование проводилось при температуре 80 ᵒC, времени контактирования — 2 минуты, рН = 1,78, концентрации ионов железа 0,28 мг/мл, соотношения фаз О:В=1:3. На рисунке 1 представлены полученные результаты.
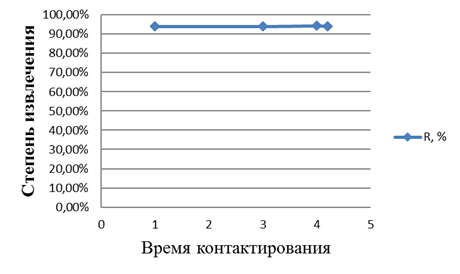
Рисунок 1. Зависимость степени извлечения от времени контакта фаз
По результатам видно, что степень извлечения практически не меняется в зависимости от времени. Поэтому все последующие исследования проводились при времени контактирования фаз равном 1 минуте.
Одним из основных факторов, которые оказывают значительное влияние на селективность процесса извлечения ионов железа (II) является кислотность водного раствора. Интервал значений pH также определяет природа металла. Изучение влияния pH водного раствора на степень экстракции ионов двухвалентного железа проводилось при с(Fe2+)=0,00947 мг/мл в широком интервале pH от 0,98 до 11,4.
В ходе работы установлено, что при значениях pH = 3,14; 3,5; 6,4 и 11,4 выпадают осадки гидроксидов трехвалентного железа. Это объясняется частичным окислением ионов двухвалентного железа кислородом воздуха и его переходом в трехвалентное [9]. Данный процесс, как уже было описано ранее, протекает в природе при подъеме подземных вод на поверхность, поэтому, при выбранных в ходе работы условиях, в ходе процесса будет иметь место одновременная экстракция ионов как двух, так и трехвалентного железа. При значениях pH = 0,98; 2,1 и 2,6 наблюдается увеличение степени экстракции с 23 до 98 % (рис. 2) и практически остается постоянным с увеличением pH до 11,4.
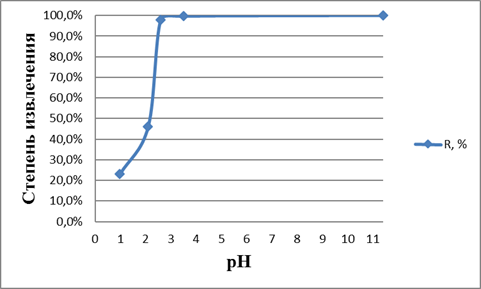
Рисунок 2. Зависимость степени извлечения от рН
Все сказанное позволяет сделать вывод, что для эффективного проведения экстракционного извлечения двухвалентного железа из природных вод, необходимо соблюдать следующие условия:
· температурный режим в пределах 80 0С;
· соотношение объемов водной и органической фаз 1:3;
· время контакта фаз брать в интервале от 1 до 4 минут;
· поддерживать уровень значений рН выше 2,6.
Список литературы:
1.Анализ промышленных растворов и сточных вод с применением легкоплавких экстрагентов / Н.Н. Андреева, Т.А. Николаева, Ф.И. Лобанов // Журнал аналитической химии. — 1981. — т. 47, — вып. 4, — С. 629—635.
2.Лобанов Ф.И., Андреева Н.Н., Мануйлова О.А. и др. Экстракция металлов смесями органических экстрагентов. // Сборник работ по химии. Алма-Ата. КазГУ. — 1990. — Вып. 12. — С. 7—12.
3.Общий практикум по органической химии: Учебное пособие / В.П. Черных, И.С. Гриценко, М.О. Лозинский, З.И. Коваленко: Под. ред. В.П. Черных. Харьков : НФАУ «Золотые страницы». 2002. — 575 с.
4.Статья «Показатели качества воды» // СПАВ-ТЕСТ Санкт-Петербург фильтры тонкой очистки воды в системах теплоснабжения [Офиц. сайт]. [Электронный ресурс] — Режим доступа. — URL: http://www.spawtest.ru/art_07.htm (дата обращения: 20.01.2015).
5.Статья «Очистка воды от железа. Обзор методов» [Электронный ресурс] // Системы очистки воды [Офиц. сайт]. [Электронный ресурс] — Режим доступа. — URL: http://www.osmos.ru/house/article/deironing.html
6.Салыкбаева А.С., Исаева С.Х. Экстракция ионов никеля (II) расплавом стеариновой кислоты // Наука и образование 2011. 2011. — С. 372—376.
7.Соль Мора [Электронный ресурс] // Классификация и систематика минералов, горных пород, окаменелостей, метеоритов [Офиц. сайт]. [Электронный ресурс] — Режим доступа. — URL: http://kristallov.net/salmohr.html (дата обращения: 23.01.2015).
8.Сборник «Вода питьевая. Методы анализа». М: Издательство стандартов, 1984. — С. 66—68.
9.Тинсли И. Поведение химических загрязнителей в окружающей среде. Пер. с англ. М.: Мир, 1982. — С. 110.
дипломов


Оставить комментарий