Статья опубликована в рамках: XIII Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 07 ноября 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
ИССЛЕДОВАНИЕ ФИЗИКО-ХИМИЧЕСКИХ И КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ НОВЫХ ИОНИТОВ SYNTHER EV 023, CRX 300, CRX 210, CRX 100, ALX 220, ALX 400
Землянская Алёна Игоревна
студент 5 курса, кафедра органической и аналитической химии СФУ, г. Красноярск
E-mail: aloyna91g@mail.ru
Кононова Ольга Николаевна
научный руководитель, канд. хим. наук, доцент СФУ, г. Красноярск
С развитием теории и практики ионного обмена все большее внимание уделяется комплексообразующим смолам, способным к избирательному поглощению одного или нескольких видов ионов [1].
В настоящее время накопилась достаточно много информации о синтезе комплексообразующих ионитов, влиянии состава раствора, химической и физической природы ионитов на процесс сорбции, о свойствах образующихся соединений. Теоретическим и практическим исследованиям по этой теме посвящено большое число работ, однако изложенные в них результаты требуют обобщения и дальнейшего развития [2]. Поэтому в данной работе нами были изучены физико-химические и кислотно-основные свойства ионитов. Для исследования были взяты аниониты Synthes EV 013 и SXR 002, синтезированные НПО «Синтез» г. Санкт-Петербург.
Ионит перед работой следует подвергать предварительной обработке, то есть кондиционированию, с целью удаления органических и минеральных примесей.
Воздушно-сухой сорбент подвергают набуханию в насыщенном растворе хлорида натрия в течение суток. Затем раствор сливают, сорбент промывают дистиллированной водой до тех пор, пока вода на выходе не будет давать отрицательную реакцию на хлорид-ионы. Реактивом на хлорид-ионы является раствор нитрата серебра.
Далее сорбент заливают 2М раствором соляной кислоты, после чего промывают дистиллированной водой до слабокислой реакции (рН 3-4).
Следующая стадия кондиционирования — обработка ионита 2М раствором гидроксида натрия, после чего их промывают дистиллированной водой до слабощелочной реакции (рН 8-9). Затем промывают ионит спиртом (1:1).
После кондиционирования сорбент переводят сначала в OH‾ -форму, потом в Cl‾ -форму.
Переведение в ОН-. Предварительно оттитрованным раствором 2 М NaОH 0,2N HCl (приготовленной из фиксанала) насыщаем анионит. Промываем его раствором до тех пор, пока концентрация вливаемого и выходящего гидроксида натрия не станут равны. Пробу в присутствии 2 капель 5 N фенолфталеина оттитровываем 0,2 N HCl. После этого промываем ионит спиртом и высушиваем на фильтровальной бумаге.
Переведение в Cl-. Промываем анионит водой, далее выполняем насыщение согласно предыдущей методике. Пробы кислоты оттитровываем в присутствии фенолфталеина 0,2 N NaOH. После насыщения анионит промывается спиртом и сушится на фильтровальной бумаге [3, 4].
В колбы на 50—100 мл вносят по 0,5 г воздушно-сухого ионита в OH- или Cl- формах. Навески заливают соответствующими растворами 0,25М NaOH (для ионитов в Cl- форме) и 0,25М NaCl (для ионитов в OH- форме). Количества растворов приведены в таблице 1.
Таблица 1.
Количества растворов для потенциометрического титрования ионитов в ОН- - форме и анионита в Cl- - форме
Колбы перемешивают, закрывают крышками и оставляют стоять до установления равновесия (не менее 24 часов).
Затем готовят те же растворы, но без ионитов, и измеряют их pH.
Через 24 часа, измеряют pH растворов с ионитами. По полученным данным строят кривые титрования [5].
Измерили рН растворов без ионитов и с ионитами. Результаты потенциометрического титрования представлены на рисунках 1—6:
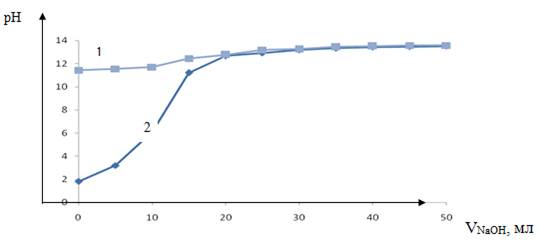
Рисунок 1. Кривая потенциометрического титрования катионита CRX 300, кривая 1 — без ионитов, кривая 2 — с ионитами
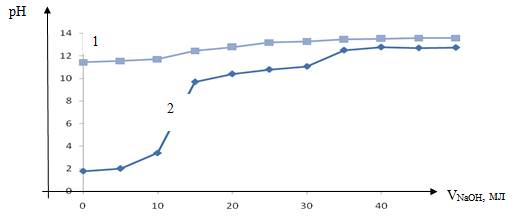
Рисунок 2. Кривая потенциометрического титрования ионита CRX 210, кривая 1 — без ионитов, кривая 2 — с ионитами
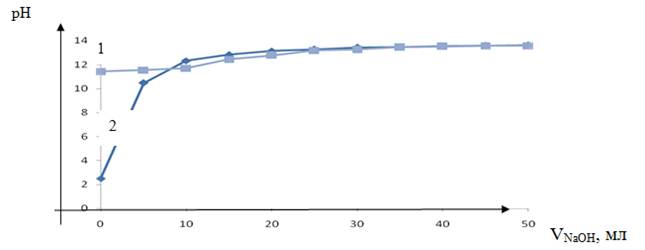
Рисунок 3. Кривая потенциометрического титрования ионита CRX 100, кривая 1 — без ионитов, кривая 2 — с ионитами
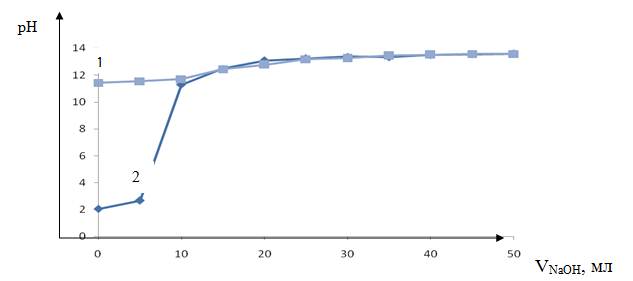
Рисунок 4. Кривая потенциометрического титрования анионита EV 023, кривая 1 — без ионитов, кривая 2 — с ионитами
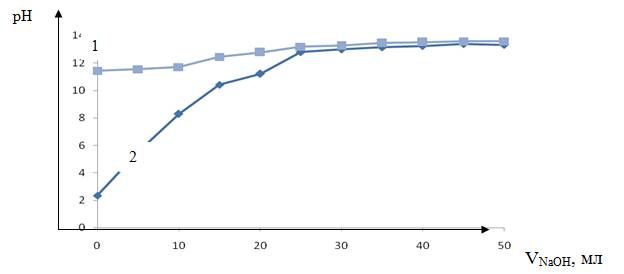
Рисунок 5. Кривая потенциометрического титрования анионита ALX 220, кривая 1 — без ионитов, кривая 2 — с ионитами
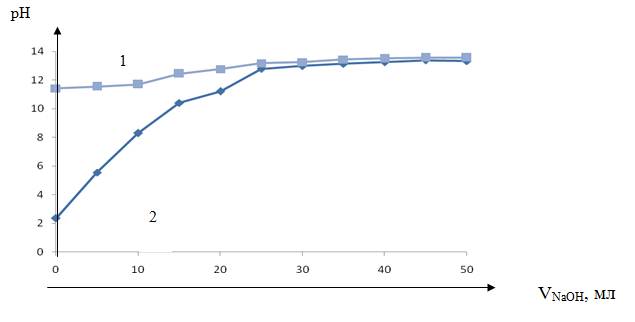
![]() Рисунок 6. Кривая потенциометрического титрования анионита AX400, кривая 1 — без ионитов, кривая 2 — с ионитами
Рисунок 6. Кривая потенциометрического титрования анионита AX400, кривая 1 — без ионитов, кривая 2 — с ионитами
Далее были рассчитаны по уравнению Гендерсона-Гассельбаха![]() , кажущиеся константы кислотно-основного равновесия, представленные в таблицы 2.
, кажущиеся константы кислотно-основного равновесия, представленные в таблицы 2.
Таблица 2.
Значения кажущихся констант кислотно-основного равновесия, рассчитанные по данным потенциометрического титрования
Название сорбентов |
|||||
CRX 300 |
EV 023 |
CRX 210 |
CRX 100 |
ALX 220 |
AX 400 |
Слабо-кислотный катионит |
Сильно-кислотный катионит |
Хелато-образующий ионит |
Хелато-образующий ионит |
Низко-основный анионит
|
Высоко-основный анионит |
рК |
|||||
8,75 |
9,16 |
7,73 |
10,77 |
9,56 |
10,27 |
Значения полученных констант согласуются с кислотно-основными свойствами изучаемых образцов.
На основании проведенного исследования можно сделать вывод о том, что образцы сорбентов являются ионитами смешанного типа. В структуре этих ионитов присутствуют группы сильнокислотного, слабокислотного, хелатообразующего, сильноосновного характера, а также слабоосновные аминогруппы.
Список литературы:
1.Гельферих Ф. Иониты. Основы ионного обмена/Ф. Гельферих. М.: Изд. иностранной литературы, 1962. — 492 с.
2.Иониты и ионный обмен: Сборник статей/Под ред. Г.В. Самсонова. Л.: Наука, 1985. — 230 с.
3.Иониты в цветной металлургии/Отв. ред. К.Б. Лебедев. М.: Металлургия, 1975. — 352 с.
4.Кононова О.Н. Применение хелатных и амфотерных ионитов в анализе и технологии редких металлов./О.Н. Кононова. Красноярск: КГУ, 1981. — 40 с.
5.Полянский Н.Г. Методы исследования ионитов/Н.Г. Полянский, Г.В. Горбунов, Н.Л. Полянская. М.: Химия, 1976. — 208 с.
отправлен участнику


Оставить комментарий