Статья опубликована в рамках: XIII Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 07 ноября 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
ИССЛЕДОВАНИЕ ИНДИКАТОРНЫХ СВОЙСТВ ХАЛЬКОГЕНИДОВ ЖЕЛЕЗА
Сагида Мария Олеговна
студент 5 курса, кафедра химии ОГУ, г. Оренбург
Макаров Антон Геннадиевич
научный руководитель, канд. хим. наук, доцент ОГУ, г. Оренбург
Создание и совершенствование индикаторных электродов имеет большое значение для контроля процессов, сопровождающихся изменением рН. На сегодняшний день, описаны различные виды мембран, используемых для изготовления индикаторных электродов. В работах [2, 4] говорится о применении халькогенидных электродов в качестве индикаторных. Авторы работы [1] определяли константы устойчивости некоторых аминокислот используя халькогенидные электроды. При исследовании процессов комплексообразования в работе [5], электроды изготовленные из дисульфида железа, сульфида меди (I) и дисульфида триникеля использовались в качестве индикаторных. Использование электродов на основе дисульфида триникеля описано также в работе [6].
В данной работе для изготовления кристаллических мембран, были использованы халькогениды железа. Основное преимущество исследуемых индикаторных электродов перед стеклянным электродом, обычно используемым для измерения рН, состоит в их прочности и удобстве в эксплуатации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалом мембран электродов послужили элементарное железо класса Армко, природный пирит, синтетические диселенид железа, дителлурид железа и теллурид железа. Диселенид железа получали нагреванием (~500 °С) селена с селенидом железа (FeSe) в кварцевой ампуле. FeSe получали нагреванием стехиометрических количеств железа и селена. Теллурид и дителлурид железа получали аналогично FeSe2 из стехиометрических количеств соответствующих элементов.
Потенциал измеряли относительно ХСЭ с последующим пересчетом в НВЭ. Растворы готовили используя реактивы класса чистоты не менее х.ч. Кроме перечисленных электродов при титровании в неводной среде использовали платиновый электрод для оценки адекватности получаемых результатов.
Индикаторные свойства исследуемых электродов определяли на примере кислотно-основного титрования бензойной и винной кислот гидроксидом калия в среде метанола, и титрования соляной, серной и ортофосфорной кислот гидроксидом натрия в водной среде. Результаты титрования анализировали на основе дифференциальных кривых титрования.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При титровании соляной кислоты гидроксидом натрия использовали электроды на основе FeS2, FeSe2, FeTe2 и FeTe. Экстремумы на дифференциальной кривой титрования для всех электродов имеют разную интенсивность (Рисунок 1). Наиболее чувствительным к изменению рН оказался теллуриджелезный электрод. Интенсивность пика на диселениджелезном электроде составляет 4,6 % относительно максимума (Здесь и далее принимаем интенсивность максимального пика за 100 %). Экстремум пиритового электрода имеет интенсивность 61,3 %. Согласно показаниям FeTe2 и FeTe электродов, при увеличении доли теллура, несколько снижается восприимчивость к изменению концентрации ионов водорода.
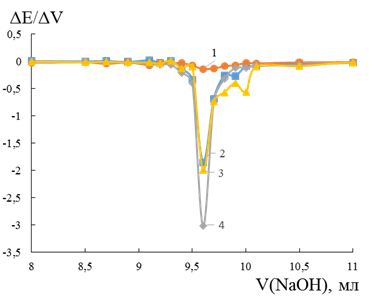
Рисунок 1. Дифференциальная кривая потенциометрического титрования соляной кислоты гидроксидом натрия на FeSe2 –1, FeS2 –2, FeTe2 –3 и FeTe –4 электродах.
Дифференциальная кривая титрования серной кислоты с FeS2, FeSe2 и FeTe2 электродами представлена на рисунке 2. Все исследуемые электроды не зафиксировали вторую константу ионизации, но тем не менее точно определили точку эквивалентности. Наиболее интенсивные пики были отображены дителлуридным и пиритовым электродами. Электрод на основе FeSe2, как и в случае титрования соляной кислоты, проявил меньшую чувствительность. Интенсивности экстремумов на дисульфидном и дителлуридном электродах различаются почти на 38 % относительно максимума.
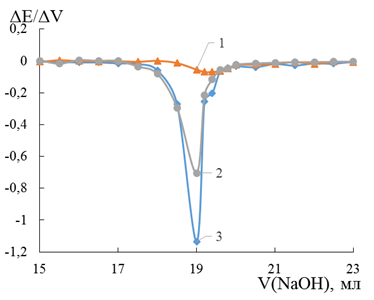
Рисунок 2. Дифференциальная кривая потенциометрического титрования серной кислоты гидроксидом натрия на FeSe2 –1, FeS2 –2, FeTe2 –3 электродах
При титровании ортофосфорной кислоты получили только два экстремума (Рисунок 3).
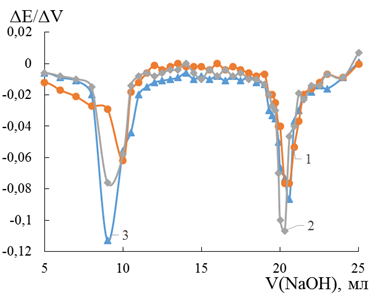
Рисунок 3. Дифференциальная кривая потенциометрического титрования ортофосфорной кислоты гидроксидом натрия на FeSe2 –1, FeS2 –2, FeTe2 –3 электродах
Установили, что электроды позволяют с достаточной точностью определять конечную точку титрования. Первый пик лучше других почувствовал FeTe2 электрод, а второй пик — пиритовый электрод. Интенсивности максимумов двух разных пиков на каждом электроде отличаются не более чем на 28 % относительно наибольшего.
Титрование органических кислот проводили в среде метанола с железным, платиновым, пиритовым и диселениджелезным электродами. Пиритовый электрод при титровании бензойной кислоты показал максимальный пик в точке эквивалентности (Рисунок 4). Минимальную селективность проявил электрод на основе диселенида железа (интенсивность 10,1 % относительно максимума). Высота пика железного электрода составила 63,3 % относительно пирита, а платинового электрода — 35,8 %. Возможно, меньшая чувствительность платины, по сравнению с водной средой, вызвана отсутствием ионов гидроксония, роль которых в среде метанола, согласно [3], выполняют ионы ![]() .
.
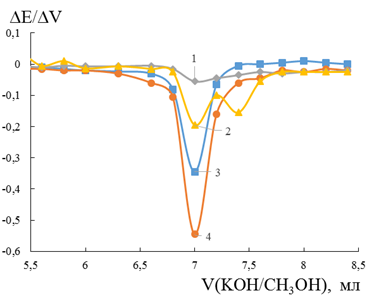
Рисунок 4. Дифференциальная кривая потенциометрического титрования бензойной кислоты гидроксидом калия на FeSe2–1, Pt –2, Fe –3 и FeS2 –4 электродах в среде метанола
При титровании винной кислоты все электроды, кроме FeSe2, показали по два пика, соответствующие двум ступеням диссоциации кислоты (Рисунок 5). Первые экстремумы на кривых железного и пиритового электродов смещены в область больших объемов относительно экстремума платинового электрода. Второй пик кривой титрования на железном электроде смещен в область меньшего объема относительно платинового электрода. Если принять за 100 % интенсивности пиков на платиновом электроде, то на железном и пиритовом они примут значения соответственно 253,8 % и 350,8 % для первого пика; 15,3 % и 5,9 % для второго пика.
Изменение селективности платинового электрода к иону ![]() при переходе от бензойной кислоты к винной, вызвана, возможно, различием в поведении моно- и дикарбоновых кислот в неводных средах. Это объясняется тем, что винная кислота в среде метанола ведет себя как смесь двух кислот, отличающихся по силе [3].
при переходе от бензойной кислоты к винной, вызвана, возможно, различием в поведении моно- и дикарбоновых кислот в неводных средах. Это объясняется тем, что винная кислота в среде метанола ведет себя как смесь двух кислот, отличающихся по силе [3].
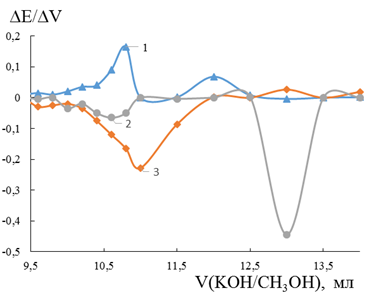
Рисунок 5. Дифференциальная кривая потенциометрического титрования винной кислоты гидроксидом калия на Fe –1, Pt–2 и FeS2 –3электродах в среде метанола
ВЫВОДЫ
В результате проведенной работы установлено, что все исследуемые электроды — FeS2, FeSe2, FeTe2, FeTe — в той или иной мере проявляют селективность к ионам водорода. По сравнению с платиной, халькогениды железа практически не уступают, а в некоторых случаях превосходят её при использовании в качестве индикаторных электродов. Показано, что халькогениджелезные электроды почти одинаково эффективны при использовании как в водной среде, так и в среде метилового спирта.
Теллуриды железа наиболее чувствительные, из исследуемых электродов, к изменению концентрации ионов водорода. Пиритовый электрод отличается четкими и стабильными показаниями. Электрод на основе FeSe2 хуже других исследуемых электродов проявил себя при титровании одноосновной и двухосновной минеральных кислот, однако при титровании трехосновной кислоты, наравне с FeTe2 и FeS2, показал два достаточно отчетливых экстремума.
Список литературы:
1.Амерханова Ш.К. Термодинамическое исследование аминокислотных комплексов меди (II) и железа (II) с использованием халькогенидных электродов // Физ. химия. — 2003. — Т. 77. — № 2. — С. 376—378.
2.Амерханова Ш.К. Физикохимия халькогенидов металлов и некоторые аспекты их практического применения как отдельное направление научной школы академика Е.А. Букетова. Краткий обзор // Вестник Карагандинского университета. — 2011. — № 4(64). — С. 34—39.
3.Крешков А.П., Быкова Л.Н., Казарян Н.А. Кислотно-основное титрование в неводных растворах. М.: Химия, 1967 — 192 с.
4.Макаров Г.В., Букетов Е.В., Едрисова М.А. Козорин Л.Г. О функционировании пирита как индикаторного электрода // Журнал аналитической химии — 1974. — Т. XXIX. — № 4. — С. 801—804.
5.Шляпов Р.М. Термодинамические параметры процессов комплексообразования в системе Ме–L–ВМС // Вестник Карагандинского университета. — 2005. — № 2(38). — С. 15—21.
6.Amerkhanova Sh.K. The solid potentiometric electrode for determination of chromium (III, VI) ions // Вестник Карагандинского университета. — 2013. — № 1(69). — С. 29—33.
отправлен участнику


Оставить комментарий