Статья опубликована в рамках: XII Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 10 октября 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
ПОЛУЧЕНИЕ АЛЛИЛОВЫХ ЭФИРОВ ОРТО-АМИНОГИДРОКСИАНТРАХИНОНОВ
Куликова Мария Николаевна
магистр 1 курса химического факультета КемГУ, г. Кемерово
Ткаченко Татьяна Борисовна
научный руководитель, канд. хим. наук, доцент кафедры ОХ, г. Кемерово
В последнее время в синтетической органической химии интенсивно развиваются научные направления, связанные с разработкой методов синтеза различных типов гетероциклических систем. Актуальность и значимость этих направлений обусловлены, в первую очередь, потенциальной способностью таких соединений проявлять широкий спектр биологической активности. На данный момент существует не так много методов, позволяющих одновременно усложнить углеродный скелет антрахинона и получить конденсированный с его ядром гетероцикл. Одной из реакций, которая может быть использована для синтеза указанных соединений, является реакция Меервейна, отличающаяся исключительными возможностями для органического синтеза и широко используемая для получения различных классов соединений, таких как стильбены, диены, карбоновые кислоты и пр. Внутримолекулярный вариант реакции Меервейна интересен тем, что в этом случае образование гетероциклических структур происходит в одну стадию. В ряду антрахинона указанная реакция изучена не достаточно хорошо, а сведения о ее внутримолекулярном варианте отсутствуют.
Для проведения внутримолекулярной реакции Меервейна в качестве исходного соединения требуется производное, у которого бы в орто- положении к аминогруппе находилась какая-либо достаточная для циклизации группа, содержащая непредельный остаток, например, О-аллильная.
В данной работе были осуществлены различные попытки синтеза 1-амино-2-антрахинонилаллилового эфира (2).
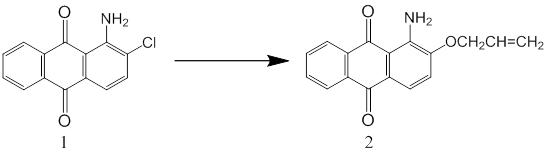
Наиболее привлекательным путем получения указанного соединения является замена орто-расположенного галогена в 1-аминоантрахиноне на О-аллильный остаток. Данная реакция является реакцией нуклеофильного ароматического замещения. Т. к. легкость замещения галогенов в таких реакциях уменьшается в ряду Сl, Br, J, в качестве исходного соединения был использован 1-амино-2-хлорантрахинон, который вводился во взаимодействие с такими нуклеофилами как аллиловый спирт и аллилат натрия в ДМСО при нагревании. Целевой продукт с выходом 20 % удалось получить только при использовании аллилата.
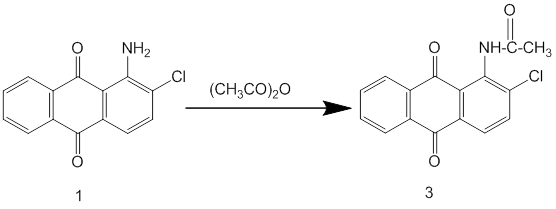
Возможно, низкая подвижность хлора может быть обусловлена донорным влиянием аминогруппы, которое можно понизить при помощи ацилирования или диазотирования. Однако, взаимодействие 1-амино-2-хлорантрахинона с уксусным ангидридом при разных условиях приводило к образованию ацильного производного (3) с очень малым выходом, не превышающим 15 %.
При диазотировании амина (1) нитритом натрия в концентрированной серной кислоте при комнатной температуре с хорошим выходом (80 %) была получена диазосоль (4), которая была введена в реакцию нуклеофильного замещения. Соединение (4) менее устойчиво, чем гидросульфаты или тетрафторбораты антрахинонилдиазония, легко разлагается и реагирует по разным направлениям, образуя трудноразделимую смесь продуктов реакции. Т. о. данный метод является трудоемким и не приводит к высокому выходу продукта.

Другим способом получения соединения (2) может быть нитрование 2-гидроксиантрахинона (5), с последующим восстановлением нитрогидроксипроизводного (6) до аминогидроксиантрахинона (7), который подвергается дальнейшим превращениям, описанным ниже.
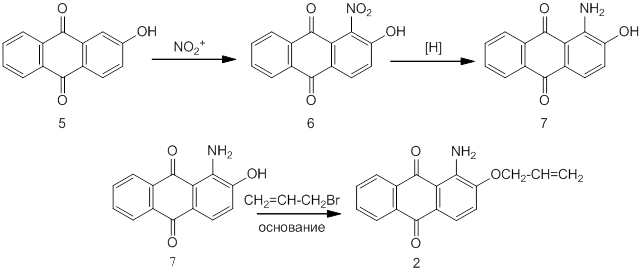
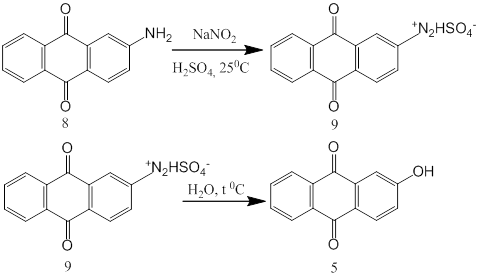
Необходимый для нитрования 2-гидроксиантрахинон был получен путем диазотирования 2-аминоантрахинона и дальнейшего разложения диазосоли в воде [2].
По литературным сведениям нитрование 2-гидроксиантрахинона протекает преимущественно в α-положение. Это связано с тем, что при образовании нитропроизводного в промежуточном сигма-комплексе происходит стабилизация за счет взаимодействия нитро-группы с карбонильной группой антрахинона.

Было исследовано нитрование исходного соединения в разных условиях. Найдено, что оптимальными условиями получения нитропроизводного (7) является нитрование 2-гидроксиантрахинона азотной кислотой в уксусной при температуре 55 0С в течение 3 часов. В результате реакции образуется смесь продуктов (7) и (10).
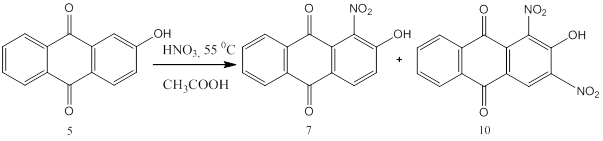
Т. к. оба вещества обладают близкой подвижностью, разделить их хроматографически сложно. В промышленности для получения чистых нитроантрахинонов используется обработка органическими растворителями, химическими реагентами и вакуум-перегонка. Наилучший эффект дает последовательное использование нескольких методов [1].
Поэтому полученная смесь была использована в следующем превращении без разделения.
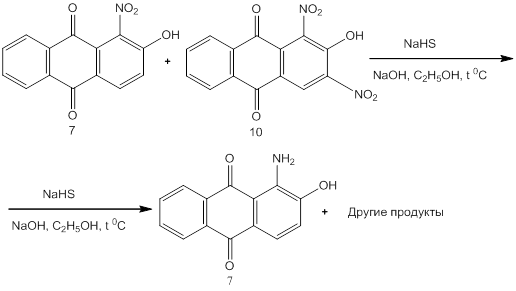
Для восстановления нитрогруппы использовали гидросульфид натрия в водно-спиртовом растворе с добавлением щелочи. Амин (7) из смеси был выделен хроматографически.
Для получения эфира (2) соединение (7) было введено во взаимодействие с аллилбромидом в ацетоне в присутствии поташа.

Выход эфира составил 40 %. Структуры полученных соединений (2), (6), (7) подтверждены данными ИК-спектроскопии и элементного анализа. Для всех соединений приведены температуры плавления.
Список литературы:
1.Горелик М.В. Химия антрахинонов и их производных. М.: Химия, 1983. — 296 с.
2.Сидорина Н.Е. Диазо- и азосоединения: практикум. Самара: Самар. гос. техн. ун-т, 2009. — 118 с.
отправлен участнику


Комментарии (1)
Оставить комментарий