Статья опубликована в рамках: XII Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 10 октября 2013 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ПОЛУЧЕНИЕ И ОЧИСТКА РЕКОМБИНАНТНОГО ЗЕЛЕНОГО ФЛУОРЕСЦЕНТНОГО БЕЛКА TAGGFP2 И ВОЗМОЖНОСТИ СОЗДАНИЯ ХИМЕРНЫХ БЕЛКОВ С TAGGFP2
Крат Сергей Михайлович
студент, медико-биологический факультет, СибГМУ, г. Томск
E- mail:
Сафонова Алена Владимировна
студент, медико-биологический факультет, СибГМУ, г. Томск
E- mail:
Першина Александра Геннадьевна
научный руководитель, канд. биол. наук, ЦНИЛ СибГМУ, г. Томск
Флуоресцентные белки (ФБ) находят широкое применение для исследования экспрессии белков, их локализации в клетке, в области генной терапии [3, с. 1129]. ФБ очень удобны в качестве модели для разработки гибридных конструкций типа наночастица-белок, т. к. могут быть получены в качестве белков слияния с функционально активными пептидами и белками стандартными методами молекулярной биологии (рестриктазно-лигазное клонирование) и обеспечивают легкость контроля успешности иммобилизации. Биотехнологически особо интересны мономерные флуоресцентные белки в виду относительной простоты их структуры, а так же легкости манипулирования генами, кодирующими такие белки. В молекулярной биотехнологии очень удобно использовать такие белки как репортерные, например, помещая их ген под контроль промотора, для изучения работы последнего и оптимизации его активности, измеряя уровень флуоресценции, прямо пропорциональный количеству продукта экспрессии, при варьировании условий культивирования продуцента. Большую привлекательность в использовании представляет разработанный на базе Института биоорганической химии (Москва) генетически кодируемый, яркий, мономерный, быстро созревающий флуоресцентный белок TagGFP2.
Целью работы было поставлено оптимизировать экспрессию белка TagGFP2 в бактериальной системе и получить рекомбинантный белок.
В качестве исходного материала использовали штамм E.coli XL-blue, рекомбинантную плазмиду pQE30, со встроенным геном TagGFP2 (Рис. 1, Евроген). Белок, экспрессируемый в данной системе, несет 6xHis последовательность на N-конце, что позволяет очищать целевой продукт высокоэффективно и одностадийно с помощью металл-аффинной хроматографии.
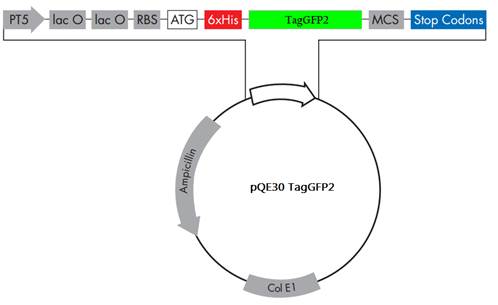
Рисунок 1. Плазмида pQE30 с геном TagGFP2
Проводили культивирование по стандартной методике с использованием жидкой и агаризованной LB среды. Трансформацию клеток E. coli проводили с использованием CaCl2 (Маниатис, 1984). Отбор трансформированных бактерий проводили на селективной среде, содержащей ампициллин (50 мкг/мл). Экспрессию белка индуцировали добавлением ИПТГ в концентрации (0,1—1 мМ) и при варьировании температуры от 25 до 37оС. Очистку белка проводили с использованием Ni-NTA агарозы (Qiagen). Денатурирующий электрофорез белков в ПААГ проводили по методике (Laemmli, 1970). Концентрацию препарата очищенного белка определяли флуориметрическим (VersaFluor, Bio-Rad) и спектрофотометрическим методами (Nanodrop, Thermoscientific).
В результате уровень трансформации E.coliсоставил 10^7 (на 1 мкг плазмидной ДHК). Наибольший выход белка наблюдали при индукции ИПТГ в конечной концентрации 0,5 мМ и температуре культивирования 28оС. В результате очистки белка методом металл-аффинной хроматографии с использованием Ni-NTA агарозы был получен препарат TagGFP2 с концентрацией 1 мг/мл.
Выводы: Таким образом, получен трансформированный штамм E. coli, продуцирующий TagGFP2 белок и оптимизированы условия экспрессии и очистки флуоресцентного белка.
Полученную рекомбинантную плазмидуможно использовать для получения генетических конструкций, кодирующих разные химерные белки. В составе химерных белков GFP-подобные белки обладают наибольшим научным потенциалом, так как не влияют на функциональную активность ни GFP, ни исследуемого белка.
Уникальность вариантов GFPкак молекулярно-биологических инструментов обусловлена рядом причин. Во-первых, они не токсичны для живых систем, во-вторых они обладают стабильной флуоресценцией, которая не требует наличия дополнительных факторов. В третьих они не агрегируют, и сохраняют свои уникальные свойства в составе фьюз-конструкций.
GFP-химерные белки успешно использованы для изучения мембранных белков [4, с. 303], для изучения цитоскелета эукариотических клеток с помощью фьюзов TagCFP-β-актин, TagYFP-α-тубулин (см. рис. 2) [2, с. 17] и во многих других исследованиях [3, с. 1106].

Рисунок 2. Флуоресцентное мечение белков цитоскелета
Важно отметить применение флуоресцентных белков в составе биосенсоров. Получены биосенсоры для индикации наличия в среде ионов кальция, кислорода и многих других веществ [1, с. 435]. Ведутся исследования в этой области и разрабатываются новые биосенсоры.
Для исследования любого белка или фермента всегда важно знать его локации в клетке, это дает большее понимание его функциональной активности. Белок, скрепленный с другим белком, флуоресцентным, сохраняет свою функциональную активность благодаря естественным или искусственным линкерам, которые предупреждают стерический конфликт между ФБ и исследуемым белком. Часто используется химерная конструкция вида «6xHis-ФБ-исследуемый белок», в таком случае становится возможной легкая очистка такого сложного белка с помощью металл-аффинной хроматографии (IMAC), например, на Ni-NTA-агарозе.
В молекулярной биологии и биотехнологии флуоресцентные технологии только начали становиться актуальными, но без сомнения, уже очень многое сделано с их помощью.
Использование флуоресцентных белков должно развиваться в различных направлениях, не только в области микробиологии и молекулярной биологии, но и генетике и генной терапии, синтетической биологии, молекулярной медицине и многих других направлениях.
Несомненно, химерные конструкции c GFPбудут использоваться в областях фундаментальных исследований, контроля биотехнологических процессов и диагностики.
Список литературы:
1.Зубова Н.Н. и др. Молекулярные клеточные сенсоры, созданные на основе цветных флуоресцентных белков, Успехи биологической химии, — т. 45, — 2005, — с. 391—454.
2.Чудаков Д.М. Генетически кодируемые флуоресцентные инструменты для исследования живых систем, автореферат, М. 2011.
3.Chudakov D. M., et al Fluorescent Proteins and Their Applications in Imaging Living., Cells and Tissues, Physiol Rev 90: p. 1103—1163, — 2010
4.Drew D, Lerch M, et al. Optimization of membrane protein overexpression and purification using GFP fusions Nat Methods. — 2006 Apr; — № 3(4):— p. 303-13.
дипломов


Оставить комментарий