Статья опубликована в рамках: V Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 25 октября 2012 г.)
Наука: Биология
Секция: Экология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ОЦЕНКА СОСТОЯНИЯ АПОПТОЗА КЛЕТОК ПЕЧЕНИ И МИКРОЭЛЕМЕНТНОГО СОСТАВА, КАК КРИТЕРИЕВ БЕЗОПАСНОСТИ ВВЕДЕНИЯ НАНОЧАСТИЦ В ОРГАНИЗМ ЖИВОТНЫХ
Танцикужина Анна Абриковна
студент 5 курса, Химико-биологический факультет ОГУ, г. Оренбург
Е-mail: black
Сизова Елена Анатольевна
научный руководитель, канд. биол. наук, доцент ОГУ, г. Оренбург
Введение
Использование нанотехнологий и наноматериалов бесспорно является одним из самых перспективных направлений науки и техники в XXI веке. Учитывая, что в перспективе ожидается тесный контакт человека и других биологических объектов с наноматериалами, изучение вопросов потенциальных рисков их использования представляется первостепенной. Нанотехнологии, это технологии направленного получения и использования веществ и материалов в диапазоне размеров до 100 нанометров. Особенности поведения вещества в виде частиц таких размеров, свойства которых во многом определяются законами квантовой физики, открывают широкие перспективы в целенаправленном получении материалов с новыми свойствами, такими как уникальная механическая прочность, особые спектральные, химические, биологические характеристики.
Уникальные свойства наноматериалов и их биологическая активность могут быть использованы, в частности, для адресной доставки лекарственных препаратов, для борьбы с онкологическими заболеваниями и опасными инфекциями, для целей генной и молекулярной инженерии, для улучшения качества окружающей среды, наночипы и наносенсоры, в парфюмерно-косметической, наночастицы используются как составная часть солнцезащитных кремов, и пищевой промышленности, наноматериалы находят применение в фильтрах для очистки воды.
Примеры применения нанотехнологий можно продолжать бесконечно, и в целом, они призваны улучшить качество жизни человека, благодаря эффективности их использования в различных сферах: в сельском хозяйстве, медицине, охране окружающей среды, в производстве энергии. Однако наночастицы обладают свойствами, которые необходимо учитывать для безопасности и здоровья людей, для сохранения биосферы. Так, обнаружено, что взаимодействие наноматериалов с живыми клетками может быть непредсказуемым и опасным [1].
В связи с этим, определение элементного состава органов и тканей при введении композиций наночастиц металлов в организм животных является целесообразным и актуальным. Проведение такого исследования связано с необходимостью проверки факта накопления элементов, которые могут вызывать токсическое действие, и характера влияния наночастиц на изменения ритма естественных колебаний элементов и взаимоотношение между ними.
Существует концепция, что наноразмерные частицы заслуживают более строгой оценки их эффектов на живые организмы и связанных с этим требований контроля, так как площадь их поверхности и токсичность значительно выше, чем у более крупных частиц.
Органы иммунологической защиты, являясь наиболее восприимчивой системой, в большей мере, отзывчивы на воздействие внешних факторов. В этой связи накопление знаний об изменении минерального состава печени позволит дать оценку безопасности введения наночастиц.
Цель работы: на основании комплексных исследований, включающих морфологический и гистологический контроль тканей печени, особенностей ответа организма на введение наночастиц меди по показателям изменения минерального состава печени, установить манифестные структурно-функциональных критерии, позволяющие оценить диапазон органотипических потенций печени крыс, при внутримышечном введении наночастиц меди.
Для реализации цели мы поставили ряд задач:
1 Изучить степень проявления апоптоза в органах — мишенях при введении в организм наночастиц меди. При анализе уровня эксперссии маркеров апоптоза показать его зависимость от различных доз введения.
2 Выявить структурно-функциональную реорганизацию и диапазон органотипических потенций органов-мишений животных при введении в организм наночастиц меди.
3 Исследовать элементный статус печени животных на ранние и поздние сроки после введения наночастиц меди в организм и выявить коэффициент накопления геннотоксических элементов.
Используемая методика проведения исследований
Учитывая особую роль меди в жизнедеятельности живых систем, потенциальную возможность использования наночастиц меди в составе лекарственных средств и биопрепаратов, нами было проведено исследование изменений микроэлементного состава печени при его структурной перестройки и состояние клеток к апоптозу при многократном введении наночастиц меди экспериментальным животным [2].
Наночастицы меди получали методом высокотемпературной конденсации на установке Миген-3. Для приготовления образца нанопорошок подвергали кратковременному ультрозвуковому деспергированию в ацетоне. Затем наночастицы наносили на специальную углеродную подложку и помещали в микроскоп.
Для изучения влияния введения на степень проявления апоптоза в органах — мишенях в исследованиях использовали крыс-самцов линии Wistar, массой 150—170 г (n=78). Для введения наночастиц металлов в организм животных была разработана лабораторная технологическая схема приготовления инъекционной формы c наночастицами, которая включает следующие стадии: приготовление точной навести нанопорошка, перенесение нанопорошка в водный раствор, последовательное диспергирование суспензии нанопорошка на ультразвуковом диспергаторе в отработанном режиме. Для приготовления инъекционной суспензии нанопорошок меди в определенных концентрациях смешивали с водой для инъекций и подвергали диспергированию в ультразвуковом диспергаторе УЗДН — 2 Т в режиме 0,5 А, 44 кГц при охлаждении по следующей схеме: 30 сек. диспергирования — 1 мин. охлаждения (3 цикла) [3]. Суспензию наночастиц меди вводили экспериментальным животным в бедренную группу мышц в дозе 2,0 мг/кг массы животного с периодичностью 7 дней в течение 12 недель. Биохимический, морфологический и гистологический контроль тканей животных осуществляли через 7 дней после каждой инъекции. Параллельно анализировали состояние обмена 25 микроэлементов. Убой животных проводили путем декапитации под нембуталовым наркозом. Экспериментальные исследования на животных проводили в соответствии с инструкциями, рекомендуемыми (Приказ № 755 от 12.08.1977 МЗ СССР) Российским Регламентом, 1987 г. и «The Guide for the Care and Use of Laboratory Animals (National Academy Press Washington, D.C. 1996)». Отбор проб для исследования структурно-функционального состояния тканей животных и микроэлементного состава проводили через 1 сутки, 7 суток. после I инъекции, 7 суток после II, III, XII инъекций. В контрольную группу входили животные, которым внутримышечно вводили дистиллированную воду в том же объеме и по той же схеме, что и опытным животным. Суспензию готовили перед применением. Область введения выстригали, обрабатывали ватным тампоном, смоченным в спирте. Суспензию вводили инсулиновым шприцом.
В ходе проведенного исследования нами экспериментально подобран срок инкубации препаратов в среде, содержащей солянокислый бензидин и тиацианат аммония, и температурный режим, что позволило выявить наночастицы меди в исследуемых органах [5].При оценке структурно-функциональной реорганизации печени нами наряду с традиционными морфологическими методами - обзорной световой микроскопии, морфометрии с использованием окулярных вставок, позволяющих определить относительную объемную плотность структур в органе [4, 5], использованы современные иммуногистохимические методы.
Для исследования материала на светооптическом уровне его фиксировали в 10 % нейтральном формалине в течение суток при комнатной температуре. После стандартной гистологической проводки материал заливали в парафин. Парафиновые срезы толщиной 5 мкм окрашивали гематоксилином Майера и эозином (Пирс Э., 1962), для определения кислых и нейтральных мукополисахаридов — Шифф-реактивом (ШИК-реакция), соответственно. Мукополисахариды выявляли перйодат-Шифф-реакцией.
Иммуногистохимические исследования проводили на парафиновых срезах при помощи моноклональных антител (Ki-67, Сaspase-3, Вcl-2) и системы визуализации фирмы Bio Genex Super Sensytive Detection System, США. Для оценки пролиферативной активности клеток выявляли экспрессию маркера Ki-67, для определения готовности клеток к гибели путем апоптоза исследовали экспрессию Сaspase-3 (СРР-32), а также возможного угнетения апоптоза — Вcl-2 [6]. Для выявления готовности к запрограммированной клеточной гибели гепатоцитов и эпителиоцитов канальцев почек выявляли экспрессию Сaspase-3 (СРР-32), а также использовали набор Apoptag (Plus Peroxidase in situ Apoptosis Detection Kit-S 71010, Intergen, USA) для выявления фрагментированной ДНК в этих клетках. Производили подсчет иммунопозитивных клеток на 1000 и выражали в ‰.
Определение содержания химических элементов в печени проводили в лаборатории АНО «Центр биотической медицины», г. Москва (аттестат аккредитации ГСЭН.RU.ЦОА.311, регистрационный номер в Государственном реестре РОСС RU. 0001.513118 от 29 мая 2003 г.).
Статистическую обработку полученных данных проводили c исполь-зованием пакета программ «Statistica 5,5 for Windows» и программного пакета «MS Excel 2000». Достоверность различий сравниваемых показателей определяли по t-критерию Стьюдента. Достоверными считали результаты при р ≤ 0,05.
Результаты и их обсуждение
Для исследования влияния увеличивающейся нагрузки наночастиц меди на организм, микроэлементный статус, структуру тканей и готовность клеток к апоптозу были использованы наночастицы со следующими физико-химическими характеристиками: средний размер наночастиц меди, имеющих сферическую форму, составляет 103.0 ± 2.0 нм; кристаллической меди в ядре частиц содержится 96.0 ± 4.5 %, меди оксида — 4.0 ± 0.4 %; толщина оксидной пленки на поверхности наночастиц — 6 нм [6]. Изучение острой токсичности этих наночастиц показало, что фармакотоксическая зона начинается с дозы 10 мг/кг (МПД) массы животного, ЛД50 (летальная доза) составляет 15 мг/кг массы животного, ЛД100 — 30 мг/кг массы животного. Учитывая эти данные, для наших исследований была выбрана однократная доза введения 2 мг/кг массы животного, позволяющая при 5-кратном введении наночастиц меди достичь МПД — 10 мг/кг массы животного, при 12-кратном введении — дозу, близкую к ЛД100 — 24 мг/кг массы животного. Результаты кинетических изменений микроэлементного состава печени, почек, селезенки, костной и мышечной ткани в процессе увеличения нагрузки медью в виде наночастиц на организм выявило, что наиболее выраженные изменения наблюдаются в органах-мишенях: печени и селезенки [7, 12, 13].
Однократное введение меди приводит к резкому увеличению ее концентрации (на 293 % по сравнению с контролем) в печени через сутки после введения. Это связано с активным поступлением самих наночастиц меди в печень [7]. Так, при гистологических исследованиях в васкулярной части перипортальных гепатоцитов и в цитоплазме клеток Купфера печени экспериментальных животных обнаружены наночастицы меди, которые исчезают через 3 суток после введения (Рисунок 1). При этом структурных изменений в органе не выявлено. Причем, система гомеостатического регулирования уровня меди эффективно справляется с поступающими наночастицами и через 7 суток после первого и второго введения уровень меди в ткани равен 81 % и 101 % по сравнению с контролем соответственно.
В васкулярной части перипортальных гепатоцитов и в цитоплазме клеток Купфера печени экспериментальных животных наблюдается аморфное сине-голубое окрашивание (указано стрелкой) экзогенной меди при использовании модифицированного метода окраски с бензидином гистологических срезов фрагментов печени.
При повторном через неделю внутримышечном введении меди наночастицы выявляются преимущественно в васкулярной части перипортальных гепатоцитов. При этом через сутки после второй инъекции металла в васкулярной части перипортальных гепатоцитов выявляются признаки гидропической дистрофии. Среди гепатоцитов появляются также апоптозные тельца Каунсильмена (Рисунок 2).
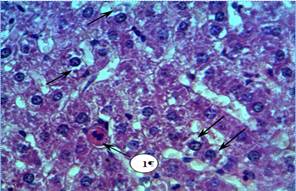
По сравнению с контролем (а) в гепатоцитах опытных крыс (б) наблюдается вакуолизация цитоплазмы (указано стрелкой) и выявляются оксифильные апоптозные тельца Каунсильмена (на рисунке 2 б) под цифрой — 1). Это подтверждают иммуногистохимические исследования по выявлению готовности гепатоцитов к клеточной гибели — апоптозу (Рисунок 3). При иммуногистохимическом выявлении готовности клеток к апоптозу в коричневый цвет окрашена цитоплазма гепатоцита (указана стрелкой), экспрессирующего каспазу-3.
При исследовании микроэлементного состава установлено, что дальнейшее увеличение нагрузки меди на организм приводит к увеличению концентрации меди в ткани, и после третьей (суммарная доза 6 мг/кг) и 12-ой (суммарная доза 24 мг/кг — близкая к токсичной) инъекций концентрация меди в печени опытных животных на 29 % и 63 % выше контроля. При этом функциональная активность клеток печени по показателю экспрессии антигена каспазы-3 меняется и достоверно увеличивается через 3 сут. и 7 сут. после третьей инъекции (Рисунки 4, 5, 6). Следовательно, при усилении нагрузки меди на организм в виде наночастиц происходит увеличение уровня меди в печени, что отражается на ее структурно-функциональном состоянии и после третьей инъекции (суммарная доза 6 мг/кг) выявляется достоверная готовность клеток печени к апоптозу.
Известно, что в системе регуляции уровня микроэлементов в организме большое значение принадлежит взаимоотношениям элементов, носящих конкурентный или неконкурентный характер [8]. Еще в 1970 г. Хилл выдвинул гипотезу, что «физически и химически похожие элементы будут антагонистами в биологических системах».
Рассмотрим с этих позиций изменение микроэлементов в печени при введении наночастиц меди. Через сутки после первой инъекции наночастиц в печени животных происходит резкое в 2,93 раза увеличение меди, которое приводит к снижению содержания железа (1 сут.,7 сут. после I инъекции), кальция (1 сут. после I инъекции), цинка (7 сут. после I инъекции), кадмия (на 85 %), кобальта (на 23 %), олова (67 %) (Рисунок 7, 8). Снижение уровня железа способствует увеличению в 2,33 раза концентрации йода, на 9,0 % содержания селена, на 17 % концентрации марганца в ткани. Следовательно, введение наночастиц меди стимулирует систему регуляции уровня микроэлементов, причем наблюдаемое увеличение уровня меди сразу после введения приводит к изменению концентрации 25 исследованных элементов в печени [10, 14]. Характер этих изменений согласован и за исключением нескольких элементов, амплитуда изменений концентрации которых очень мала, например, цинка (через 1 сут. после введения содержание элемента равно контролю, через 7 сут. на 3 % ниже контроля), построен на антагонистических взаимоотношениях.
Дальнейшее увеличение нагрузки (суммарная доза 4 мг/кг массы животного) наночастиц на организм не нарушает системы гомеостатического регулирования уровня микроэлементов в ткани, и антагонистические взаимоотношения микроэлементов сохраняются. После третьей инъекции (суммарная доза 6 мг/кг массы животного наночастиц, близкая к МПД — 10 мг/кг массы животного) содержание меди в печени увеличивается на 29 % по сравнению с контролем, но антагонистические взаимоотношения между элементами нарушаются. Как результат, происходит увеличение концентрации следующих элементов в печени по сравнению с контролем: Fe, Zn, Mg, Na, Co, Al, Li, K, V, I, Se, B, P, As, Sn, Cd; снижение: Ca, Si, Sr, Pb, Cr; концентрации элементов Ni, Hg не отличается от контроля. В это же самое время наблюдается достоверное увеличение готовности клеток печени к апоптозу. Наконец, после 12-кратного введения наночастиц меди в организм, когда суммарная доза наночастиц меди приближается к ЛД100, происходит увеличение концентрации всех элементов в печени, кроме йода, селена (элемента антиоксидантной защиты) (Рисунок 9) .
Известно, что в регуляции апоптоза существенная роль принадлежит микроэлементам, которые могут усиливать эффект как при дефиците, так и при избытке элементов или в результате дисбаланса ряда жизненно важных микроэлементов. Так, цинк является селективным ингибитором апоптоза, марганец, кадмий, свинец, галлий и др. способны модулировать апоптоз, т. е. по-разному влиять в зависимости от дозы. Элементы селен, цинк, железо, медь препятствуют реализации геноповреждающего действия [11, 12]. Учитывая эти представления, мы рассчитали соотношение элементов, способных индуцировать генные повреждения (Ni, Pb, Cd, Hg, Cr) к элементам, обеспечивающих защиту гена (Se, Zn, Fe, Cu). Оказалось, что после I инъекции соотношение равно 0,59 после II инъекции — 0,88, после III инъекции — 0,84, после XII инъекции — 1,20.
Следовательно, при увеличении нагрузки наночастиц меди на организм, начиная с дозы, обладающей биотическим действием (I инъекция), вплоть до дозы, близкой к ЛД100 (XII инъекция), нарастает дисбаланс микроэлементов в сторону тех элементов, которые обладают генноповреждающим действием.
Таким образом, увеличение нагрузки наночастиц меди на организм приводит к изменению микроэлементного статуса печени. Введение наночастиц меди в суммарной дозе 4 мг/кг способствует началу структурно-функциональной перестройки тканей. Дальнейшее увеличение нагрузки наночастиц меди на организм вплоть до дозы, близкой к ЛД100, вызывает такой дисбаланс микроэлементов, что наблюдается увеличение соотношения микроэлементов в сторону элементов, обладающих геноповреждающим действием, что в свою очередь, увеличивает готовность клеток к апоптозу [15].
Заключение
В результате проведенных исследований установлено, что при увеличении нагрузки наночастиц меди на организм помимо структурной реорганизации тканей, происходит достоверное усиление экспрессии антигена каспазы-3 в клетках печени через 3, 7 суток после 3-кратного внутримышечного введения наночастиц меди (суммарная доза — 6 мг/кг массы животного).
Полученные данные свидетельствуют о высокой биологической активности наночастиц меди при введении в организм.
Выявлено, что увеличение нагрузки наночастицами меди организма приводит к изменению микроэлементного статуса печени. Введение наночастиц меди в суммарной дозе 4 мг/кг способствует началу структурно-функциональной перестройки тканей, что проявляется гидропической дистрофией гепатоцитов, появлением телец Каунсильмена и увеличением готовности клеток к апоптозу. После первой и второй инъекции увеличивается интенсивность проявления апоптоза в клетках печени, но процесс является обратимым. Дальнейшее увеличение нагрузки наночастиц меди на организм вплоть до дозы, близкой к ЛД100, вызывает такой дисбаланс микроэлементов, что наблюдается увеличение соотношения микроэлементов в сторону элементов, обладающих геноповреждающим действием, что в свою очередь, увеличивает готовность клеток к апоптозу с прогрессирующей степенью. Гепатотоксичность наночастиц меди проявляется в дозе 6 мг/кг. Причем, готовность к апоптозу наблюдается в припортальных гепатоцитах после 3 сут.
Установленное нами свойство наночастиц меди в нетоксичных дозах (2 мг/кг — 6 мг/кг) повышать готовность клеток к апоптозу может быть использовано в химиотерапии злокачественных новообразований, в которых происходит торможение апоптоза клеток, содержащих мутации. Такой же особенностью как наночастицы меди модулировать апоптоз клеток обладают наночастицы серебра, на основе которых сделаны повязки для лечения гнойных ран, трофических язв и ожогов.
Кроме того, на основании проведенных исследований становится очевидно, что показатель готовности клеток к апоптозу отражает начавшиеся необратимые структурные изменения независимо от специфики ткани в ответ на введение наночастиц меди [15]. Это дает нам основание предложить показатель апоптоза в качестве критерия для оценки безопасности введения наночастиц меди в организм живых систем. По этому показателю можно судить о допустимых дозах вводимого металла, об органах-мишенях, установить оптимальные и безопасные способы введения наночастиц в организм для дальнейшего использования их в составе лекарственных средств и биопрепаратов.
Приложение
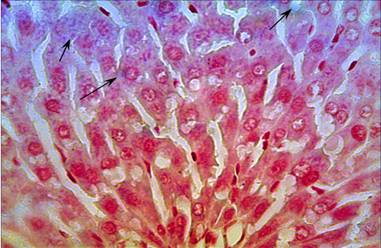
Рисунок 1. Гистологический срез фрагмента печени крысы через 3 часа после однократного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного
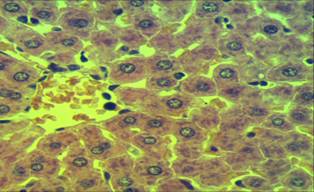
а) б )
Рисунок 2. Гистологический срез фрагментов печени контрольной (а) и опытной крысы (б) на 1 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного
Рисунок 3. Микрофото 15 х 40. Гистологический срез фрагмента печени опытной крысы на 1 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного
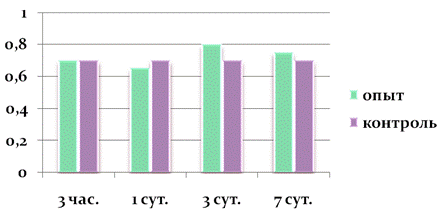
Рисунок 4. Показатели экспрессии каспазы-3 в клетках печени при внутримышечном введении наночастиц меди в дозе 2 мг/кг массы животного (в ‰). Первое введение наночастиц меди. По оси абсцисс отложено время после введения частиц, по оси ординат-промилле
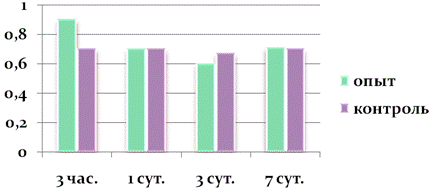
Рисунок 5. Второе введение наночастиц меди
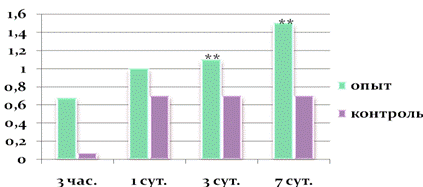
Рисунок 6. Третье введение наночастиц меди
** — результаты являются статистически достоверными (p < 0,05)

Рисунок 7. Разница концентрации минеральных элементов печени 1-ой опытной группы относительно контрольной, %
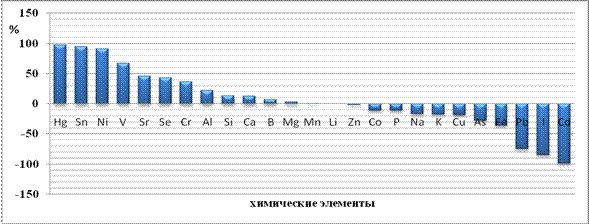
Рисунок 8 Разница концентрации минеральных элементов печени 2-ой
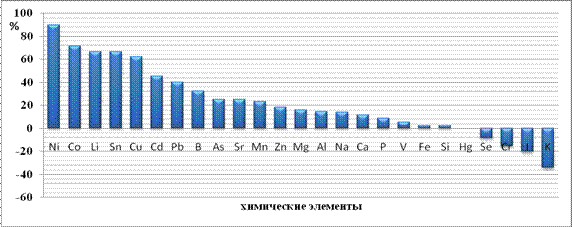
Рисунок 9. Разница концентрации минеральных элементов печени 5-ой опытной группы относительно контрольной, %
Список литературы:
1.Губин С.П. Что такое наночастица? Тенденции развития нанохимии и нанотехнологии / С.П. Губин // Российский химический журнал. — 2000. — Ч. 2 — № 6 — С. 23—30.
2.Артюхов И.В. Нанотехнологии, биология и медицина / И.В. Артюхов, В.Н. Кеменов, С.Б. Нестеров // Вакуумная наука и техника — 2002. — М.: МГИЭМ, 2002. — С. 248—253.
3.Бурень В. М. Биология и нанотехнология: материалы для соврем. и будущей бионики / В.М. Бурень, О.В. Бурень — Ростов н/Д: Феникс, 2006. —125 с.
4 Мосин О.В. Физиологическое воздействие наночастиц меди на организм человека / О.В. Мосин // NanoWeek. — 2008. — № 22 — С. 4—7.
5 Власов В.В. Наноматериалы и наноустройства на основе нуклеиновых кислот / В.В. Власов // Нанотехнологии в биологии и медицине. — 2009. — № 6 — С. 12—15.
6 Зимон А.Д. Особенности коллоидно-химических свойств наночастиц / А.Д. Зимон, А.В. Вегера, А. Н. Павлов. — М.: МГУТУ, 2006. — Т. 3. — 136 с.
7 Кудрин А.В., Жаворонков А.А. Роль микроэлементов и кальция в регуляции апоптоза.//Успехи современной биологии. 1998. 7 с.
8 Оберлис Д., Харланд Б., Скальный А. Биологическая роль макро- и микроэлементов у человека и животных. — СПб.: Наука, 2008. — 544 с.
9 Егорова Е.М. Наночастицы металлов в растворах: биохимический синтез, свойства и приминение / Е.М. Егорова // Нанотехника. — 2004. — № 1 — С. 10—15.
10 Губин С.П. Наночастицы: получение, строение, свойства / С.П. Губин, Г.Ю. Юрков. — Москва: ИОНХ РАН, 2005. — 60 с.
11 Богуславский Л.И. Методы получения наночастиц и их размерно-чувствительные физические параметры / Л.И. Богуславский // Вестник МИТХТ. Химия и технология неорганических материалов. — 2010. — № 5 — С. 20—22.
12 Строение печени // Биологический энциклопедический словарь. — М.: Сов. Энциклопедия, 1986. — С. 377—381.
13 Строение печени // Биология. Современная иллюстрированная энциклопедия. — М.: Росмэн, 2006. — С. 120—125.
14 Функции печени. Виды нарушений функций печени. MedicalPlanet Патофизиология [Электронный ресурс]. — Режим доступа: — URL: http://medicalplanet.
15 Сизова Е.А. Оценка безопасности наночастиц меди с различными физико-химическими характеристиками по показателям токсичности / Е.А. Сизова, В.С. Полякова, С.А. Мирошников // Тезисы докладов XXIII Любищевские чтения: сб. ст. — Ульяновск, 2009. — С. 339—341.
дипломов


Оставить комментарий