Статья опубликована в рамках: V Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 25 октября 2012 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
АНОДИРОВАНИЕ АЛЮМИНИЯ
Уразалиев Ренат Халилович
студент 3 курса, институт нефти и газа, Астраханский государственный технический университет, г. Астрахань
E-mail: renatyra@gmail.com
Кравцов Евгений Евгеньевич
научный руководитель, профессор АГТУ, г. Астрахань
Значение коррозионных исследований определяется тремя аспектами.
Первый из них — экономический. Огромные средства из бюджета государств идут на борьбу с коррозией. Из-за разрушения труб, мостов, различных металлических конструкций на заводах, деталей машин, судов и т. д. в развитых странах тратятся миллиарды долларов на восстановление. К тому же основной статьей расходов является не столько потеря самого металла, сколько повреждение дорогого оборудования.
Вторым аспектом является повышение надежности оборудования, которое в результате коррозии может разрушаться с катастрофическими последствиями, например, сосуды высокого давления, паровые котлы, металлические контейнеры для токсичных материалов, лопасти и роторы турбин, мосты, детали самолетов и автономные автоматизированные механизмы.
Третий аспект — сохранность мировых металлических ресурсов. Природные ресурсы ограничены, а разрушение металла из-за коррозии ведет, кроме того, к дополнительным расходам энергии и воды [2.]
Важным вопросом для ученых-химиков является исследование причин возникновения коррозии, условий, при которых она наиболее агрессивно проявляется и разработка решений для устранения или уменьшения действия коррозии. Разрушение металлов протекает в соответствие с законами природы, и поэтому устранить её полностью не удастся, но замедлить пагубное действие коррозии вполне решаемо для химиков. Разработаны следующие методы защиты металлических поверхностей от разрушения коррозией:
1. Защитные покрытия;
2. Изменение коррозионной среды;
3. Электрохимическая защита металлов;
4. Изобретение новых сплавов или ввод добавок в сплав, улучшающих устойчивость к коррозии, например, добавление хрома или никеля в железо в сплав новых компонентов, сильно повышающих коррозионную устойчивость;
5. Замена металлических материалов химически устойчивыми материалами;
Актуальность устранения данной проблемы состоит в необходимости сохранения запаса металлических ресурсов планеты. Эта проблема находит широкое отражение в печати. Таким образом, необходимость исследования коррозионных процессов является одной из наиболее важных проблем. Осмыслив проблему коррозии, я принял решение разобраться в ее сути, изучить частный случай защиты от коррозии, анодирование (на примере алюминия), и, по возможности, разработать новое эффективное средство для ее устранения.
«Анодирование сплавов — электрохимический процесс получения защитного или декоративного покрытия на поверхности различных сплавов (алюминиевых, магниевых, титановых). Например, при анодировании алюминиевых сплавов деталь погружают в кислый электролит (H2SO4) и соединяют с положительным полюсом источника тока; выделяющийся при этом кислород взаимодействует с алюминием, образуя на его поверхности оксидную плёнку. Наибольшее распространение для анодирования алюминиевых деталей получил сернокислый процесс» [1].
Анодирование проводят в различных средах, заполняющих пространство между электродами: в расплавах солей, в водных растворах электролитов, в газовой плазме, плазменно-электролитическое.

Рисунок 1. Схема модели утолщенных анодных пленок: 1. Пора; 2. Оксидная ячейка; 3. Стенка оксидной ячейки; 4. Беспористый оксидный слой барьерного типа; 5. Отпечатки оснований оксидных ячеек на поверхности алюминия; 6. Алюминий
Экспериментальная часть.
На основе теоретических представлений и данных практики анодирования цель настоящего исследования заключается в разработке сернокислотного электролита, в котором было бы подавлено растравливающее действие хлоридов на анодную плёнку на алюминии.
Методика:
1. Подготовка образцов для анодирования:
Для анодирования из листового алюминия изготавливались аноды с площадью анодируемой поверхности 0,2 дм2 (20 см2). Перед тем как анодировать данные образцы в электролите их поверхность тщательно подготавливалась. Сначала механическим путем поверхность обрабатывалась мелкозернистой наждачной бумагой, потом химическим путём из неё удалялись загрязнения, далее производилось обезжиривание.
Раствор для обезжиривания:
Н2О — 2 л.
Na3PO4 — 20 г.
NaOH — 15 г.
Обезжиривание проводилось для того, чтобы очистить поверхность алюминия от естественных загрязнений, присутствия жира, а также снять естественную оксидную плёнку. Обезжиривание велось в течение 7—10 минут при комнатной температуре.
Этапы подготовки поверхности проводились для того, чтобы получить наиболее качественные покрытия на ней.
2. Анодирование:
Электролит: для электролита использовался 15 %-ный раствор серной кислоты (H2SO4), в котором получались бесцветные гладкие плёнки, в дальнейшем подвергавшиеся капельной пробе.
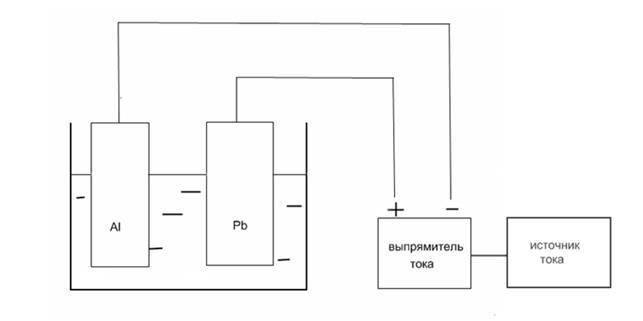
Рисунок 2. Схема ванны для анодирования
Катод (-) — восстанавливается
2Н + 2ē →2Н0
2Н→Н2
Анод (+) – окисляется
2Н2О – 4ē →2О0 + 4Н+
2О0→О2
4Al + 3O2→2Al2O3 — оксидная пленка
Катод изготовляется из свинца, анод алюминиевый; ванной для анодирования служит химический стакан. Анодирование велось при комнатной температуре на постоянном токе в течение 20 минут и 40 минут. Плотность тока изменялась 1 А/дм2; 1,25 А/дм2; 1,5 А/дм2.
Такие же опыты анодирования проводились с добавкой тиазол, добавленной в количестве 700 мг/л электролита.
После анодирования образцы промывались в дистилированнной воде, через 24 часа проводилась капельная проба.
3. Раствор для капельной пробы:
Н2О
К2Сr2O7
HCl
С помощью пипетки раствор для капельной пробы наносился на образцы анодированного алюминия. Отмечалось время, за которое капля раствора, нанесенная на образец, начала зеленеть. Капельная проба проводилась при комнатной температуре порядка 25—28 градусов Цельсия.
Эти данные отражены в таблицах.
Таблица 1.
Данные капельной пробы (без тиазола)
|
№ опыта |
Сила тока (I) |
Время (t) |
Капельная проба |
|
Начало позеленения (минуты) |
|||
|
Электролит 15 мл Н2SO4/850 мл Н2О; — предварительная подготовка(NaOH+Na3PO4) — без тиазола |
|||
|
Опыт № 1 |
1 А/дм2 |
20 минут |
13,54 |
|
Опыт № 2 |
1,25 А/дм2 |
20 минут |
16,18 |
|
Опыт № 3 |
1,5 А/дм2 |
20 минут |
21,28 |
|
Опыт № 4 |
1 А/дм2 |
40 минут |
36,53 |
|
Опыт № 5 |
1,25 А/дм2 |
40 минут |
40,39 |
|
Опыт № 6 |
1,5 А/дм2 |
40 минут |
47,09 |
Таблица 2.
Данные капельной пробы (с тиазолом)
|
№ опыта |
Сила тока (I) |
Время (t) |
Капельная проба |
|
Начало позеленения (мин.) |
|||
|
С тиазолом |
|||
|
Опыт № 7 |
1 А/дм2 |
20 минут |
30,08 |
|
Опыт № 8 |
1,25 А/дм2 |
20 минут |
46,03 |
|
Опыт № 9 |
1,5 А/дм2 |
20 минут |
49,08 |
|
Опыт № 10 |
1 А/дм2 |
40 минут |
57,05 |
|
Опыт № 11 |
1,25 А/дм2 |
40 минут |
54,49 |
|
Опыт № 12 |
1,5 А/дм2 |
40 минут |
60,22 |
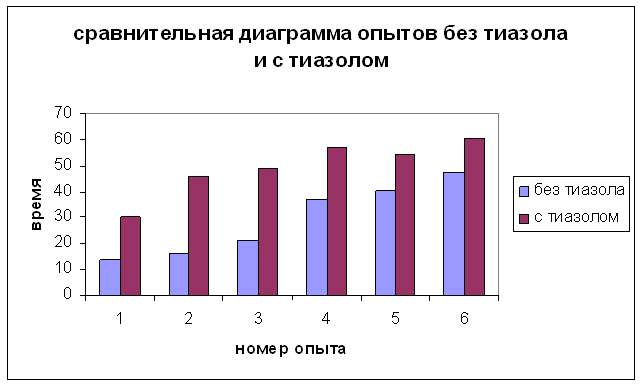
Диаграмма 1
Выводы:
1. Изучен теоретический материал о природе коррозии алюминия, формировании анодно-оксидных пленок, различных способах анодирования.
2. Изучено анодирование алюминия в серной кислоте на постоянном токе для подготовки образцов к капельной пробе.
3. Разработка добавки к сернокислотному электролиту для защиты алюминия от коррозии.
Список литературы:
1.Статья «Анодирование» в Википедии. — [Электронный ресурс] — Режим доступа. — URL: http://ru.wikipedia.org/wiki/Анодирование.
2.Статья «КОРРОЗИЯ И ЕЕ ПОСЛЕДСТВИЯ» — [Электронный ресурс] — Режим доступа. — URL: http://www.rosteplo.ru/Tech_stat/stat_shablon.php?id=235
дипломов


Оставить комментарий