Статья опубликована в рамках: IV Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 27 сентября 2012 г.)
Наука: Физика
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СПЕКТРОСКОПИЧЕСКОЕ ИЗУЧЕНИЕ ВЗАИМОСВЯЗИ КОЛЕБАНИЙ КАРБОНИЛЬНЫХ ГРУПП В КРОКОНОВОЙ КИСЛОТЕ
Вайц Екатерина Вадимовна
студент 3 курса, кафедра медицинской и биологической физики и высшей математики КемГМА, г. Кемерово
Е-mail: pediatr@kemsma.ru
Фадеев Юрий Александрович
научный руководитель, д. физ.-мат. наук, профессор КузГТУ, г. Кемерово
Салтанова Елена Владимировна
научный руководитель, ст. преподаватель, КемГМА, г. Кемерово
В последнее десятилетие значительно возрос интерес к изучению свойств кроконовой кислоты. Это связано с тем, в кристаллическом состоянии между молекулами кроконовой кислоты возникают сильные водородные связи. Известно, что водородные связи играют важную роль в различных физико-химических процессах, протекающих как в живой, так и неживой материи, оказывают существенное влияние на физические свойства различных материалов. В ряде случаев протоны водорода принимают участие в кооперативных явлениях. В будущем предполагается, что кроконовая кислота может быть использована как органический полупроводник, а так же может стать экологически безопасным материалом для органической электроники будущего, в частности для хранения информации [3—12].
Кроконовая кислота (С5H2O5) относится к классу оксокарбоновых кислот с общей формулой ![]() и представляет собой циклопентан с двумя гидроксильными и тремя кетоновыми группами (рис. 1) [1, с. 428—429; 2, с. 366].
и представляет собой циклопентан с двумя гидроксильными и тремя кетоновыми группами (рис. 1) [1, с. 428—429; 2, с. 366].

Рисунок 1. Структурная формула кроконовой кислоты
Методом дифракции рентгеновского излучения [4, 7], установлено, что в кристаллическом состоянии каждая молекула кроконовой кислоты связана с четырьмя другими молекулами. Межмолекулярные связи осуществляются двумя независимыми видами водородных связей (Н-связь), расположенных в разных кристаллографических плоскостях (рис. 2). Одна из связей образует цепь линейных водородных связей A-B-A-B и C-D-C-D почти параллельно полярной оси с. Другая связь А-D-А-D и B-C-B-C идет зигзагом в направлении оси с [7]. Braga D., [4] J. Seliger [10] отмечают, что расстояние O-H…O равно 2,628 Å и 2,617Å, а расстояние O-H (0,98 ± 0,01) Å , что значительно короче длины самой водородной связи. Расстояние О…О равно 2,62–2,63 Å соизмеримо с длиной водородной связи [6].

Рисунок 2. Межмолекулярные водородные связи
Водородные связи образуют полосы из крупных тетрамолекулярных колец [4], которые в пространстве располагаются по образу «аккордеона», образуя угол между полосами 68—69,9° (рис. 3) [4, 5].

Рисунок 3. Пространственное расположение молекул кроконовой кислоты, показывающее структуру типа «аккордеон»
Расположение длинных полос приводит к возрастанию разницы энергии двух протонов в водородной связи, что делает водородные связи более асимметричными, чем в неполярных системах с водородными связями [10]. По каждой полосе происходит перенос двух гидроксильных протонов к карбонильным группам от смежных молекул. S. Horiuchi [6, 7] отмечает, что такая передача протона и происходящее одновременно переключение π — связи может полностью изменять полярность кристалла, если оба процесса происходят совместно.
В работе [11] Seliger J и сотрудники анализируя спектр 13C NMR CP/MAS кроконовой кислоты установили, что две водородные связи O–H. . .O являются неэквивалентными и несимметричными.
Одним из основных методов определения характера внутри- и межмолекулярных связей является ИК спектроскопия, т. е. инфракрасная спектроскопия служит важным методом в структурном анализе. Цель нашей работы — анализ ИК спектров кроконовой кислоты, приведенных в различных литературных данных и сравнение их с ИК спектром полученным нами экспериментально и изучение взаимосвязи колебаний карбонильных групп в кроконовой кислоте.
Yamada K. и сотрудники [12] одними из первых зарегистрировали ИК-спектры пропускания кроконовой кислоты в бромиде калия и в Nujol (рис. 4 и 5). Из анализа спектров следует, что в обоих спектрах наблюдается широкая полоса поглощения в области частот примерно 3000 см -1. Yamada K. и сотрудники предположили, что широкая полоса поглощения на частотах около 3000 см -1 соответствует сильной межмолекулярной водородной связи. Из положения полосы поглощения соответствующей ν O-H водородной связи Yamada K. и сотрудники выдвинули предположение, что водородная связь сильнее, если кроконовая кислота смешивалась с Nujol.
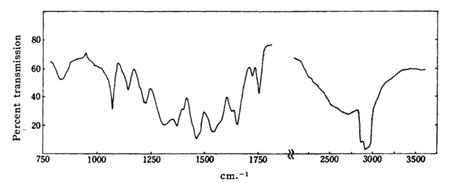
Рисунок 4. ИК-спектр пропускания кроконовой кислоты (Nujol) [12].

Рисунок. 5. ИК-спектр пропускания кроконовой кислоты (KBr) [12].
В области 750—1500 см -1 в спектрах кроконовой кислоты в бромиде калия и в Nujol наблюдается небольшое сходство, в частности на обоих спектрах наблюдается резкая линия поглощения на частоте 1075 см -1. Yamada K. и сотрудники выделили основные линии ИК спектров: 1755, 1720 (широкая), 1655, 1630, 1540 см -1 (Nujol); 1755, 1720, 1665, 1640, 1600, 1560 см -1 (KBr), но не соотнесли частоты поглощения с видами колебаний молекулярных групп в молекуле кроконовой кислоты.
В [9] были получены ИК спектры кроконовой кислоты в кристаллическом состоянии и тонкой пленки кроконовой кислоты в метаноле (рис 6). Из сравнения спектров авторы [9] сделали вывод, что наблюдается незначительное отличие в форме и положении полос поглощения вследствие чувствительности молекулы кроконовой кислоты к ее окружению. Две полосы поглощения с максимумами 1722 и 1756 см-1 соответствуют колебаниям карбонильных групп. Широкая полоса поглощения от 3500 до 2000 см-1 соответствует OH- связи. Полосы поглощения расположенные между 1700 и 1500 см-1 соответствуют продольным колебаниям группы С=С; продольные колебания С-О наблюдаются на частоте 1070 см-1.
Рисунок 6. ИК спектры кроконовой кислоты и кроконовой кислоты в метаноле [7].
В [8] приведены результаты теоретических расчетов ИК спектра, а также неполяризованный и линейно поляризованные спектры кроконовой кислоты. Теоретические расчеты частот ИК спектра проводились с учетом пространственного строения молекулы. Теоретические расчеты показали, что в спектре могут присутствовать линии поглощения 3617 и 3582 см-1, первая из которых соответствует валентному колебанию свободной ОН группы, второе — внутримолекулярной водородной связи ОН группы. Частоты валентных колебаний групп С=О равны: 1781 см-1 С=О2 , 1764 см-1 симметричное валентное колебание С=О1, 1703 см-1 — антисимметричное валентное колебание С=О3 (нумерация атомов кислорода приведена на рис. 1). Частоты 800, 560 и 510 см-1 согласно вычислениям соответствуют колебаниям атомов углерода перпендикулярным плоскости кольца. Валентные колебания сильной водородной связи проявляются в неполяризованном спектре кроконовой кислоты в виде широкой полосы поглощения 3300—2000 см-1 (рис. 7). В области частот 1800—1500 см-1 наблюдаются две полосы поглощения 1755 и 1721 см-1 , соответствующие валентным колебаниям С=О. Наблюдаемое различие в частотах валентных колебаний С=О (26 и 43 см-1) между теоретическими и экспериментальными значениями можно объяснить участием С=О группы в образовании межмолекулярной водородной связи.
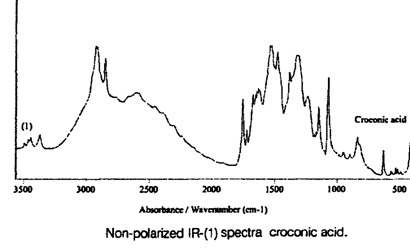
Рисунок 7. Неполяризованный ИК (1) спектр кроконовой кислоты [8].
В своей работе для регистрации ИК спектра мы использовали поликристаллы кроконовой кислоты чистотой 98 % и молекулярной массой 142,07. ИК-спектры регистрировались ИК фурье-спектрометром ФСМ 1202 фирмы Инфраспек (Россия). Перед записью спектра кристаллический порошок кроконовой кислоты тщательно растирался в агатовой ступке и перемешивался с бромидом калия в соотношении 1,0: 100,0 мг. Полученную смесь при комнатной температуре прессовали в таблетку на гидравлическом прессе под давлением 8000 г/см2 и дополнительным вакуумированием для дополнительной сушки образца. ИК спектр регистрировался в диапазоне 400—4000 см-1 с разрешением 0,5 см -1 , стандартным отклонением 0,103 и отношением сигнал/шум 5,248. Обработка спектров производилась с использованием программного обеспечения Fspec.
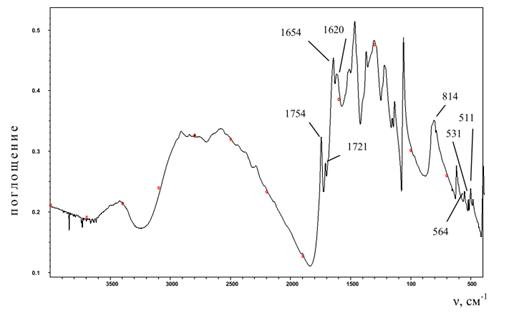
Рисунок 8. ИК-спектр поглощения кроконовой кислоты при комнатной температуре (KBr).
Сравнительный анализ ИК спектров кроконовой кислоты полученных в работах [8, 9]. приведен в таблице 1.
Таблица 1.
Сравнительный анализ ИК спектров кроконовой кислоты.
Вид колебаний |
ν, см -1 [9] |
ν, см -1 [8] calculated IR-spectra
|
ν, см -1 [8] non-polarized IR-spectra |
ν, см -1 данные настоящей работы |
|
С=О валентные колебания |
1722 1756 |
1781 С=О2 |
|
|
симметричное валентное колебание С=О1 |
||||
1764 |
1755 |
1754 1654 |
||
антисимметричное валентное колебание С=О3 |
||||
1703 |
1721 |
1721 |
||
|
ОН группа валентные колебания |
3500—2000 |
3617 свободная ОН группа 3582 внутримолекулярная водородная связь ОН группы |
3300—2000 |
3200—1900 |
|
ОН группа деформационные колебания |
|
522 |
|
531,6 |
|
C=C |
1700 1500 |
1800—1500 |
1633 |
|
|
колебания атомов С перпендикулярные плоскости кольца |
|
800 560 510 |
|
800 565 511 |
Проведя анализ полученного ИК спектра кроконовой кислоты, можно сделать вывод, что участие карбонильных групп в межмолекулярном взаимодействии в кислотах, проявляется с образованием как внутри, так и межмолекулярной Н-связи. Н-связь может оказывать влияние на формирование кристаллической структуры вещества. В ИК спектрах присутствие двух и более С=О связей проявляется в виде нескольких полос, которые относятся к валентным симметричным ![]() и антисимметричным
и антисимметричным ![]() колебаниям. Данные полосы являются характеристическими по частоте и расположены в узком интервале частот от 1650 до 1750 м-1. расщепление частот
колебаниям. Данные полосы являются характеристическими по частоте и расположены в узком интервале частот от 1650 до 1750 м-1. расщепление частот ![]() зависит от различных факторов, среди которых присутствуют как стерические, так и динамические факторы. К стерическим факторам можно отнести такие, как расстояние между карбонильными связями в молекулах, а также значение угла между ними. Очевидно, что если угол между карбонильными связями составляет 90°¸то их колебания практически не влияют друг на друга. В то же время компланарность карбонильных групп приводит к их наибольшему взаимодействию. Степень взаимодействия С=О существенно уменьшается по мере выхода этих связей из компланарного состояния. Таким образом, анализируя величину расщепления
зависит от различных факторов, среди которых присутствуют как стерические, так и динамические факторы. К стерическим факторам можно отнести такие, как расстояние между карбонильными связями в молекулах, а также значение угла между ними. Очевидно, что если угол между карбонильными связями составляет 90°¸то их колебания практически не влияют друг на друга. В то же время компланарность карбонильных групп приводит к их наибольшему взаимодействию. Степень взаимодействия С=О существенно уменьшается по мере выхода этих связей из компланарного состояния. Таким образом, анализируя величину расщепления ![]() в спектрах кроконовой кислоты можно судить об изменении геометрии молекул и внешних факторах, влияющих на динамические характеристики карбонильной связи.
в спектрах кроконовой кислоты можно судить об изменении геометрии молекул и внешних факторах, влияющих на динамические характеристики карбонильной связи.
Список литературы:
1.Свойства органических соединений: Справочник. — под ред. Потехина А.А. — Л.: Химия, 1984. — 518 с.
2.Химическая энциклопедия. М.: Большая российская энциклопедия, 1992. — Т. 3. — С. 366.
3.Bisti F., Stroppa A., Picozzi S., Ottaviano L. Fingerprints of the hydrogen bond in the photoemission spectra of croconic acid condensed phase: an x-ray photoelectron spectroscopy and ab-initio study. //Chem Phys. — 2011. — V. 134 (17): 174505.
4.Braga D., Maini L., Grepioni F. Crystallization from hydrochloric acid affords the solid state structure of croconic acid (175 years after its discovery) and a novel hydrogen-bonded network // Cryst Eng Comm. — 2001. — V. 6. — I. 3. — P. 27—29.
5.Braga D., Maini L., Grepioni F. Сroconic acid and alkali metal croconate salts: some new insights into an old story. //Chem. Eur. J. — 2002. — V. 8. — I. 8. — P. 1804—1812.
6.Horiuchi S., Kumai R.. Tokura Y. Hydrogen-bonding molecular chains for high-temperature ferroelectricity //Advanced Materials. — 2011. — V 23. — P. 2098—2103.
7.Horiuchi S., Tokunaga Y., Giovannetti G. Above-room-temperature ferroelectricity in a single-component molecular crystal. //Nature. — 2010. — V. 463. — P. 789—793.
8.Kolev T., Koleva B., Spiteller M. Solid-state linear polarized IR-spectroscopy of croconic and rhodizonic acids //European Journal of Chemistry. — 2008. — V. 6. — № 3. — P. 393—399.
9.O'Malley S.M, Sun Yong Yi, Jimenez R. Matrix-assisted pulsed laser deposition of croconic acid, a diprotic organic ferroelectric //Applied Physics A Materials Science & Processing. — 2011. — V. 105. — № 3. — P .635 — 641.
10.Seliger J. Nuclear Quadrupole resonance study of hydrogen bonded solid materials. //Acta Chim. Slov. — 2011. — V. 58. — P 471—477.
11.Seliger J., Plavec J., Šket P., Žagar V., Blinc R. 17 O NQR and 13 C NMR study of hydrogen-bonded organic ferroelectric croconic acid. //Phys. Status Solidi B. —2011. — V. 248. — № 9. — P. 2091—2096.
12.Yamada K., Mizuno N., Hirata Y. Structure of Croconic Acid. //Bulletin of the Chemical Society of Japan. — 1958. — V. 31. — I 5.—P. 543—549.
дипломов


Оставить комментарий