Статья опубликована в рамках: XVI Международной научно-практической конференции «Проба пера» (Россия, г. Новосибирск, 27 мая 2015 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ПОЛУЧЕНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА
Крикунов Станислав
Класс 10 «В», МБОУ лицей «Технический лицей при ДГТУ», РФ, г. Ростов-на-Дону
Задошенко Елена Геннадьевна
научный руководитель, учитель химии, кандидат технических наук, доцент, МБОУ лицей «Технический лицей при ДГТУ», РФ, г. Ростов-на-Дону
Известно [1], что железо с кислородом может образовывать три вида оксидов: оксид железа (II) FeO, оксид железа (III) Fe2O3, оксид железа (II, III) Fe3O4 .
Оксид железа (II) называется вюрсит, имеющий кубическую решетку типа хлорида натрия, является метастабильным, легко переходит в Fe3O4. Для оксида железа (III) характерны две кристаллические модификации: ромбоэдрическая α-Fe2O3 — гематит, проявляющий антиферромагнитные свойства, кубическая γ-Fe2O3 — маггетит, отличающийся от гематита наличием ферромагнитных свойств. Смешанный оксид железа (II, III) Fe3O4 — это магнетит, имеет кристаллическую структуру обращенной шпинели [2], проявляет магнитные свойства.
Среди всех известных кислородсодержащих соединений железа для науки и техники наибольший интерес представляют следующие оксиды: гематит, маггетит и магнетит. Последний является достаточно распространённым минералом чёрного цвета, образует большие скопления и рудные залежи. Он тверд, непрозрачен, имеет металлический блеск, характеризуется высокой электрической проводимостью и сильными ферромагнитными свойствами, т.е. способен намагничиваться в отсутствие внешнего магнитного поля. Благодаря хорошей электропроводности, изделия из плавленого магнетита используют в качестве электродов для некоторых электрохимических процессов, а также для изготовления заземлителей. Магнетит в наноразмерной структуре используется в качестве катализаторов, сенсоров, магнитных носителей информации, магнитных жидкостей, систем доставки лекарств [3—6].
Одним из распространенных способов получения наночастиц оксида железа является термическое разложение (пиролиз) его органических солей (оксалатов, цитратов и т. д.) с последующим окислением кислородом. В литературе [7—10] указывается на многообразие вариантов термолиза оксалата железа, однако имеются трудности с оптимизацией проведения синтеза, неоднозначно установлен состав конечных продуктов. В некоторых лабораторных руководствах по химии рекомендуется нагреванием оксалата железа (II) получать пирофорное железо, которое на воздухе окисляется с образованием Fe3O4.
Целью настоящей работы является получение частиц оксида железа и определение их размеров.
Для решения поставленной цели необходимо было получить оксалат железа (II), провести пиролиз соли с последующим получением оксида железа, установить размеры полученных частиц оксида железа с помощью атомно-силовой микроскопии.
Для проведения синтеза использовали следующие реактивы и оборудование: оксалат аммония, сульфат железа (II), дистиллированная вода, пробирки, спиртовка, два мерных стаканчика, стеклянные палочки, магнитная мешалка, воронка, фильтровальная бумага, ступка, фарфоровые чашечки, технические весы, штатив, атомно-силовой микроскоп фирмы Phywe. Синтез проводили поэтапно.
1. Получение оксалата железа (II)
Оксалат железа (II) получали реакций обмена между растворами солей сульфата железа (II) и оксалата аммония.
FeSO4 + (NH4)2C2O4 + 2H2O= FeC2O4·2H2O¯ + (NH4)2SO4 (1)
Для приготовления растворов этих солей с концентрацией 1 моль/л объемом 30 мл на технических весах взвешивали 4,68 г соли FeSO4 и 3,72 г соли (NH4)2C2O4 которые растворяли в 30 мл дистиллированной воды (рис. 1).

Рисунок 1. Растворы солей: слева оксалат аммония, справа сульфат железа
Приготовленные растворы смешали и наблюдали выпадение осадка оксалата железа (II) желтого цвета (рис. 2).

Рисунок 2. Взвесь оксалата железа на магнитной мешалке
Затем полученный осадок фильтровали через воронку, используя фильтровальную бумагу. Оставшийся на фильтровальной бумаге осадок переносили в фарфоровую чашку и высушивали в сушильном шкафу при температуре 100 °С.
2. Разложение оксалата железа и получение оксида железа
Полученный оксалат железа переносили в пробирку, закрепив ее в лапке штатива, затем проводили нагревание с помощью спиртовки в атмосфере выделяющихся газов, конденсированную на стенках пробирки воду удаляли ватной палочкой во избежание контакта с порошком железа (рис. 3).

Рисунок 3. Разложение оксалата железа над пламенем спиртовки
При нагревании оксалата железа идет реакция разложения по уравнению:
FeC2O4·2H2O = Fe + 2CO2 + 2Н2О (2)
Реакцию разложения прекращали, когда весь порошок желтого цвета приобретал черный цвет. Согласно литературным данным [8] черный порошок представляет собой пирофорное железо. Пирофорность — способность твердого вещества, находящегося в мелко измельченном состоянии, самовоспламеняться на воздухе без дополнительного нагрева. Она объясняется тем, что частицы вещества при достаточно малом размере и большой площади поверхности быстро нагреваются за счет экзотермической реакции окисления кислородом, содержащимся в воздухе. При высыпании твердого вещества из пробирки, происходит его возгорание и образуются мелкие частицы оксида железа.
3Fe+ 2O2 = Fe3O4 (3)
3. Результаты атомно-силовой микроскопии
Форма и размеры частиц оксида железа изучались с использованием прибора AFM compact Phywe. Предварительно проводили ультразвуковую обработку оксида железа в растворе этанола в течении 15 минут, а затем методом распыления раствор наносили на подложку кварцевого стекла. После высыхания спирта проводили сканирование поверхности размером 15х16 мкм и 3х3 мкм. Результаты сканирования представлены в трехмерной системе координат на рис. 4 и рис. 5.
Анализ результатов АСМ показал, что частицы оксид железа имеют различные размеры: от 60—70 нм до 1—1,5 мкм.
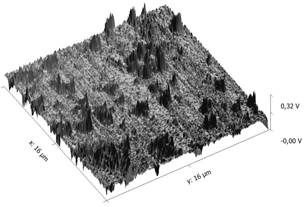
Рисунок 4. АСМ (поле 16×16 мкм)

Рисунок 5. АСМ (поле 3×3 мкм)
Как известно, магнетит проявляет магнитные свойства: меняет свою структуру под действием магнитного поля. На рис.6 представлено изображение намагниченных частиц оксида железа.
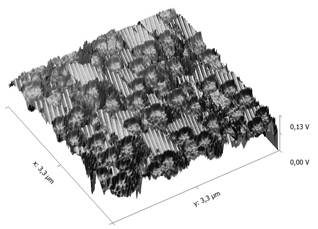
Рисунок 6. АСМ (поле 3,3×3,3 мкм)
Таким образом, в результате проведенной работы получены частицы оксида железа из оксалата железа и установлено, что частицы имеют полидисперсный характер от 60 нм до 1,5 мкм.
Список литературы:
1.Губин С.П. Магнитные наночастицы: методы получения, строение и свойства // Успехи химии. — 2005. — Т. 74. — № 4. — С. 539—574.
2.Белов К.П. Загадки магнетита // Соросовский образовательный журнал. — 2000. — Т. 6. — № 4. — С. 71—76.
3.Tang Z., Sheng P. Nano science and technology: Novel structures and phenomena. New York: Taylor and Francis, 2003. — 272 p.
4.Анисимова Н.Ю., Сенатов Ф.С., Миляева С.И. и др. Исследование сорбционных свойств ферримагнитных наночастиц // Фундаментальные исследования. — 2011. — № 11. — С. 263—265.
5.Такетоми С., Тикадзуми С. Магнитные жидкости: пер. с японск. М.: Мир, 1993. — 272 с.
6.Ахметов М.А. Введение в нанотехнологии. Химия. Учебное пособие для учащихся 10—11 классов средних общеобразовательных учреждений. СПб: Образовательный центр «Участие», Образовательные проекты, 2012. — 108 с. (Серия «Наношкола»).
7.Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии. М.: Химия, 1979. — С. 265.
8.Платонов Ф.П. Лекционные опыты и демонстрации по общей и неорганической химии. М.: Высшая школа, 1976. — С. 214.
9.Практикум по общей и неорганической химии / под ред. М.Х. Карапетьяна и С.И. Дракина. М.: Высшая школа, 1969. — С. 236.
10.Леенсон И.А. Загадка оксалата или реакция, которой интересовались все знаменитости // Химия и жизнь. — 2002. — № 7. — С. 50—53.
дипломов

Оставить комментарий