Статья опубликована в рамках: VI Международной научно-практической конференции ««Проба пера» ЕСТЕСТВЕННЫЕ И МАТЕМАТИЧЕСКИЕ НАУКИ» (Россия, г. Новосибирск, 09 апреля 2013 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
ОЦЕНКА СТРУКТУРНОЙ ОРГАНИЗАЦИИ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (ПС) МЕТОДАМИ СТИ
Алматова Зарина
Жаулыбай Жандос
класс 11, многопрофильная специализированная школа № 27 г. Актобе
Агишева Алмагуль Абилкаировна
научный руководитель, канд. хим. наук, старший преподаватель, Актюбинский государственный педагогический институт, Казахстан
Объектом познания синергетической теории информации (СТИ) являются информационно-количественные аспекты отражения дискретных системных образований. Согласно информационному закону отражения СТИ информация, отражаемая системой через совокупность своих частей, разделяется на отраженную и неотраженную части, первая из которых — аддитивная негэнтропия отражения (![]() ) — характеризует структуру системы со стороны ее упорядоченности, а вторая, энтропия отражения (S), является показателем структурного хаоса. При этом в любой системе A с фиксированным числом элементов m(A)
) — характеризует структуру системы со стороны ее упорядоченности, а вторая, энтропия отражения (S), является показателем структурного хаоса. При этом в любой системе A с фиксированным числом элементов m(A) ![]() — при структурных преобразованиях без изменения числа элементов системы сумма порядка и хаоса сохраняется [1].
— при структурных преобразованиях без изменения числа элементов системы сумма порядка и хаоса сохраняется [1].
В качестве обобщенной характеристики структурной организации системных образований используют R-функцию: ![]() . Для произвольной системы А с числом элементов m(A), разделенной по какому-либо признаку на N частей B1, B2, ... , BN с числом элементов в каждой части соответственно равным m(B1), m(B2), ... , m(BN)
. Для произвольной системы А с числом элементов m(A), разделенной по какому-либо признаку на N частей B1, B2, ... , BN с числом элементов в каждой части соответственно равным m(B1), m(B2), ... , m(BN) ![]() . Тогда формулы аддитивной негэнтропии и энтропии отражения имеют вид:
. Тогда формулы аддитивной негэнтропии и энтропии отражения имеют вид:
![]() ,
, ![]() .
.
И
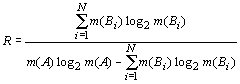
...Значения R-функции показывают, что и в какой мере преобладает в структурной организации системы: хаос или порядок. Если , то в структурной организации системы преобладает порядок, когда — хаос. Если , то хаос и порядок уравновешивают друг друга, структурная организация системы является равновесной.
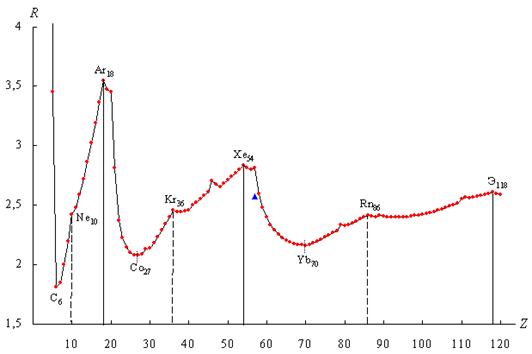
Рисунок 1. График R-функции электронных систем атомов химических элементов в плоскости орбитального квантового числа
Электронные системы атомов химических элементов состоят из конечного множества электронов, число которых равно порядковому номеру элементов (Z) в ПС. Рассматривая эти системы в плоскости какого-либо квантового числа, можно с помощью R-функции оценивать соответствующую, например, ![]() структурную организацию систем.
структурную организацию систем.
Если в качестве системных объектов взять совокупности электронов с одинаковым значением l, то есть, s, p, d, f совокупности и обозначить количество электронов в них через ![]() , то для атома криптона,
, то для атома криптона,![]() Подставляя в формулу R-функции с учетом
Подставляя в формулу R-функции с учетом![]() , получаем
, получаем ![]()
![]()
![]()
![]() И
И ![]() .
.
Расчет значений R-функции в плоскости орбитального квантового числа для электронных систем химических элементов (рисунок 1) выявил периодический характер зависимости R-функции от порядкового номера элемента, которую можно разделить на четыре основных периода (Т-периода), границы которых проходят по максимумам R-функции у химических элементов с Z = 2, 18, 54, 118. Количество элементов в периодах (m(TN), где N — номер Т-периода) равно:
![]()
В СТИ эти периоды названы орбитально-волновыми периодами структурной организации электронных систем атомов химических элементов (Т-периодами), которые соответствуют подобным периодам (р-периодам) казахстанских химиков [2, 3, 4].
В структурной организации электронных систем химических элементов, рассматриваемых в плоскости орбитального квантового числа, присутствует вторичная периодичность. Каждый орбитально-волновой период делится на два полупериода с одинаковым количеством элементов: ![]() При этом каждый орбитально-волновой период охватывает два химических периода (
При этом каждый орбитально-волновой период охватывает два химических периода (![]() — номер периода) с одинаковым числом элементов
— номер периода) с одинаковым числом элементов ![]() , то есть:
, то есть:
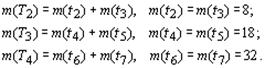
Соответственно, все орбитальные полупериоды в точности совпадают с химическими периодами и равны с ними по числу элементов. Орбитальные полупериоды (химические периоды) обозначаются символом tn.
Количество элементов в химическом периоде зависит от того, к какому периоду структурной организации он принадлежит.
Количество элементов в химических периодах: ![]() Применяя последнюю формулу к семи известным химическим периодам периодической системы Д.И. Менделеева, получаем числовой ряд: 2, 8, 8, 18, 18, 32, 32, члены которого в точности соответствуют количеству их элементов. При этом первый орбитальный период по своей сущности является орбитально-волновым полупериодом.
Применяя последнюю формулу к семи известным химическим периодам периодической системы Д.И. Менделеева, получаем числовой ряд: 2, 8, 8, 18, 18, 32, 32, члены которого в точности соответствуют количеству их элементов. При этом первый орбитальный период по своей сущности является орбитально-волновым полупериодом.
Во всех орбитальных периодах структурной организации электронных систем атомов химических элементов орбитальное квантовое число принимает ряд значений, максимальное из которых ![]() выражается формулой:
выражается формулой: ![]() , а общее число этих значений равно, соответственно, номеру периода N. При этом в каждом орбитальном полупериоде наблюдаются все N значений орбитального квантового числа, а соответствующее число s, p, d, f электронов
, а общее число этих значений равно, соответственно, номеру периода N. При этом в каждом орбитальном полупериоде наблюдаются все N значений орбитального квантового числа, а соответствующее число s, p, d, f электронов ![]() в атомах их элементов (как и число самих s, p, d, f элементов) достигает величины:
в атомах их элементов (как и число самих s, p, d, f элементов) достигает величины:
![]()
В орбитальных полупериодах число электронов с данным значением орбитального квантового числа ![]() связано с номером орбитального периода, в котором они впервые появились, зависимостью:
связано с номером орбитального периода, в котором они впервые появились, зависимостью: ![]()
Заменяя N на ![]() , получаем общую формулу числа электронов при данном значении орбитального квантового числа, хорошо известную из курса теории строения атома:
, получаем общую формулу числа электронов при данном значении орбитального квантового числа, хорошо известную из курса теории строения атома: ![]()
Число элементов в орбитальном полупериоде конкретизируется в виде форм![]() улы: из которой в отношении числа элементов орбитально-волновых периодов (как и в отношении числа образующих их электронов) следует:
улы: из которой в отношении числа элементов орбитально-волновых периодов (как и в отношении числа образующих их электронов) следует: ![]() .
.
В химических периодах максимальное значение орбитального квантового числа у электронов атомов их элементов подчиняется условию:
![]()
то есть орбитальное квантовое число в химических периодах принимает ряд значений ![]() . Можно констатировать, что информационно-синергетическая теория ПС подтвердила некоторые несоответствия традиционной ПС, ранее указанные в работах наших соотечествеников [2, 3, 4].
. Можно констатировать, что информационно-синергетическая теория ПС подтвердила некоторые несоответствия традиционной ПС, ранее указанные в работах наших соотечествеников [2, 3, 4].
Так, согласно теории Нурлыбаева И.Н. предлагается ввести понятие подобных периодов (рn-периодов), где р1-период включает первый химический период, р2-период объединяет второй и третий химические периоды, р3-период — четвертый и пятый химические периоды, р4-период — шестой и седьмой химические периоды. Им же предлагается математическое выражение периодического закона в виде Z = 2pn2, аналогичное выражению ![]() , выведенному согласно аппарату СТИ. По Нурлыбаеву И.Н., количество элементов в химических периодах ПС Д.И. Менделеева равно удвоенному квадрату номера подобного периода, к которому они принадлежат. Таким образом, химическая наука находится на пути переосмысления сущности периодического закона, в частности, возможного изменения базового понятия главного квантового числа.
, выведенному согласно аппарату СТИ. По Нурлыбаеву И.Н., количество элементов в химических периодах ПС Д.И. Менделеева равно удвоенному квадрату номера подобного периода, к которому они принадлежат. Таким образом, химическая наука находится на пути переосмысления сущности периодического закона, в частности, возможного изменения базового понятия главного квантового числа.
Список литературы:
1.Вяткин В.Б. Структурная организация электронных систем атомов химических элементов в свете синергетической теории информации // Ergo. Проблемы методологии междисциплинарных исследований и комплексного обеспечения научно-исследовательской деятельности. Вып. 4. Екатеринбург: УрО РАН, 2005.
2.Нурлыбаев И.Н. О формулировке периодического закона//Вестник КазНУ. Сер. химическая, № 4. — 2004 — С. 583.
3.Нурлыбаев И.Н., Семкина К.Ю. О формулировке периодического закона и подобии периодов периодической системы Д.И. Менделеева // XIX Менделеевс. съезд по общей и прикл. химии. Тезисы докл. — Волгоград. — 2011. — том 4. — С. 561.
4.Нұрлыбаев И.Н., Иманғалиева Б.С. Д.И. Менделеевтің периодтық заңының тұжырымдамасын қорыту // Вестник КазНУ. Сер. химическая, № 4 (64). — 2011 г — С. 176.
отправлен участнику

Оставить комментарий