Статья опубликована в рамках: I Международной научно-практической конференции ««Проба пера» ЕСТЕСТВЕННЫЕ И МАТЕМАТИЧЕСКИЕ НАУКИ» (Россия, г. Новосибирск, 25 октября 2012 г.)
Наука: Химия
- Условия публикаций
- Все статьи конференции
дипломов
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АНТРАЦЕНПРОИЗВОДНЫХ В ЛЕКАРСТВЕННОМ РАСТИТЕЛЬНОМ СЫРЬЕ
Пушпушева Ольга
класс 10 «В», МБОУ «Гимназия № 9», г. Красноярск
Лыкова Елена Викторовна
научный руководитель, педагог высшей категории, преподаватель химии, МБОУ «Гимназия № 9», г. Красноярск
Береснев Вячеслав Александрович
научный руководитель, канд. хим. наук, доцент кафедры химии Красноярский государственный педагогический университет им. В.П. Астафьева, г. Красноярск
Большое число растений, сырье которых используется в лечебных целях, накапливают антраценпроизводные, в значительных количествах. Эти соединения обуславливают разнообразные фармакотерапевтические действия многих фитопрепаратов: слабительное, вяжущее, противовоспалительное, адаптогенное, диуретическое, противоопухолевое. Особое внимание в связи с ухудшающимися условиями экологического состояния окружающего мира в последнее время уделяется лекарственным растениям адаптогенного действия.
Антраценпроизводные широко распространены в растительном мире. По данным В.А. Стихина и А.И. Баньковского в растениях обнаружено около 200 веществ этой группы. Наиболее часто встречаются в растениях семейств Fabaceace, Hypericaceae, Liliaceae, Polygonaceae, Rhamnaceae, Rubiaceae. Также они обнаружены в грибах, в том числе в различных видах плесени, лишайниках, насекомых и морских животных.
Наиболее важной функцией антраценпроизводных является их участие в окислительно-восстановительных процессах, протекающих в растениях. Также они выполняют защитную функцию от различных микроорганизмов, насекомых (обладают антибиотическими свойствами); стимулируют образование полисахаридов в растениях.
Среди фармакологически активных соединений, синтезируемых растениями, своеобразную группу представляют производные антрацена хиноидной структуры. Они могут существовать как в гликозилированной, так и негликозилированной форме. Большинство производных антрацена относится к полиокси(метокси)-антрахинонам с заместителями –CH3, –CH2OH, –CHO, –COOH в β-положении, в то время как –OH и –OCH3 — группы могут находиться как в α-, так и в β-положении (рис. 1).
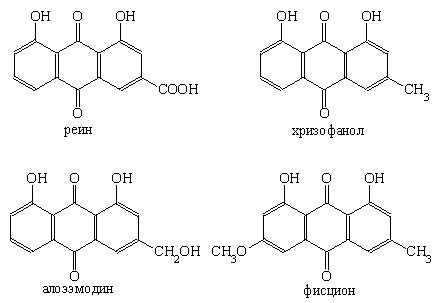
Рисунок 1. 9, 10-Антрахиноны, выделенные из растений.
По своему фармакологическому действию антраценпроизводные относятся средствам, усиливающим перистальтику толстого кишечника. Целью данной работы является определение количественного состава антраценпроизводных в растительном сырье, используемом в современной медицине (кора крушины и листья сенны).
Крушина ольховидная (Frangula alnus Mill.). Высокий кустарник или деревце с гладкими, расположенными поочередно ветвями, покрытыми белыми чечевичками. Листья очередные, широкоэллиптические, цельнокрайние, блестящие, гладкие, с 6—8 парами параллельных вторичных жилок. Цветки мелкие, зеленовато-белые, собраны пучками в пазухах листьев. Плод — костянка, меняющая свою окраску (зеленая, красная и черная), содержащая внутри две плоские с клювовидным выростом косточки. Цветет в мае-июне, плодоносит в сентябре. Имеет евразиатский тип ареала. Она занимает всю европейскую часть страны, произрастает на Кавказе, в Сибири — до Алтая и р. Енисей. На севере доходит до полярного круга. Кроме того, встречается в Северном Казахстане и на юге Красноярского края. В свежей собранной коре крушины содержится первичный антрагликозид — фрагуларозид, обладающий рвотными свойствами, и антранолы, способные к окислению. При хранении коры крушины франгуларозид окисляется ферментами в гликофрангулин, агликоном которого является франгула-эмодин. Поэтому использовать кору крушины рекомендует только через год после заготовки сырья. Хранение в течение года может быть заменено прогреванием сырья при температуре 100 °С в течение часа. В продажу поступает кора крушины, подвергнутая тепловой обработке или хранившаяся не менее 1 года, следовательно, в коре крушины, готовой к медицинскому применению, могут одновременно находиться гликофрагулин, франгулин и франгула-эмодин, а также хризофанол (хризофановая кислота).

Рисунок 2. Кора крушины, используемая для анализа
Кассия (сенна) остролистная (Cassia acutifolia Del.). Кассия (сенна) узколистная (Cassia angustifolia Vahl.). Небольшие полукустарники высотой от 0,5 до 1 м. Листья крупные, парноперистосложные, содержащие 4—8 пар листочков, очередные. Цветки желтые неправильные, собраны в пазушные кисти. Плод — плоский широкоовальный перепончатый сухой буроватый многосемянный боб. Цветет с июля до осени. Растение тропического климата. В диком виде в стране не встречается. До революции листья и плоды кассии в значительных количествах ввозились из-за границы. Кассия остролистная растет в бассейне среднего Нила, кассия узколистная — по берегам Красного моря. Культивируется в Индии и Пакистане. Листья, плоды и стебли кассии остролистной содержат антрагликозиды. Среди них сеннозид А, расщепляющийся на агликон сеннидин А (диреинантрон) и две молекулы глюкозы. В растении найден также сеннозид В: при гидролизе он дает агликон сеннидин В и две молекулы глюкозы.В растении обнаружены также антрапроизводные — реин, алоэ-эмодин. Кроме того, найдены флавоновые гликозиды: изорамнетин, кемпферол, кемпферин. Выделены также органические кислоты (линолевая, стеариновая, пальмитиновая и др.), фитостерин, фитостеролин, следы алкалоидов, полисахариды. В кассии узколистной, помимо, указанных веществ, обнаружен мерициловый спирт. Содержание антрагликозидов в листьях кассии узколистной достигает 3,77 %, в плодах — 4,6%. Согласно нормативной документации для листа сенны содержание суммы агликонов антраценового ряда в пересчете на хризофановую кислоту должно быть не менее 1,35 %, для плодов — не менее 1,5 %.
Экспериментальная часть.
Качественное определение антрахинонов.
1. 0,2 г измельченного сырья кипятили в течение 2 мин с 5 мл 10 % едкого натра. После остывания смесь разбавляли 5 мл воды и фильтровали.
2. 3 мл фильтрата поместили в делительную воронку и добавили 3 мл 10 % соляной кислоты и 10 мл хлороформа.
3. Осторожно перемешали и после расслоения жидкости слили хлороформный слой, фильтруя его через небольшой комочек ваты.
4. Фильтрат встряхивали с 10 мл 10 % раствора аммиака и наблюдали появившееся окрашивание.
При наличии 1, 8-диоксиантрахинонов аммиачный слой принимает вишнево-красное окрашивание, 1, 4-диоксиантрахинонов — пурпурное окрашивание, 1, 2-диоксиантрахинонов — фиолетовое окрашивание.
Сущность реакции заключается в следующем: при кипячении растительного материала со щелочью происходит гидролиз антрагликозидов с образованием свободных агликонов. Одновременно антрон- и антранолпроизводные окисляются до антрахинонов. Образовавшиеся оксиантрахиноны за счет фенольных гидроксилов дают феноляты (антрахиноляты), растворимые в воде. При подкислении водно-щелочного раствора диссоциация фенольных гидроксилов подавляется, и соединения становятся липофильными, в результате чего при встряхивании с хлороформом они из водного слоя переходят в хлороформный, хлороформный слой при этом принимает желтую окраску оксиантрахинонов. При встряхивании хлороформного слоя с раствором аммиака вновь происходит образование фенолятов окрашивающих аммиачный слой.
Сублимация антраценпроизводных.
1. Поместили на дно сухой пробирки небольшое количество измельченного сырья и, осторожно, нагревали, держа пробирку почти горизонтально. Сублимат конденсировался на холодных участках пробирки в виде желтых капель или желтых игольчатых кристаллов.
2. После остывания пробирки к сублимату прибавили 1 каплю 5 % NaOH в этиловом спирте; появилось яркое красное окрашивание.
Сущность реакции: содержащиеся в растительном материале антрагликозиды при высокой температуре расщепляются с образованием свободных агликонов; одновременно производные антрона и антронолаокисляются до антрахинонов, которые возгоняются. При добавлении щелочи образуются окрашенные феноляты:

Хроматографическое определение антраценпроизводных в растительном сырье.
1. 0,3 г измельченного растительного сырья нагрели с 3 мл этилового спирта в течение 5 мин, доводя до слабого кипения. После остывания фильтровали.
2. 0,1 мл извлечения наносили на линию старта и хроматографировали в системе «этилацетат: метиловый спирт: вода», взятых в соотношениях 100:17:13, на пластинках «Силуфол». Одновременно хроматографировали стандарт «свидетель», нанося его раствор рядом с исследуемым извлечением.
3. После окончания хроматографирования пластинку вынимали из камеры, отмечают линию финиша пробега растворителя, высушивают и просматривают в видимом и УФ свете до и после проявления парами аммиака или 5 % NaOH в этиловом спирте.
Количественное определение.
Метод основан способности окрашенных фенолятов поглощать свет при длине волны 530—540 нм.
Аналитическую пробу сырья измельчали до размера частиц, проходящих сквозь сито с отверстиями размером 1 мм. Около 0,05 г (точная навеска) измельченного сырья помещали в колбу вместимостью 100 мл, прибавляли 7,5 мл ледяной уксусной кислоты и смесь нагревали на кипящей водяной бане с обратным холодильником в течение 15 мин. После охлаждения в колбу добавляли через холодильник 30 мл эфира и кипятили на водяной бане 15 мин. Затем извлекали, охлаждали, фильтровали через вату в делительную воронку вместимостью 300 мл и вату промывали 20 мл эфира. Вату перенесли обратно в колбу, прибавили 30 мл эфира и кипятили 10 мин. Охлажденное эфирное извлечение фильтровали через вату в ту же делительную воронку. Колбу дважды споласкивали эфиром (по 10 мл) и фильтровали через ту же вату. К объединенным извлечениям осторожно, по стенкам прибавляли 100 мл щелочно-аммиачного раствора и осторожно взбалтывали 57 мин, охлаждая воронку под струёй холодной воды. После полного расслоения прозрачный красный нижний слой, не фильтруя, сливали в мерную колбу вместимостью 250 мл, а эфирный слой обрабатывали порциями по 20 мл щелочно-аммиачного раствора до прекращения окрашивания жидкости, сливали окрашенные растворы в ту же мерную колбу и доводили объем раствора в колбе щелочно-аммиачным раствором до метки.
25 мл полученного раствора помещали в колбу и нагревали 15 мин на кипящей водяной бане с обратным холодильником. После охлаждения измеряли оптическую плотность раствора на фотоэлектроколориметре при длине волны около 540 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения щелочно-аммиачный раствор. При получении слишком интенсивной окраски раствор перед колориметрированием разбавляли щелочно-аммиачным раствором.
Концентрацию производных антрацена в колориметрируемом растворе в пересчете на истизин определяли по калибровочному графику.
Содержание производных антрацена в пересчете на истизин в процентах (X) и абсолютно сухое сырье вычисляли по формуле:
C • 250 • 100 • 100
m • (100 - W)
где С — содержание производных антрацена в пересчете на истизин в 1 мл колориметрируемого раствора, найденное по калибровочному графику, в граммах; m — масса сырья в граммах; W — потеря в массе при высушивании сырья в процентах.
Построение калибровочного графика. 50 г кобальта хлорида (CoCl2 • 6H2O), высушенного до постоянной массы, помещали в мерную колбу вместимостью 500 мл, растворяли в 250 мл воды, прибавляли 1 мл хлористоводородной кислоты и доводили объем раствора водой до метки. Из этого раствора готовили серию разбавленных растворов (№№ 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12), содержащих кобальта хлорида соответственно 0,0025; 0,0050; 0,0075; 0,0100; 0,0125; 0,0150; 0,0175; 0,0200; 0,0225; 0,0250; 0,0275; 0,0300 г в 1 мл, и измеряли их оптические плотности на фотоэлектроколориметре при длине волны около 530 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения воду. Для построения калибровочного графика по оси абсцисс откладывали концентрацию растворов, а по оси ординат — их оптическую плотность. При этом концентрации растворов кобальта хлорида выражали в соответствующих концентрациях производных антрацена (в пересчете на истизин), пользуясь таблицей 1.
Таблица 1.
|
№ п/п |
Содержание кобальта хлорида (CoCl2 • 6H2O), г/мл |
Содержание производных антрацена в пересчете на истизин, г/мл |
№ п/п |
Содержание кобальта хлорида (CoCl2 • 6H2O), г/мл |
Содержание производных антрацена в пересчете на истизин, г/мл |
|
1 |
0,0025 |
0,0000009 |
7 |
0,0175 |
0,0000063 |
|
2 |
0,0050 |
0,0000018 |
8 |
0,0200 |
0,0000072 |
|
3 |
0,0075 |
0,0000027 |
9 |
0,0225 |
0,0000081 |
|
4 |
0,0100 |
0,0000036 |
10 |
0,0250 |
0,0000090 |
|
5 |
0,0125 |
0,0000045 |
11 |
0,0275 |
0,0000099 |
|
6 |
0,0150 |
0,0000054 |
12 |
0,0300 |
0,0000108 |
Результаты исследования.
Обнаружено, что содержание антраценпроизводных в составекоры крушины, произведенной ОАО «Красногорсксредства», составляет 10,05 % в пересчете на сухое сырье. Данный показатель удовлетворяет требованиям, предъявляемыми нормативными документами.
Установлено, что содержание антраценпроизводных в листьях сены ЗАО «Здоровье» ниже нормы и составляет 2,38 %, что характеризует данное сырье как неудовлетворительное.
Список литературы:
1.Муравьева Д.А., Самылина И.А., Яковлев Г.П. Фармакогнозия: Учебник. 4-е изд., перераб. и доп. — М.: Медицина, 2002. — 656 с.
2.Тихонов В.Н., Калинкина Г.И., Сальникова E.H., Под редакцией профессора Дмитрука С.Е. Лекарственные растения, сырье и фитопрепараты / Учебное пособие. Часть I, II .Томск, 2004. — 116 с, 148 с.
3.Копейка В.И. Семейный справочник лекарственных растений. — Донецк: ООО «ПКФ «БАО», 2009. — 224 с.
дипломов

Оставить комментарий