Статья опубликована в рамках: I Международной научно-практической конференции ««Проба пера» ЕСТЕСТВЕННЫЕ И МАТЕМАТИЧЕСКИЕ НАУКИ» (Россия, г. Новосибирск, 25 октября 2012 г.)
Наука: Химия
- Условия публикаций
- Все статьи конференции
дипломов
СИНТЕЗ И ФУНКЦИОНАЛИЗАЦИЯ ПРОИЗВОДНЫХ АНТРА[2,1-b]БЕНЗО[d]ТИОФЕН-8,13-ДИОНОВ
Буйко Евгений
класс 11 «Г», МБОУ «Гимназия № 9», г. Красноярск
Лыкова Елена Викторовна
научный руководитель, педагог высшей категории, преподаватель химии, МБОУ «Гимназия № 9», г. Красноярск
Гетероциклические производные 9, 10-антрахинона, конденсированные по положениям 1, 2 с тиофеновым циклом, природного и синтетического происхождения перспективны для практического использования в качестве противоопухолевых препаратов [2, 3].
Цель научной работы: Синтезировать соединения антрахинонового ряда и исследовать их на биологическую активность. Провести предварительное тестирование соединений на культуре клеток рака толстой кишки HCT116 на биологическую активность.
Также следует отметить, что способы получения данных веществ достаточно малочисленны
Нами разработан способ получения 7-гидроксиантра [2, 1-b] бензо[d]тиофен-8,13-дионов на основе более легкодоступных [4] реагентов. Интерес именно к этим веществам обусловлен еще и тем, что наличие гидроксильной группы в производных антрахинона обычно повышает их биологическую активность.
Красители, пигменты, люминофоры, аналитические реагенты, катализаторы и ингибиторы химических реакций, сенсибилизаторы фотохимических реакций, биологически активные и лекарственные препараты — таковы основные направления применения антрахинонов.
Во второй половине ХХ века резко возрос интерес к биологически активным хинонам и хиноидным соединениям. Это было связано с обнаружением противоопухолевой активности как у природных хинонов, так и у ряда синтетических производных сравнительно простого строения, а также с успешным внедрением некоторых из них в медицинскую практику. Позже были выявлены и другие виды физиологической активности хиноидных соединений, в том числе антибактериальная, противовирусная, фунгицидная, обнаружены радиосенсибилизирующие свойства. Найдены новые классы антибиотиков и биоактивных пигментов. Интерес возник к выявлению зависимости биологической активности хиноидных соединений от их строения и синтеза.
Задачи:
1. Получить соединения антрахинонового ряда и провести их фукционализацию;
2. Очистить методом перекристаллизации и с помощью хроматографии;
3. Провести тестирование их на биологическую активность.
В работах В.М. Потапова отмечается, что хроматография — это целая группа физико-химических методов разделения. В настоящее время эти методы приобрели большое значение во всех областях химии.
Хроматография на колонках, заполненных адсорбентом (неподвижная фаза), с использованием безводных растворителей в качестве подвижной фазы основана на адсорбционном принципе. Хроматографирование проводили в колонках из стекла. Разделение смесей происходило в результате обратимой адсорбции на неподвижной фазе с последующим элюированием при помощи растворителя (подвижной фазы). В качестве адсорбента использовали силикагель, который имел большую поверхность, обладал химической инертностью по отношению в подвижной фазе и разделяемым веществам. Мелко раздробленный силикагель помешали в колонку равномерно и без пузырьков воздуха. Затем осторожно вливали раствор разделяемой смеси. Когда разделяемая смесь почти вся впиталась в колонку, наливали элюент, в качестве которого использовали толуол, добавляя новые его порции до тех пор, пока не произошло разделение смеси на компоненты в ясно видимых зонах. Эти компоненты собирали отдельно на выходе из колонки.
Перекристаллизация — метод очистки вещества, основанный на различии растворимости вещества в растворителе при различных температурах (обычно интервал температур от комнатной до температуры кипения растворителя, если растворитель — вода, или до какой-то более высокой температуры).
При помощи данных методов мы провели очистку веществ от примесей.
Исследование антипролиферативной активности веществ на культуре клеток аденнокарциномы кишки человека HCT116.
Клетки HCT-116 рассевали на 96-луночные планшеты (Costar, США) (5—10х103 клеток в 190 мкл культурной среды). В лунки вносили соответствующие антратиофендионы до конечных концентраций 100 н М-50 мкМ или соответствующие количества растворителя (вода-ДМСО; контроль). Объем вносимых веществ не превышал 5 % объема среды в лунках. Каждую концентрацию препаратов изучали в 2—3 проворностях. Культуры инкубировали при 37 0С, 5 % СО2 до 72 часов. По окончании инкубации в лунки вносили 20 мкл 0,5 % водного раствора МТТ (Сигма), и планшеты помещали в СО2-инкубатор на 2 часа. О жизнеспособности клеток судили по цветной реакции, развивающейся при восстановлении МТТ в формазан дегидрогеназами метохондрий (МТТ-тест). Окраску регистрировали на спектрофотометре при длине волны возбуждения 540 нм. Оптическую плотность в лунках, где клетки инкубировались только с растворителем (контроль), принимали за 100 %. Показатели оптической плотности в лунках с каждой концентрацией испытуемых препаратов усредняли и вычисляли процент выживших клеток при той или иной концентрации исследуемого токсина.
Экспериментальная часть
Нами изучено поведение продуктов диазотирования 1-амино-2-арилтио-9, 10-антрахинонов. Обнаружено, что независимо от условий диазотирования 1-амино-2-арилтио-9, 10-антрахиноны 1a-c при нагревании элиминируют азот с образованием антра [2, 1-b] бензо [d] тиофендионов 4a-c. В некоторых случаях в качестве побочных веществ получаются продукты замещения диазогруппы водородом 5a-c, что подтверждено нами на примере превращения вещества 1a.
По-видимому образование соответствующих тиофендионов может протекать не только с участием диазосоединений 2a-c, но и хинондиазидов 3a-c:

Схема 1
Мы изучили возможности модификации веществ 4a-c путем замещения гидроксильной группы аминами. Продукт бензолсульфонилирования — 8,13-диоксо-8,13-дигидроантра [2,1-b] бензо [d] тиофен-7-бензолсульфонат при ведении в реакцию с аминами превращается не только в продукт замещения 9a-c, но и исходный антра [2,1-b] бензо [d] тиофендион 4a-c.
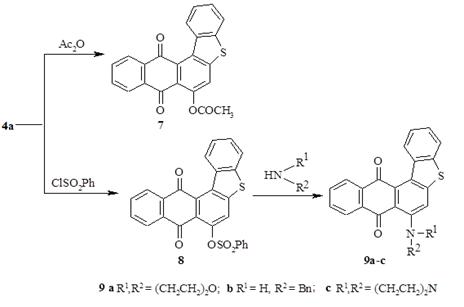
Схема 2
Строение всех исследуемых продуктов подтверждено физико-химическими методами.
Спектры ЯМР 1Н получены на спектрометре Bruker DRX-500 (500 МГц), растворитель — ДМСО-d6, внутренний стандарт — ТМС. Контроль за ходом реакции и индивидуальностью полученных соединений осуществляли с помощью ТСХ на пластинах Silufol UV-254.
Исходные 1-амино-2-арилтио-9,10-антрахиноны получены известными методами [1].
7-Гидроксиантра [2,1-b] бензо [d] тиофен-8, 13-диона (4a).
а) К смеси 1 г (3 ммоль) амина 1a в 5 мл ДМСО при перемешивании добавляют 2 мл изопропилнитрита при 20 0С, выдерживают 30 мин и нагревают до 90 0С в течение 30—60 мин. После охлаждения осадок отфильтровывают, промывают этанолом, высушивают, хроматографируют на колонке с силикагелем, элюент-толуол. Получают соединения 4a. Выход продукта 0,64 г (68 %), т. пл. 233—234 0С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д. (J, Гц): 7,44 (1H, т, J = 7, H-2); 7,53 (1H, т, J = 7, H-3); 7,94 (1H, д, J = 8, H-10,11); 7,97 (1H, д, J = 8, H-10,11); 8,00 (1H, уш. д, J = 7, H-4); 8,02 (1H, с, H-6); 8,20 (1H, д. д, J = 8, H-9,12); 8.22 (1H, д. д, J = 8, H-9,12); 8,76 (1H, уш. д, J = 7, H-1); 13.0 (1H, с, OH). %). Найдено, %: C 72,51; H 2,87; S 9,10. C20H10O3S. Вычислено, %: C 72,72; H 3,03; S 9,69.
б) К смеси 1 г (3 ммоль) амина 1a в 8 мл AcOH при перемешивании в течение 1 ч добавляют 3 мл нитрозилсерной кислоты. Затем реакционную массу нагревают до 90 °C в течение 1 часа. После охлаждения осадок отфильтровывают, промывают этанолом, высушивают, хроматографируют на колонке с силикагелем, элюент-толуол. Выход продукта 4a 0,54 г (55 %).
Побочный продукт реакций — 1-гидрокси-3-фенилтио-9,10-антрахинон 5a выделяют после диазотирования амина в ДМСО, отделением вещества 4a фильтрованием, разбавлением фильтрата водой и хроматографированием выпавшего осадка. Выход продукта 5a 0,20 г (21 %) т. пл. 137 0С.
Соединения 2b-с получают аналогично.
8,13-Диоксо-8,13-дигидроантра [2,1-b] бензо [d] тиофен-7-ацетат (7).
К 1 г (3 ммоль) соединения 1a прибавляют 10 мл уксусного ангидрида и 0,1 г конц. H2SO4, перемешивают при 20 0С в течение 2 ч. Реакционную массу выливают на лед, выпавший осадок отфильтровывают, высушивают. Выход 0,91г (81 %), т. пл. 199 0С Спектр ЯМР 1H (ДМСО-d6), δ, м. д. (J, Гц):2.44 (3H, с, CH3), 7,49—7,52 (1H, т, J = 8, H-2), 7,58—7,61 (1H, т, J = 8, H-3), 7,88—7,94 (2H, м, H-10,11), 8,06—8,10 (2H, т, J = 8, H-9,12), 8,20—8,23 (1H, д, J = 8, H-4), 8,27 (1H, с, H-6), 8,76 (1H, д, J = 8, H-1). Найдено, %: C 70.90; H 3,23; S 8,50. C22H12O4S. Вычислено, %: C 70,96; H 3,22; S 8,60.
8,13-Диоксо-8,13-дигидроантра [2,1-b] бензо [d] тиофен-7-бензолсульфонат (8).
К раствору 0,16 г (0,5 ммоль) соединения 1a в 3 мл пиридина прибавляют 4 мл БСХ при 20 0С, перемешивают при 90 0С в течение 4 ч. После охлаждения реакционную массу выливают на лед. Выпавший осадок отфильтровывают, промывают этанолом, высушивают. Выход 0,16 г (76 %), т. пл. 209—210 0С (из толуола).
7-Бензиламиноантра [2,1-b] бензо [d] тиофен-8,13-дион (9a).
К смеси 0,1 ммоль соединения 8 в 3 мл ДМФА добавляют 0,3 ммоль амина при 20 0С, перемешивают при 90—100 0С в течение 40—60 мин. После охлаждения осадок отфильтровывают, промывают этанолом, высушивают, хроматографируют на колонке с силикагелем, элюент – толуол или бензол. Выход 0,03 г (79 %), т. пл. 233—234 0С (из толуола). Найдено, %: C 77.25; H 4.02; S 7.57; N 3.33. C27H17O2SN. Вычислено, %: C 77.32; H 4.05; S 7.63; N 3.34.
Выводы
1.Синтезировали и изучили функционализацию антра [2,1-b] бензо [d] тиофен-8,13-дионов. В ходе исследования мы установили, что 7-гидроксиантратиофендион вступает в реакцию с бензилсульфохлоридом с образованием сульфоэфира.
2.При взаимодействии сульфоэфира с различными аминами объектом нуклеофильной атаки является атом углерода карбоцикла, а не атом серы.
3.В ходе исследования получено 10 новых веществ, строение которых подтверждено физико-химическими методами анализа.
4.Было проведено предварительное тестирование соединений на культуре клеток рака толстой кишки HCT116. Некоторые показали вполне приличную активность, но есть проблемы с растворимостью, поэтому нужно добиваться растворимости в воде введением гидрофильных заместителей в полученные соединения.
Работа была выполнена на базе КГПУ им. В.П. Астафьева.
Список литературы:
1.Клименко Л.С., Майнагашев И.Я., Е.П. Фокин, Изв. АН, Сер. Хим., № 3, 582 (1992).
2.Файн В.Я., 9, 10-Антрахиноны и их применение, Центр фотохимии РАН, Москва, 1999, с. 92.
3.Шварцберг М.С, Барабанов И.И., Феденок Л.Г., Успехи химии, 73, 171 (2004).
4.Saunders K.H., Allen R.L.M. Aromatic Diazo Compounds. — Arnold. London, 1985, p 615—765.
дипломов

Оставить комментарий