Статья опубликована в рамках: XXXIX Международной научно-практической конференции «Технические науки - от теории к практике» (Россия, г. Новосибирск, 22 октября 2014 г.)
Наука: Технические науки
Секция: Химическая техника и технология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ТЕРМОДИНАМИЧЕСКИЕ ИССЛЕДОВАНИЯ ПОЛУЧЕНИЯ ГЕКСАМЕТИЛЕНТЕТРАМИНА ИЗ АММОНИЙНЫХ СОЛЕЙ МИНЕРАЛЬНЫХ КИСЛОТ
Жуманиязов Максуд Жаббиевич
д-р техн. наук, профессор, Ургенчский государственный университет, Республика Узбекистан, г. Ургенч
E-mail:
Курамбаев Шерзод Раимберганович
канд. техн. наук, доцент, Ургенчский государственный университет, Республика Узбекистан, г. Ургенч
E-mail:
Жуманиязова Дилноза Максудовна
ассистент кафедры общей химии, Ургенчский государственный университет, Республика Узбекистан, г. Ургенч
E-mail:
THERMODYNAMIC INVESTIGATIONS OF HEXAMETHYLENETETRAMINE PRODUCING FROM AMMONIUM SALTS OF MINERAL ACIDS
Jumaniyazov Maksud
doctor of technical sciences, prof., Urgench State University, Republic of Uzbekistan, Urgench
Kurambaev Sherzod
candidate of technical sciences, docent, Urgench State University, Republic of Uzbekistan, Urgench
Jumaniyazova Dilnoza
assistant, Urgench State University, Republic of Uzbekistan, Urgench
АННОТАЦИЯ
В статье приводится результаты термодинамических исследований синтеза гексаметилентетрамина из различных солей аммония, имеющихся в достаточно больших объемах, в частности, в отходах производства кальцинированной соды и капролактама.
ABSTRACT
The results of thermodynamic investigations of hexamethylenetetramine synthesis from various salts of ammonium which are available in rather large volumes, in particular, in production wastes of the calcinated soda and a caprolactam, are given in the article.
Ключевые слова: гексаметилентетрамин; термодинамика; равновесная реакция; конденсация; константы равновесия; свободная энергия; тепловой эффект; энтропия.
Keywords: hexamethylenetetramine; thermodynamics; equilibrium reaction; condensation; balance constants; free energy; thermal effect; entropy.
Гексаметилентетрамин (ГМТА) обладает всеми характерными свойствами третичного амина, образует бесчисленное количество солей, продуктов присоединения и различного рода комплексов, в которых атомы углерода и азота равноценны между собой, что позволяет объяснить поведение ГМТА как одноосновного амина.

Чистый ГМТА представляет собой бесцветное, не имеющее запаха кристаллическое вещество со сладковатым привкусом. Хорошо кристаллизуется в форме ромбических додекаэдров, обладающих пьезоэлектрическими свойствами. При охлаждении насыщенного водного раствора кристаллизуется в виде гексагидрата гексаметилентетрамина — (СН2)6N4 · 6H2O, устойчивого до 13,5 °C.
В связи с этим для получения ГМТА в больших количествах возникает задача изыскания более рационального способа его получения. Одним из таких вариантов является синтез ГМТА из различных солей аммония, имеющихся в достаточно больших объемах, в частности, в отходах производства кальцинированной соды и капролактама.
Снижение себестоимости ГМТА за счёт использования вместо свободного аммиака различных отходов в виде аммонийных солей (NH4Cl — побочный продукт содового производства, (NH4)2SO4 — отход производства капролактама) открывает новые возможности применения ГМТА, получения разнообразных материалов с его участием.
В традиционных проектах содовых заводов предусматривается регенерация аммиака из хлористого аммония. Именно этот приём порождает многотоннажные отходы дистиллерной жидкости. Предложенная нами переработка фильтровой жидкости в гексаметилентетрамин и HCl решает проблему ликвидации отходов, так называемых «белых морей».
В основе процесса лежит реакция взаимодействия формальдегида и хлористого аммония. Учитывая обратимый характер этой реакции и для выявления оптимальных условий и параметров, обеспечивающих высокий выход целевого продукта, нами изучена термодинамика равновесных реакций конденсации.
С целью термодинамического анализа вероятности протекания реакций конденсации аммонийных солей минеральных кислот и их общей характеристики мы провели расчеты констант равновесии lgKp, изменений свободной энергии Гиббса ΔG, тепловых эффектов и энтропии систем, образованных исходными и конечными продуктами реакции.
Важнейшей характеристикой состояния обратимых реакций являются константы их равновесия. Для определения константы равновесия используем следующее уравнение [1]:
![]() (3.1)
(3.1)
из которого следует:
 (3.2)
(3.2)
Здесь: ΔG — истинная мера сродства.
Различие между истинной мерой сродства ΔG и мерой сродства по Бертело Δ Н выражается уравнением:
![]() или
или![]() (3.3)
(3.3)
где Δ Н — тепловой эффект реакции.
По закону Гесса тепловой эффект реакции равен алгебраической сумме теплот образования реагентов из простых веществ, также сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ:
![]() (3.4)
(3.4)
или:
![]() (3.5)
(3.5)
Здесь: ![]() — тепловой эффект реакции;
— тепловой эффект реакции;
![]() — сумма теплот образования конечных продуктов;
— сумма теплот образования конечных продуктов;
![]() — сумма теплот образования исходных продуктов.
— сумма теплот образования исходных продуктов.
Зависимость теплового эффекта от температуры находим по уравнению:
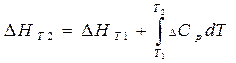 (3.6)
(3.6)
Известные термодинамические величины взяты из справочной литературы [2] и приведены в табл. 3.1.
Для определения принципиальной возможности получения ГМТА путем конденсации аммонийных солей формальдегидом мы провели расчет термодинамических параметров следующих обратимых реакций:
2 (NH4)2SO4 + 6CH2O D (CH2)6N4 + 2H2SO4 + 6H2O (3.7)
2 (NH4)2HPO + 6CH2O D (CH2)6N4 + 2H3PO4 + 6H2O (3.8)
4 NH4H2PO4 + 6CH2O D (CH2)6N4 + 4H3PO4 + 6H2O (3.9)
4 NH4Cl + 6CH2O D (CH2)6N4 + 4HCl + 6H2O (3.10)
4 NH4NO3 + 6CH2O D (CH2)6N4 + 4HNO3 + 6H2O (3.11)
Таблица 1.
Термодинамические характеристики веществ
|
Наименование вещества |
ΔН, кДж/моль |
ΔS, Дж/моль.град |
|
(NH4)2SO4 CH2O (CH2)6N4 H2SO4 H2O NH4H2PO4 (NH4)2HPO4 NH4Cl HCl NH4NO3 HNO3 H3PO4 |
- 1175,0672 - 115,97436 - 136,90836 -909,87537 -286,02082 -1432,0949 -1559,583 -299,85861 -167,27103 -342,60584 -207,4978 -1289,1994 |
245,34648 218,80216 226,2128 20,09664 70,1289 203,89716 193,43016 169,98408 56,5218 260,00028 146,538 158,26104 |
I. Тепловые эффекты для каждой реакции мы нашли по уравнению (3.5):
· для реакции 3.7 :
![]() - 136,90836 + 2(-909,87537)+6(-286,02082)-2(-1175,0672)-6(-115,97436)=-626,8034 Дж/моль;
- 136,90836 + 2(-909,87537)+6(-286,02082)-2(-1175,0672)-6(-115,97436)=-626,8034 Дж/моль;
· для реакции 3.8 :
![]() - 36,90836 +
- 36,90836 +
+2(-1289,1994)+6-(-286,02082)-2(-1559,583)-6(-115,97436) = - 616,4199 кДж/моль;
· для реакции 3.9 :
![]() -136,90836+
-136,90836+
4(-1289,1994)+6 (-286,02082)-4(-1432,0949) - 6(-115,97436) =-585,6051 кДж/моль;
· для реакции 3.10 :
![]() - 136,90836 + +4(-167,27103)+6(-286,02082)-4(-299,85861)-6(-115.97436) = -626,8368 кДж/моль;
- 136,90836 + +4(-167,27103)+6(-286,02082)-4(-299,85861)-6(-115.97436) = -626,8368 кДж/моль;
· для реакции 3.11:
![]() - 136,90836 + +4(-207,4978)+6(-286,02082)-4(-342,60584)-6(-115,97436)=-616,755 кДж/моль
- 136,90836 + +4(-207,4978)+6(-286,02082)-4(-342,60584)-6(-115,97436)=-616,755 кДж/моль
II. Провели расчеты изменения энтропии каждой реакции. Изменение энтропии реакции выражается по уравнению:
Δ S = ∑ S rjy - ∑ S bc[ (3/12)
· для реакции 3.7:
![]() 226,2128+2·20,09664 + +6.70,1289-2·24,34648-6·218,80216 = -1137,386 Дж/моль·град).
226,2128+2·20,09664 + +6.70,1289-2·24,34648-6·218,80216 = -1137,386 Дж/моль·град).
· для реакции 3.8:
![]() 226,2128+2 · 158,26104 + +6·70,1289-2 ·193,43016-6·218,80216 = -736,165 Дж/(моль·град).
226,2128+2 · 158,26104 + +6·70,1289-2 ·193,43016-6·218,80216 = -736,165 Дж/(моль·град).
· для реакции 3.9:
![]() 226,2128+4·158,26104 +
226,2128+4·158,26104 +
6 · 70,1289-4·203,89716-6·218,80216 = -848,3712 Дж/(моль·град).
· для реакции 3.10:
![]() 226,2128+4·56,5218+
226,2128+4·56,5218+
+6·70,1289-4·169,96408-6 ·218,80216 = - 1119,6759 Дж/(моль·град).
· для реакции 3.11:
![]() 26,212814-146,538+
26,212814-146,538+
+6·70,1289-4 · 260,00028-6·218,80216 = -1119,6758 Дж/(моль·град).
III. Изменение изобарно-изотермического потенциала мы рассчитали по формуле 3.3.
Для реакции 3.7:
ΔG = -626803,4 - 298(-1137.386) = - 287862,38 Дж/моль. Соответственно Кр системы по уравнению 3.2 будет равно:
-287862,38
lg Кр = - —––––————— = 50,44792; Кр = 2,8 · 1069
8,31441 · 298-2,303
Для реакции 3.8:
ΔG = - 616419,9 - 298(-736,165) = -397042,73 Дж/моль
-397042,72
lg Кр = ———————— = 69,5818 Кр = 3,82 · 1069
8,31441 · 298-2,303
Для реакции 3.9:
ΔG = - 585605,1 - 298(-848,3712) = -332790,49 Дж/моль
- 332790,49
lg Кр = ———————— = 58,3215 Кр = 2,096 · 1058
8,31441 · 298-2,303
Для реакции 3.10:
ΔG = - 626836,8 – 298 · (-1119,6759)= - 293173,39 Дж/моль
293173,39
lg Кр = ———————— = 51,3786; Кр = 2,391 · 1051
8,31441 · 298 · 2,303
Для реакции 3.11:
ΔG = 616755 - 298(-1119,6758) = - 283091,61 Дж/моль
283091,61
lg Кр = ———————— = 49, 6118 Кр= 4,091 · 1049
8,31441 · 298 · 2,303
Таким образом, получены термодинамические параметры изменения энтропии, тепловых эффектов и изменения свободной энергии Гиббса реакций конденсации аммонийных солей серной, фосфорной, хлористоводородной и азотной кислот.
Отрицательные значения изобарно-изотермического потенциала рассмотренных реакций показывают вероятность их протекания в направлении образования ГМТА и соответствующих кислот. Наибольшее значение Кр имеет реакция конденсации:
![]()
В то же время относительно небольшие абсолютные значения этих потенциалов указывают на возможность их протекания и в обратных направлениях, что обуславливает установление определенного равновесия между исходными и конечными продуктами и обратимый характер реакций взаимодействия их компонентов [3].
Список литературы:
1.Карапетьянц М.Х. Примеры задач по химической термодинамике. М.: Химия, 1984. — С. 211.
2.Карапетьянц М.Х., Карапетьянц М.Л. Основные термодинамические константы неорганических и органических веществ-М.: Химия, 1968. — 470 с.
3.Жуманиязов М.Ж., Тиллабаева Д., Бабаев З.К. Органик ўғит –уротропин чиқиндисиз сода ишлаб чиқаришдаги истиқболли йўналишдир. //Научно-практ. конф. УрГУ: Тез.докл. Урганч, 1998. — С. 74.
дипломов


Оставить комментарий