Статья опубликована в рамках: XXIX Международной научно-практической конференции «Технические науки - от теории к практике» (Россия, г. Новосибирск, 25 декабря 2013 г.)
Наука: Технические науки
Секция: Безопасность жизнедеятельности человека, промышленная безопасность, охрана труда и экология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
РАСЧЁТ КОНЦЕНТРАЦИЙ ВТОРИЧНЫХ ЗАРЯЗНИТЕЛЕЙ В АТМОСФЕРЕ НА ПРИМЕРЕ СОЕДИНЕНИЙ АЗОТА И СЕРЫ
Чернявский Сергей Анатольевич
аспирант НИУ МИЭТ, РФ, г. Зеленоград
E-mail: spin204@yandex.ru
Каракеян Валерий Иванович
д-р техн. наук, профессор, НИУ МИЭТ, РФ, г. Зеленоград
E-mail: zelikar@mail.ru
CALCULATIONOFTHECONCENTRATIONSSECONDARY POLUTANTS IN THE ATMOSPHERE ON THE EXAMPLE NITROGEN AND SULFUR COMPOUNDS
Chernyavskiy Sergey
postgraduate, National Research University of Electronic Technology, Russia Zelenograd
ValeriyKarakeyan
doctor of Engineering Science, National Research University of Electronic Technology, Russia Zelenograd
АННОТАЦИЯ
В статье разобраны численные методы экспериментального вычисления концентраций вторичных загрязнителей атмосферного воздуха. В работе исследуются химические соединения, в состав которых входят азоти сера.
На основе полученных вычислений можно будет сделать вывод о том, насколько большие концентрации вторичных загрязнителей могут присутствовать в атмосфере, и стоит ли на них обращать большое внимание при мониторинге атмосферного воздуха.
ABSTRACT
Article dismantled numerical methods of experimental calculations the concentrations secondary air pollutants. In this paper we study the chemical compounds, which include nitrogen and sulphur.
On the basis of the received calculations we can draw a conclusion about how large concentration of secondary pollutants may be present in the atmosphere, and whether they pay great attention to the monitoring of atmospheric air.
Ключевые слова: первичные загрязнители; вторичные загрязнители; константа равновесия.
Keywords: primary pollutants; secondary pollutants; equilibrium constant.
Численный расчёт химических соединений в атмосфере является одной из самых трудоёмких задач современной экологии. На сегодняшний день существует достаточно мало технических средств, которые бы улавливали подобные вещества и показывали их концентрацию. Также из-за погодных условий, солнечного света и направления ветра сложно определить, произойдёт ли химическая трансформация или нет.
Рассмотрим химическую реакциюaA + bB → dD + eE. Для такой реакции установлено, что независимо от того, каковы были начальные концентрации реагентов, присутствовали или нет продукты реакции, в состоянии равновесия сохраняется постоянным соотношение [1]:
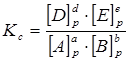 ,
,
где: [A]p, [B]p, [D]p, [E]p — равновесные молярные концентрации реагентов и продуктов реакции;
a, b, d, e — стехиометрические коэффициенты в уравнении реакции;
Kc — константа химического равновесия.
Для равновесий между газообразными веществами удобнее пользоваться парциальными давлениями газообразных веществ
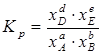 , (1)
, (1)
![]() — константа химического равновесия;
— константа химического равновесия;
![]() ,
, ![]() ,
, ![]() ,
, ![]() — мольные доли.
— мольные доли.
Константа равновесия, выраженная через концентрации, и константа равновесия, выраженная через мольные доли веществ, связаны соотношением
![]() ,
,
где: R=8,314 Дж/(моль·K) — универсальная газовая постоянная;
T — абсолютная температура, К;
∆n — разность коэффициентов при формулах газообразных веществ в правой и левой частях уравнения.
Константа равновесия связана с энергией Гиббса образования вещества соотношением:
![]() , (2)
, (2)
где: ΔG — изменение энергии Гиббса, Дж/моль;
Рассмотрим информацию, полученную в г. Зеленограде со стационарного поста наблюдения№14 ГУП «Мосэкомониторинг», размещённом в 15-ом микрорайоне. Здесь представлены максимальные разовые концентрации основных газов NO, NO2, SO2, O3.
Таблица 1.
Максимальные разовые концентрации первичных загрязнителей г. Зеленограда, полученные на стационарном маршрутном посту
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В таблице представим исследуемые реакции и для каждой реакции вычислим энергию Гиббса.
Таблица 2.
Химические реакции вторичных превращений и их энергия Гиббса
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для реакции (1.1) подробно опишем поиск концентрации вторичного вещества HNO3 [2].
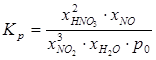 ,
,
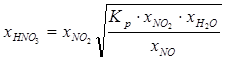 ,
,
![]() ,
, ![]() ,
,![]() ,
,![]() — мольные доли;
— мольные доли;
![]() — давление, равное 1 атм.;
— давление, равное 1 атм.;
Мольные доли рассчитываются по формуле:
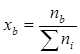 , (3)
, (3)
Где: ![]() — мольная доля вещества b в растворе;
— мольная доля вещества b в растворе;
![]() — количество вещества, содержащееся в растворе (моль);
— количество вещества, содержащееся в растворе (моль);
![]() — количество молей воздуха в 1 м3 при стандартном атмосферном давлении.
— количество молей воздуха в 1 м3 при стандартном атмосферном давлении.
Количество вещества, содержащееся в растворе, рассчитывается по формуле:
 , (4)
, (4)
где: ![]() — концентрация вещества в атмосферном воздухе (г);
— концентрация вещества в атмосферном воздухе (г);
![]() — количество вещества, содержащееся в растворе (г/моль);
— количество вещества, содержащееся в растворе (г/моль);
Произведём вычисления концентрации вторичного загрязнителя HNO3 по формулам (1), (3) и (4).
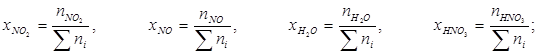
где![]()
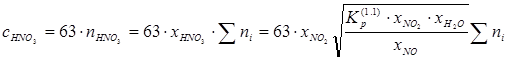
После всех преобразований, с учётом (2), получаем формулу расчёта концентраций частиц HNO3 в воздухе:
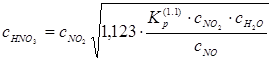
Очевидно, что концентрация вторичного загрязнителя будет зависеть от температуры воздуха. Расчёты для всех реакций, указанных в таблице будем проводить при температуре воздуха T = 298 K.
![]()
 г/м3
г/м3
Подобным образом вычислим концентрации других загрязнителей.
Вычислим концентрацию нитрата аммония в атмосфере, применяя формулы (1)—(4).
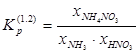
![]()
![]()
![]() г/м3
г/м3
Вычислим концентрацию серного ангидрида в атмосфере, применяя формулы (1)—(4).
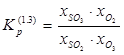
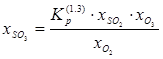
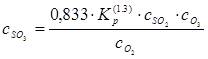
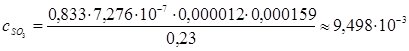 г/м3
г/м3
Вычислим концентрацию частиц аэрозоля серной кислоты в атмосфере, применяя формулы (1)—(4).
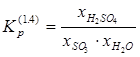
![]()
![]() .
.
![]() г/м3.
г/м3.
Необходимо провести сравнение полученных результатов с ПДКм.р. всех веществ, которые могут образоваться в атмосфере согласно табл. 3.
Таблица 3.
Сравнение концентраций, полученных численно с ПДКм.р.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аналитические расчёты показывают, что при формировании в атмосфере вторичных загрязнителей, их концентрация значительно увеличивается по сравнению с первичными, и значительно превышают ПДКм.р. Это приводит к существенному загрязнению атмосферы и присутствию в ней огромного количества частиц различных аэрозолей, и как следствие, образуется в атмосфере смог.
Список литературы:
1.Буйновкий А.С., Безрукова С.А., Лазарчук В.В. Скорость химических реакций и химическое равновесие:Практические руководство. Северск: Национальный исследовательский ядерный университет МИФИ, 2010. — С. 21—22.
2.Петелин А.Л., Вишнякова К.В., Михалина Е.С. Металлургия техногенного вторичного сырья. Прогноз распространения газовых выбросов: Курс лекций. М.: МИСиС, 2011. — С. 42—43.
дипломов


Оставить комментарий