Статья опубликована в рамках: XIX Международной научно-практической конференции «Технические науки - от теории к практике» (Россия, г. Новосибирск, 20 марта 2013 г.)
Наука: Технические науки
Секция: Приборостроение, метрология, радиотехника
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
АВТОМАТИЗИРОВАННАЯ ОБРАБОТКА МИКРОСКОПИЧЕСКИХ ИЗОБРАЖЕНИЙ В ЗАДАЧАХ НАУЧНОГО ИССЛЕДОВАНИЯ
Скулкина Юлия Сергеевна
аспирант ДВФУ, г. Владивосток
E-mail: sashulya-05@mail.ru
Кравченко Александр Петрович
доцент кафедры приборостоения ДВФУ, г. Владивосток
E-mail: petrovich_krav@mail.ru
AUTOMATED PROCESSING OF MICROSCOPIC IMAGES IN SCIENTIFIC RESEARCH
Yulia Skulkina
Graduate student of FEFU, Vladivostok
Alexander Kravchenko
Associate Professor of FEFU, Vladivostok
АННОТАЦИЯ
Цель работы — разработка методики для анализа медико-биологических препаратов в автоматизированном режиме.
Разрабатываемые средства и методики автоматизированного микроскопического анализа позволяют измерять большую группу морфологических характеристик клеток, разрабатываемый комплекс автоматизированной микроскопии решает ряд задач цитологического анализа. Предложенная и апробированная методика даёт достоверные результаты автоматизированного анализа научных исследований.
ABSTRACT
Purpose — development methods for the analysis of medical and biological preparations in an automated way.
The tools and techniques of automated microscopic analysis can measure the morphological characteristics of a large group of cells, developing a set of automated microscopy solves a number of problems of cytology. Proposed and tested method gives reliable results of the automated analysis of research.
Ключевые слова: автоматизированная микроскопия; цитологические препараты; анализ изображений
Key words: automated microscopy; cytological preparations; image analysis
Применяемая в настоящее время ручная микроскопия требует высокой квалификации врача, часто изнурительна по трудоемкости, связана с высоким напряжением и психологическим дискомфортом. Проточные гемоанализаторы измеряют малое количество диагностических признаков и не позволяют врачу-диагносту участвовать в процессе анализа. Обнаружение и идентификация атипичных клеток при их низкой концентрации недоступны как автоматическим гемоанализаторам, так и ручной микроскопии.
Преодоление указанных недостатков может быть достигнуто прежде всего за счет автоматизации трудоемкого этапа сбора выборки объектов анализа и за счет современных технологий обработки, хранения и передачи изображений. При этом выдвигается жёсткий набор требований к техническим характеристикам алгоритма обнаружения объектов анализа:
1. Высокое быстродействие;
2. Практически полное отсутствие пропусков объектов;
3. Малое число ложных тревог;
4. Обнаружение должно сопровождаться контролем качества мазка и работы самого обнаружения. Необходимо контролировать возможное наличие пропусков и предупреждать об этом [1].
Одной из важнейших задач, возникающих при анализе изображений цитологических препаратов, является задача сегментации изображений. От качества сегментации зависит точность вычисления морфологических признаков микрообъектов, а, следовательно, и точность классификации и диагностики.
Трудность автоматизации сегментации медико-биологических микрообъектов заключается в том, что эти объекты, как и все объекты естественного происхождения, отличаются большим разнообразием строения и большой вариабельностью параметров даже внутри одного класса. Микрообъекты часто соприкасаются, накладываются друг на друга, форма искажается [2]. Поэтому полностью автоматизировать процесс сегментации изображений разнотипных медико-биологических микрообъектов на сегодняшний день затруднительно. Это возможно при анализе препаратов только одного типа микрообъектов с использованием специальной стабильной окраски. Несмотря на значительные усилия, затраченные на разработку способов сегментации цитологических изображений, в настоящее время эта проблема далека от полного решения.
Наиболее ценную информацию для врача-диагноста при постановке диагноза и лечении множества заболеваний представляет дифференциальный подсчёт лейкоцитов. Автоматическое дифференцирование лейкоцитов в микроскопических изображениях обычно состоит из четырех главных этапов: предварительная обработка, сегментация изображения, выделение признаков и классификация (рисунок 1) [4].
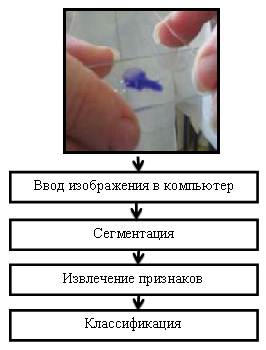
Рисунок 1. Дифференцирование лейкоцитов
Цель сегментации лейкоцитов состоит в том, чтобы отделить лейкоциты от других различных компонентов на изображении крови. Типичное изображение мазка периферической крови состоит из четырех компонентов: фона, красных кровяных клеток (безъядерные клетки), ядерных клеток — лейкоцитов и цитоплазмы. Лейкоциты более темнее, чем фон, эритроциты лежат в промежуточном уровне яркости. Существует довольно много методов сегментации изображений, но все они являются в той или иной степени вариантами двух: порогового преобразования и обнаружения границ. При анализе изображений препаратов крови цвет является одним из главных факторов, на основе которых возможно выделение и классификация элементов, поэтому работу с изображениями необходимо проводить в том цветовом пространстве, которое наиболее соответствует цветовосприятию человека [3]. Система HSV имеет перед другими системами важное преимущество: она больше соответствует природе цвета и хорошо согласуется с моделью восприятия цвета человеком. Поэтому для работы выбрана именно эта модель.
Вычисляются значения HSV по следующим формулам:
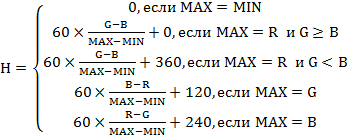 , (1)
, (1)
![]() ,
,
V=MAX
Где: MAX — максимальное значение из R, G и B,
MIN — минимальное из них.
Стадия предварительной обработки включает повышение качества полученного изображения и, по существу, выполняется, чтобы подготовить изображение к важной стадии сегментации. Объекты интереса отделяются от фона в процессе сегментации. При этом важно уделить достаточно внимания данному этапу обработки, так как он него зависит конечный результат диагностирования.

Рисунок 2. Результат сегментации: исходное изображение; сегментированное ядро
Важным этапом в дифференцировании лейкоцитов является вычисление геометрических параметров формы (Площадь, центр масс объекта, эквивалентный диаметр, длина максимальной оси инерции, длина минимальной оси инерции, эксцентриситет эллипса и отношение площади цитоплазмы к площади ядра).
В целях эксперимента мы используем четыре набора признаков F1, F2, F3 и F4 для классификации:
F1 = (площадь, отношение длины максимальной оси инерции к длине минимальной оси инерции, периметр, эксцентриситет эллипса),
F2 = (площадь, эксцентриситет эллипса, эквивалентный диаметр, периметр),
F3 = (площадь, эксцентриситет, эквивалентный диаметр, периметр, отношение областей ядра и цитоплазмы),
F4 = (площадь, отношение длины максимальной оси инерции к длине минимальной оси инерции, периметр, отношение областей ядра и цитоплазмы),
Результаты вычисления минимальных и максимальных значений параметров клеток лейкоцита представлены в таблице 1.
Таблица 1.
|
Типы клеток |
|
Площадь |
Эксцентриситет эллипса |
Эквивалентный диаметр |
Периметр |
Отношение площадей ядра и цитоплазмы |
|
Лимфоциты |
Мин |
724 |
0.321 |
30.35 |
118 |
1.1997 |
|
|
Макс |
1092 |
0.804 |
36.72 |
155 |
1.690 |
|
Базофилы |
Мин |
1076 |
0.5924 |
37.0136 |
154 |
1.754 |
|
|
Макс |
1738 |
0.8408 |
47.0414 |
267 |
1.890 |
|
Эозинофил |
Мин |
774 |
0.7019 |
31.3925 |
125 |
1.1234 |
|
|
Макс |
1057 |
0.8770 |
36.6853 |
167 |
1.5667 |
|
Моноциты |
Мин |
1256 |
0.524 |
30.32 |
167 |
0.8676 |
|
|
Макс |
1756 |
0.926 |
47.28 |
254 |
1.2208 |
|
Нейтрофилы |
Мин |
1098 |
0.51 |
30.01 |
162 |
0.41734 |
|
|
Макс |
1901 |
0.76 |
35.01 |
206 |
1.481 |
Минимальные и максимальные значения геометрических параметров лейкоцитов
Если полученное значение параметра клетки находится в пределах [min, max] для определенного класса лейкоцитов, то клетка принадлежит к этому классу [5—6].
Для демонстрации работы технологии и выбранных признаков были проведены исследования на реальных изображениях. Была получена выборка из 100 фрагментов изображений, содержащих лейкоциты. Априорно был определен тип каждого лейкоцита. Произведено выделение лейкоцитов на изображении и расчет признаков по каждому лейкоциту.
Экспериментальные результаты сравнивались с результатами, полученными вручную. Предложенный метод сегментации дает коэффициент классификации в диапазоне 92 % к 98 % для различных клеток лейкоцита, и наилучшие коэффициенты в диапазоне 98 % к 99 % в случае набора признаков F4. Этот результат может быть улучшен лучшими методами предварительной обработки и наборами признаков. Предложенная и апробированная методика дает достоверные результаты автоматизированного анализа научных исследований.
Области интереса, каждая из которых содержала лейкоциты, были автоматически извлечены из цветных микроскопических изображений. Автоматическая сегментация изображений была успешно выполнена. Было найдено, что методы пороговой обработки способны к автоматическому извлечению полезного набора признаков из областей интереса. Используемые наборы признаков оказались достаточными, чтобы классифицировать лейкоциты, достигая 98%-ой точности классификации.
Список литературы:
1.Медовый В.С. Автоматизированная микроскопия: новый этап точности, информативности и контроля качества медицинских анализов биоматериалов// Здравоохранение России, Выпуск 8. — 2007. — С. 535—537.
2.Мурашов Д.М. Метод автоматизированной сегментации изображений цитологических препаратов на основе модели активного контура// ТРУДЫ МФТИ. — 2009. — Том 1. — № 1. — C. 80—89.
3.Farnoosh S. A Framework for Blood Cell Segmentation in Microscopic Blood Images Using Digital Image Processing // Shulin Li (ed.), Biological Procedures Online. — Volume 11. — № 1. — 2009
4.Nurul H.A. Performance Comparison between Multilayer Perceptron and Fuzzy ARTMAP Networks for Acute Leukemia Detection// International Journal of Research and Reviews in Computer Science (IJRRCS). — Vol. 2. — № 5. — October 2011.
5.Ongun G. Feature extraction and classification of blood cells for an automated differential blood count system // Neural Networks. Proceedings. IJCNN '01. International Joint Conference on vol. 4. — 2001. Р. 2461—2467
6.Pilar G.A Feature Extraction Method Based on Morphological Operators for Automatic Classification of Leukocytes // IEEE Computer Society. — October 2008. Р. 227—232.
дипломов


Оставить комментарий