Статья опубликована в рамках: V Международной научно-практической конференции «Технические науки - от теории к практике» (Россия, г. Новосибирск, 14 ноября 2011 г.)
Наука: Технические науки
Секция: Химическая техника и технология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Исследование механизмов антиоксидантной активности природных полигидрокси-1,4-нафтохинонов с использованием метода функционала плотности
Савченко Вячеслав Георгиевич
Специалист лаборатории функциональных пищевых товаров; Центр исследования качества и безопасности товаров ШЭМ ДВФУ, г. Владивосток
E-mail: savslav@yandex.ru
Бабин Юрий Владимирович
д.х.н., МГУПП, г. Москва
E-mail: buv@list.ru
Антиоксидантные свойства природных полигидрокси-1,4-нафтохинонов (ПГНХ) – хиноидных пигментов морских беспозвоночных, известны достаточно давно. Эхинохром, спинохромы A, C, D и Е эффективно тормозят автоокисление жиров и масел [5], термическое окисление алкилбензолов [1]. Выраженные антиоксидантные свойства полигидрокси-1,4-нафтахинонов (ПГНХ) послужили основой для разработки нового лекарственного препарата "гистохром" (эхинохром А) [4], являющегося в настоящее время одним из самых эффективных антиоксидантов нового поколения. Высокая антиоксидантная активность эхинохрома А и родственных полигидрокси-1,4-нафтохинонов обусловлена их способностью играть роль активных перехватчиков свободных радикалов, в частности супероксид-анион-радикала и пероксильных радикалов [3; 10; 11]. При этом ключевую роль в редокс-превращениях ПГНХ играют b-гидроксильные заместители – во 2, 3 и 7 положениях. Замена этих гидроксилов в эхинохроме А на метокси-группы сводит антиоксидантную активность ПГНХ к нулю [3].
Превентивная роль антиоксиданта в реакциях окисления, связанных с переносом атома водорода, заключается в прерывании окислительной цепочки
R· + O2 ® RO2· (1)
RO2· + RH ® ROOH + R· (2)
за счет перехвата (ингибирования) свободнорадикальной частицы RO2·
RO2· + InOH ® ROOH + InO·. (3)
Слабая О – Н связь в InOH делает реакцию 3 термодинамически более предпочтительной, что повышает эффективность InOH как антиоксиданта. Термохимические свойства О – Н связей в производных фенола, обладающих антирадикальным действием, изучались различными исследовательскими группами с применением широкого круга теоретических и экспериментальных методов, в результате чего были установлены значения энтальпии диссоциации связи (BDE) OH групп, при которых соединение проявляет заметные антиоксидантные свойства. Специфика ПГНХ заключается в наличии в их фенольной части двух групп гидроксильных заместителей, проявляющих совершенно разные антирадикальные свойства (a- и b-гидроксилы), а также в возможном участии хиноидных b-гидроксильных заместителей в реакциях гашения свободных радикалов.
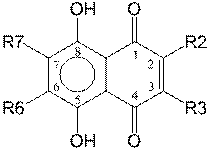
В данной работе теоретически исследована гомолитическая диссоциация О – Н связей b-гидроксильных групп 6-этил-2,3,7-тригидроксинафтазарина (эхинохром A), 2, 3-дигидроксинафтазарина (спиназарин), 2,3,6-тригидроксинафтазарина (спинохром D), 2-дигидроксинафтазарина, 2, 6-дигидроксинафтазарина (рис.1) и исследована молекулярная структура образующихся радикалов. Как известно, для того, чтобы InOH был эффективным антиоксидантом, InO· должен быть стабильным радикалом, относительно медленно вступающим в реакцию с RH, и быстро – с ROO·. Так, константа скорости реакции a-токоферола с пероксильным радикалом составляет приблизительно 106 M-1 s-1, что значительно больше скорости реакции пероксильного радикала с липидами RH [6].
Рисунок 1. Полигидрокси-1,4-нафтохиноны (ПГНХ).
|
R2 = OH, R3 = R6 = R7 = H R2 = R3 = OH, R6 = R7 = H (спиназарин, 2)
R2 = R6 = OH, R3 = R7 = H R2 = R3 = R6 = OH, R6 = H (спинохром D, 4) R2 = R3 = R7 = OH, R6 = С2H5 (эхинохром А, 5) |
Расчеты проводились с использованием гибридного функционала B3LYP с базисом 6-31G(d,p). Анализ результатов расчетов BDE ОН-связей ряда фенольных антиоксидантов, приведенных в работах [7–9; 12], показывает, что метод B3LYP/6-31G(d,p) достаточно хорошо воспроизводит значения относительной энтальпии диссоциации, т.е. ее изменение в ряду родственных соединений. Для всех расчетов использовался пакет программ GAUSSIAN09.
Энтальпия реакции отщепления атома водорода (ΔH) представляет собой разность полной энтальпии образования исходной молекулы и радикальных продуктов в реакции
XOH ® XO· + H, (4)
где ХОН – нейтральная молекула ПГНХ. При температуре Т=298К энтальпия выражается формулой H(298K) = Ee + ZPE + Hvib + Htrans + Hrot + RT, где Ее – электронная энергия, ZPE – энергия нулевых колебаний, Hvib – вклад колебательного движения молекулы, Htrans =Hrot = 3/2RT – вклады поступательного и вращательного движений соответственно. Величины ZPE, а также Evib, Erot, Etrans вычисляются на основе расчета нормальных колебаний молекулы в пакете программ GAUSSIAN 09.
Электронная энергия атома водорода была принята равной -0.50000 а.е. В расчетах ΔH использовалось значение энтальпии атома водорода при Т=298К, включающее в себя Etrans и PV, и равное -0.49764 а.е.
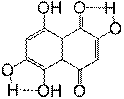
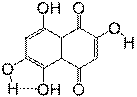
Все b-гидроксильные группы ПГНХ образуют слабые водородные связи с соседними атомами кислорода в положениях 1,4,5 и 8. Для того, что бы учесть вклад водородных связей в общее значение энтальпии реакции 4, была проведена оценка их энергии. С этой целью были оптимизированы структуры конформеров 2, 6-дигидроксинафтазарина (3), в которых водородные связи не образуются (рис.2). Локальные минимумы на ППЭ, соответствующие структурам 3а и 3б лежат выше по энергии, чем 3, на 6.87 и 5.48 ккал/моль соответственно. Полученные значения (ΔHВС) были использованы для корректирования рассчитанных значений энтальпии диссоциации ОН-связей в b-гидроксилах хиноидного и фенольного кольца соответственно.
Рисунок 2. Конформации 2, 6-дигидроксинафтазарина (3)
|
|
|
|
|
3 |
3а |
3б |
Результаты расчетов BDE b-OH представлены в таблице 1. Значения BDE представляют собой изменение энтальпии в реакции 4, скорректированное на величину энтальпии разрыва водородной связи: BDE = ΔH - ΔHВС. Величина BDE ОН заместителей в фенольном кольце ПГНХ меняется незначительно – от 81.24 до 83.42 ккал/моль. Эти значения близки к величине BDE OH фенола в расчетах B3LYP/6-31G(d,p) – 82.84 ккал/моль. Энтальпия диссоциации b-гидроксильных заместителей хиноидного кольца в значительной степени зависит от их числа – введение ОН заместителя в 3 положение 2-гидроксинафтазарина ведет к понижению BDE на 9.79 ккал/моль.
Таблица 1. Расчетные значения BDE b-гидроксильных групп ПГНХ
Соединение |
ОН группа, |
BDE, ккал/моль |
1 |
R2 |
86.19 |
2 |
R2 |
76.40 |
3 |
R2 |
87.31 |
R6 |
82.20 |
|
4 |
R2 |
76.39 |
R3 |
75.58 |
|
R6 |
81.24 |
|
5 |
R2 |
75.72 |
R3 |
75.97 |
|
R6 |
83.42 |
Таблица 2. Длины связей С(2) – О(2) в исходных молекулах и радикалах, образующихся при разрыве связи О(2) – Н, спиновая плотность в радикалах.
Соединение |
Длины связей (Å) |
Спиновые плотности на атомах радикала по Малликену |
|||
|
C – OH |
C – O· |
O2 |
C2 |
C3 |
1 |
1.336 |
1.234 |
0.343 |
-0.156 |
0.713 |
2 |
1.343 |
1.228 |
0.285 |
-0.078 |
0.458 |
3 |
1.333 |
1.233 |
0.330 |
-0.161 |
0.737 |
4 |
1.340 |
1.225 |
0.258 |
-0.080 |
0.465 |
5 |
1.341 |
1.226 |
0.263 |
-0.079 |
0.464 |
Понижение величины BDE в соединениях, имеющих пару вицинальных b-гидроксилов, является следствием дополнительной стабилизации образующегося радикала. Значения спиновой плотности на атомах в образующихся радикалах представлены в таблице 2. В соединениях 1 и 3, имеющих одну хиноидную b-гидроксильную группу, спиновая плотность в значительной степени локализована на атоме углерода С3. Введение ОН группы в положении 3 (соединения 2, 4 и 5) приводит к значительной делокализации неспаренного электрона, и, как следствие, к стабилизации радикального продукта.
Найденная зависимость энтальпии диссоциации b-гидроксильных заместителей ПГНХ от их числа и взаимного расположения подтверждает экспериментально установленную связь между строением нафтазариновых производных и их эффективностью как ингибиторов процесса автоокисления различных субстратов - значительной антиоксидантной активностью обладают соединения, как минимум, с двумя β-гидроксильными группами, наибольшую же активность проявляют те из них, которые имеют пару вицинальных гидроксилов. Понижение энтальпии диссоциации ОН-связей при переходе от соединений с одним хиноидным b-гидроксилом к соединениям с вицинальными гидроксилами составило в наших расчетах примерно 10 ккал/моль. Энтальпия диссоциации вицинальных β-гидроксильных групп в полигидроксилированных-1,4-нафтохинонах на 7 ккал/моль ниже, чем величина BDE OH-группы в феноле, что сравнимо со значениями BDE OH-групп фенольных антиоксидантов – величина ΔBDE d- и g-токоферолов, активных компонентов витамина Е, составляет -7.3 и -8.9 ккал/моль [9].
Список литературы.
1. Богуславская Л. В., Храпова Н. Г., Максимов О. Б.. // Изв. АН СССР. Сер. Хим. 1985, № 7 с. 1471-1476.
2. Лебедев А.В., Богуславская Л.В., Левицкий Д.О., Максимов О.Б. // Биохимия - 1988, 53(4), 598-603.
3. Лебедев А.В., Иванова М.В., Красновид Н.И. и др. Кислотные свойства и взаимодействие с супероксид анион-радикалом эхинохрома А и его структурных аналогов // Вопросы медицинской химии. - 1999. - Т. 45, № 2. - С. 123-130.
4. Левицкий Д.О., Лебедев А.В., Садретдинов С.М., Швилкин А.В., Афонская Н.И., Руда М.Я., Розенштраух Л.В., Флейдервиш И.Я., Максимов О.Б., Мищенко Н.П., Кольцова Е.А., Артюков А.А., Глебко Л.И., Новиков В.Л., Ануфриев В.Ф., Еляков Г.В., Серебрякова Л.И., Цкитишвили О.В., Черпаченко Н.М. (1991) Заявка на изобретение № 4764885/14. Решение ВНИИГПЭ о выдаче патента от 6 дек. 1991 г. Межд. пат. WO 91/07958 № 1833544., М, ВНИИГПЭ.
5. Максимов О. Б., Кольцова Е. А., Уткина Н. К. и др. А. с. № 566870 СССР // Б. И. 1977. № 28.
6. Burton, G. W.; Ingold, K. U. // Acc. Chem. Res. 1986, 19, 194.
7. DiLabio G. A., Pratt D. A., LoFaro A. D., and Wright J. S. // J. Phis.Chem. A 1999, 103, 1653-1661
8. James S. Wright, David J. Carpenter, Daniel J. McKay, and K. U. Ingold. // J. Am. Chem. Soc. 1997, 119, 4245-4252.
9. James S. Wright, Erin R. Johnson, and Gino A. DiLabio. // J. Am. Chem. Soc. 2001, 123, 1173-1183
10. Lebedev A.V., Ivanova M.V., Levitsky D.O. Echinochrome, a naturally occurring iron chelator and free radical scavenger in artificial and natural membrane systems // Life Sci. - 2005. - Vol. 76, № 8. - P. 863-875.
11. Lebedev A.V., Ivanova M.V., Levitsky D.O. Iron chelators and free radical scavengers in naturally occurring polyhydroxylated 1,4-naphthoquinones // Hemoglobin. -2008. - Vol. 32, №1. - P. 165-179.
12. Wayner, D. D. M.; Lusztyk, E.; Page, D.; Ingold, K. U.; Mulder P.; Laarhoven, L. J. J.; Aldrich, H. S. // J. Am. Chem. Soc. 1995, 117, 8737-8744
дипломов



Оставить комментарий