Статья опубликована в рамках: LIII Международной научно-практической конференции «Технические науки - от теории к практике» (Россия, г. Новосибирск, 23 декабря 2015 г.)
Наука: Технические науки
Секция: Химическая техника и технология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
СИНТЕЗ 3-ГИДРОКСИ-2-ОКСОИЛИДЕН-1,5-ДИГИДРО-2 H-ПИРРОЛОВ ИЗ 1,3,4,6-ТЕТРАКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ И АЗОМЕТИНОВ
Козьминых Владислав Олегович
д-р хим. наук, профессор, зав. кафедрой химии
Пермского государственного гуманитарно-педагогического университета,
РФ, г. Пермь
E -mail: kvoncstu@yahoo.com
Муковоз Пётр Петрович
канд. хим. наук, преподаватель
Оренбургского филиала Московского технологического института,
РФ, г. Оренбург
SYNTHESIS OF 3-HYDROXY-2-OXOYLIDENE-1,5-DIHYDRO-2 H-PYRROLES FROM 1,3,4,6-TETRACARBONYL COMPOUNDS AND AZOMETHINES
Vladislav Kozminykh
doctor of Chemical Sciences, Professor, Head of the Chemical Section
of the Perm State Humanitarian Pedagogical University,
Russia, Perm
Peter Mukovoz
candidate of Chemical Sciences, Teacher
of the Orenburg Division of Moscow Technological Institute,
Russia, Orenburg
АННОТАЦИЯ
Описана технология препаративного синтеза 3-гидрокси-2-оксоилиден-1,5-дигидро-2H-пирролов, образующихся в результате взаимодействия 1,3,4,6-тетракарбонильных соединений с азометинами или их синтетическими эквивалентами – ариламинами и альдегидами или кетонами. Обсуждаются особенности строения полученных соединений.
ABSTRACT
The technology for preparative synthesis of 3-hydroxy-2-oxoylidene-1,5-dihydro-2H-pyrroles, which are formed on result of the reaction of 1,3,4,6-tetracarbonyl compounds with azomethines or their synthetic equivalents, namely aryl amines and aldehydes or ketones, is described. The structure features of prepared compounds are discussed.
Ключевые слова: 3-гидрокси-2-оксоилиден-1,5-дигидро-2H-пирролы; технология; синтез; 1,3,4,6-тетракарбонильные соединения; азометины.
Keywords: 3-hydroxy-2-oxoylidene-1,5-dihydro-2H-pyrroles; technology; synthesis; 1,3,4,6-tetracarbonyl compounds; azomethines.
Препаративные особенности и технологические условия синтеза широкого ряда биологически активных 3-гидрокси-1,5-дигидро-2H-пиррол-2-онов (1) (рис. 1) разработаны достаточно подробно (см., например, статьи [2; 3; 11]). Оксоилиденпроизводные соединений (1) по лактамному карбонилу – пирролины (2) – до наших исследований [3; 4; 7–9] не были известны. Отметим, что мы сообщали ранее о результатах изучения взаимодействия 1,3,4,6-тетракарбонильных соединений (ТКС) и родственных оксо-систем с аминами, азометинами (илиденаминами, основаниями Шиффа), а также некоторыми азинами в синтезе разнообразных азотсодержащих гетероциклов и оксоенаминов [3; 4].
Целью настоящей работы является анализ данных о взаимодействии ТКС с основаниями Шиффа и их синтетическими предшественниками – ариламинами и альдегидами или кетонами, а также обсуждение строения продуктов этих реакций – 2-оксоилидензамещённых 3-гидрокси-1,5-дигидро-2H-пирролов (2: общий вид – см. рис. 1).
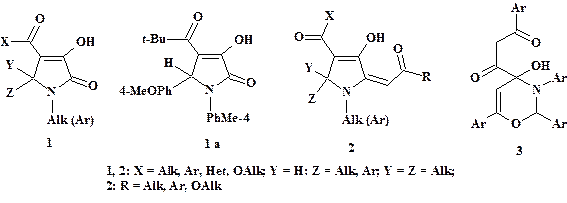
Рисунок 1. Структурное разнообразие 3-гидрокси-1,5-дигидро-2H -пирролов (1), (2) и альтернативные 4-гидрокси-3,4-дигидро-2H-1,3-оксазин-4-оны (3)
Вопреки сообщениям о выделении 4-гидрокси-3,4-дигидро-2H-1,3-оксазин-4-онов (3) (рис. 1) при действии оснований Шиффа на 1,6-диарил-1,3,4,6-гексантетраоны (4: R1 = R2 = Ar) (критическое обсуждение структурных данных приведено в работах [3; 4]), нами в результате этой реакции получены иные продукты – производные пиррола (5: R1 = R2 = Ar) [3; 4; 7–9].
Так, гетероциклизация ТКС (4: таутомеры 4A, 4B и 4C; R1 = R2 = Alk; R1 = Ar, R2 = OAlk; сведения об их синтезе и строении – см. работы [1; 5; 10]) при действии арилиденариламинов или смеси ароматических альдегидов и аминов приводит к образованию 2-оксоилиденпроизводных (ненасыщенных кетонов или эфиров) 4-ацил-3-гидрокси-1,5-диарил-1,5-дигидро-2H-пирролов (5: R1 = R2 = Alk; R1 = Ar, R2 = OAlk) [3; 4; 8] (рис. 2; табл. 1 – приведены представители каждого ряда структур).
В результате трёхкомпонентной реакции ТКС (4: R1 = Alk, R2 = OAlk; R1 = OAlk, R2 = Alk; R1 = R2 = OAlk; сведения об их синтезе – см. работы [6; 10]), имеющих по крайней мере одну терминальную сложноэфирную группу, с ацетоном и ариламинами получены соответствующие 2-оксоилиденпроизводные 1-арил-3-гидрокси-5,5-диметил-1,5-дигидро-2H-пирролов (6: R1 = Alk, R2 = OAlk; R1 = OAlk, R2 = Alk; R1 = R2 = OAlk) [3; 4; 7; 9] (рис. 2, табл. 1).

Рисунок 2. Взаимодействие 1,6-дизамещённых 1,3,4,6-тетракетонов с азометинами как технологичный метод препаративного синтеза 2-оксоилидензамещённых 3-гидрокси-1,5-дигидро-2H -пирролов
Строение пирролов (5) и (6) установлено на основании данных ИК, ЯМР 1H спектроскопии, масс-спектрометрии и рентгеноструктурного анализа (РСА) [7–9]. Сравнительные спектральные характеристики некоторых из полученных соединений (5) и (6) представлены в табл. 2. В качестве объекта сопоставления спектральных данных по маркерным сигналам выбран известный аналог – 3-гидрокси-5-п-метоксифенил-4-пивалоил-1-п-толил-2,5-дигидро-1H-пиррол-2-он (1a) [2]. Данные спектров изученных соединений удовлетворительно согласуются между собой и соответствуют установленным структурам. Результаты РСА окончательно подтверждают строение соединений (5), (6) в кристаллическом состоянии. В растворах дейтерированных растворителей – хлороформе (CDCl3) и диметилсульфоксиде (ДМСО-d6) – синтезированные пирролы имеют структуру, аналогичную твердофазной.
Таблица 1.
Матрица данных по некоторым представителям двух групп 2-оксоилиденпроизводных пиррола (5) и (6)
|
|
|
|||||||
|
Соединение |
R1 |
R2 |
Ar1 |
Ar2 |
Т. пл., °С, (растворитель, [лит.] * |
Выход, % |
|
|
|
5a |
CH3 |
CH3 |
C6H5 |
4-CH3C6H4 |
167–170 (метанол) [8] |
69 |
|
|
|
5b |
C6H5 |
OCH3 |
C6H5 |
C6H5 |
244–246 (метанол) ** |
23 |
|
|
|
6a |
CH3 |
OCH3 |
– |
4-CH3C6H4 |
135–137 (ацетон) [9] |
10 |
|
|
|
6b |
OCH3 |
CH3 |
– |
4-CH3C6H4 |
230–231 (ацетон) [9] |
13 |
|
|
|
6c |
OCH3 |
OCH3 |
– |
4-CH3C6H4 |
150–152 (ацетон) [7] |
52 |
|
|
Примечания.
* Приведены: температура плавления (в °С), растворитель для кристаллизации, ссылка на литературу.
** Н е опубликованные ранее данные.
Таблица 2.
Сравнительные спектральные характеристики производных пиррола (5), (6) и модельного 2-пирролона (1а)
|
|
|
|
|
||
|
Соединение |
Характеристические сигналы в спектрах |
||||
|
ИК, ν, cм-1 (кристаллы) |
ЯМР 1H, δ, м.д. (CDCl3, ДМСО-d6) |
||||
|
1a |
3118 (OH), 1683 (C2O), 1632 (COBu-t) |
CDCl3: 5,87 с (C5H); ДМСО-d 6: 5,98 с (C5H) |
|||
|
5a |
2925 (OH), 1639 (COMe) |
CDCl3: 5,16 с (>C2=CH), 5,80 с (C5H), 17,69 с (C3-OH); ДМСО-d 6: 5,23 с (>C2=CH), 6,13 с (C5H), 18,13 с (C3-OH) |
|||
|
5b |
3430 (OH), 1696 (COOMe), 1664 (COPh) |
CDCl3: 5,99 с (>C2=CH), 6,21 с (C5H), 8,16 с (C3-OH) |
|||
|
6a |
2625 (OH), 1823 (COOMe), 1638 (COMe) |
CDCl3: 4,30 с (>C2=CH), 15,10 с (C3-OH) |
|||
|
6b |
2690 (OH), 1678 (COOMe), 1637 (COMe) |
CDCl3: 4,67 с (>C2=CH), 17,62 с (C3-OH) |
|||
|
6c |
2950 (OH), 1694 (COOMe) |
CDCl3: 4,30 с (>C2=CH), 14,99 с (C3-OH) |
|||
В ИК спектрах пирролинов (5), (6) кроме полос поглощения карбонильных звеньев присутствуют уширенные низкочастотные полосы валентных колебаний гидроксильных групп ν 3100–2530 см-1, а также поглощение C=C связей 1603–1509 см-1 и деформационные колебания групп CH ароматических колец около 800 см-1 [7–9]. Отметим, что поглощение сложноэфирных карбонильных групп некоторых пирролинов (6), например соединения (6a) (табл. 2), наблюдается в необычно высокочастотной области 1799–1824 см-1, что свидетельствует об отсутствии как внутримолекулярных, так и межмолекулярных связей группы C=O. Для сравнения укажем, что поглощение карбонильных групп ацильного звена пирролинов (5) и (6) (R1(2) = Alk, Ar) наблюдается в низкочастотной области – около 1639–1645 см-1, что свидетельствует о наличии внутри- или межмолекулярных контактов с участием ацильных групп.
В спектрах ЯМР 1Н пирролинов (5), (6) кроме сигналов протонов алкильных групп и арильных колец присутствуют характеристические синглеты метинового протона оксоилиденового звена в широком диапазоне δ 4,27–6,13 м.д. и гидроксильной группы кольчатого енола 14,90–18,13 м.д. [7–9] (табл. 2).
Масс-фрагментация пирролинов (5) под действием электронного удара осуществляется в трёх основных направлениях – с последовательным отщеплением ацильных ионов R1(2)С≡O ]+ и разрывом связи C1-C5 с элиминированием арилиминиевого иона (рис. 3). Так, в масс-спектре соединения (5b) присутствуют сигналы следующих ионов (для каждого пика приведены значения массового числа m/z и в скобках – интенсивность в процентах по отношению к максимальному пику, указаны отчётливые сигналы с интенсивностью не менее 3 %): 411 (9) M ]+., 380 (17) M – OMe ]+, 379 (5) M – OMe – H ]+, 306 (10) M – PhC≡O ]+, 274 (100) M – PhC≡O – OMe ]+, 246 (4) M – PhC≡O – CO – OMe ]+, 222 (4) Ph-C(NHPh)=CH-C≡O ]+, 181 (3) PhCH=NPh ]+, 180 (15) PhC≡NPh ]+, 105 (13) PhC≡O ]+, 77 (20) Ph ]+, 73 (5) CH2COOMe ]+.
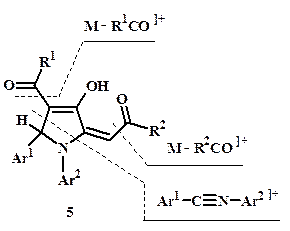
Рисунок 3. Схема основных направлений масс-фрагментации илиденпирролинов (5) под действием электронного удара
В масс-спектрах высокого разрешения для соединений (5), (6) отмечены характеристические сигналы протонированных и катионированных молекул [M+H]+ и [M+Na]+, а также кластерных ионов [2M+Na]+ [8; 9].
Таким образом, нами обобщены данные по технологически значимым реакциям 1,3,4,6-тетракарбонильных соединений с азометинами и их синтетическими эквивалентами – ариламинами и ароматическими альдегидами или кетонами. Отмечены особенности строения продуктов реакций – 2-оксоилидензамещённых 3-гидрокси-1,5-дигидро-2H-пирролов.
Список литературы:
1. Козьминых В.О., Гончаров В.И., Козьминых Е.Н. Конденсация Клайзена метилкетонов с диалкилоксалатами в синтезе биологически активных карбонильных соединений (обзор, часть 3) // Вестник Оренбургского гос. ун-та. – Оренбург, 2007. – Вып. 5 (69). – С. 138–148.
2. Козьминых В.О., Игидов Н.М., Зыкова С.С., Колла В.Э., Шуклина Н.С., Одегова Т.Ф. Синтез и фармакологическая активность 3-гидрокси-1,5-диарил-4-пивалоил-2,5-дигидро-2-пирролонов // Химико-фармацевтический журнал. – 2002. – Т. 36. – № 4. – С. 23–26.
3. Козьминых В.О., Муковоз П.П. Новые представления о взаимодействии 1,3,4,6-тетракарбонильных систем с азометинами, краткий обзор реакций с аминами и азинами // Приволжский научный вестник. Научно-практический журнал. – Ижевск: изд-во "Издательский Центр Научного Просвещения", май 2015. – № 5-1 (45). – С. 33–43.
4. Козьминых В.О., Муковоз П.П. Трёхкомпонентные реакции 1,3,4,6-тетракарбонильных соединений с ариламинами и кетонами или ароматическими альдегидами // Естественные и математические науки в современном мире. Сборник статей по материалам XXXVII международной заочной науч.-практ. конф., Новосибирск, 7 декабря 2015 г. – Новосибирск: изд-во "СибАК", 2015 (в печати).
5. Козьминых Е.Н., Гончаров В.И., Оборин Д.Б., Козьминых В.О. Простой метод синтеза эфиров 2-гидрокси-3-оксо-2,3-дигидрофуран-2-илуксусной кислоты // Химия гетероциклических соединений. – 2007. – № 5 (479). – С. 782–784.
6. Муковоз П.П., Дворская О.Н., Козьминых В.О. Синтез и особенности строения эфиров 3,4-дигидрокси-1,6-гександиовой кислоты // Известия высших учебных заведений. Химия и химическая технология. – Иваново: ИГХТУ, 2011. – Т. 54. – № 5. – С. 96–100.
7. Муковоз П.П., Козьминых В.О., Андреева В.А., Ельцов О.С., Слепухин П.А., Козьминых Е.Н. Способ получения и строение эфиров (5E)-4-гидрокси-5-(2-алкокси-2-оксоэтилиден)-2,2-диметил-1-(4-метилфенил)-2,5-дигидро-1H-пиррол-3-карбоновых кислот // Журнал органической химии. – 2015. – Т. 51. – № 6. – С. 877–879.
8. Муковоз П.П., Козьминых В.О., Козьминых Е.Н., Горбунова А.В., Слепухин П.А., Ганебных И.Н., Ельцов О.С. Особенности взаимодействия 1,3,4,6-тетракетонов с п-толуидином и бензальдегидом // Журнал органической химии. – 2016 (в печати).
9. Муковоз П.П., Слепухин П.А., Козьминых В.О., Андреева В.А., Ельцов О.С., Ганебных И.Н., Козьминых Е.Н. Особенности реакции эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот с ацетоном и п-толуидином // Журнал общей химии. – 2015. – Т. 85. – № 12. – С. 1983–1988.
10. Муковоз П.П., Тарасова В.А., Козьминых В.О. Синтез и особенности строения метиловых эфиров 3,4,6-триоксоалкановых кислот // Журнал органической химии. – 2014. – Т. 50. – № 11. – С. 1698–1700.
11. Перевалов С.Г., Бургарт Я.В., Салоутин В.И., Чупахин О.Н. (Гет)ароилпировиноградные кислоты и их производные как перспективные "строительные блоки" для органического синтеза // Успехи химии. – 2001. – Т. 70. – № 11. – С. 1039–1058.
дипломов



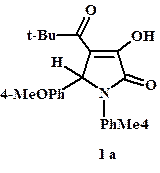
Оставить комментарий