Статья опубликована в рамках: XVIII-XIX Международной научно-практической конференции «Наука вчера, сегодня, завтра» (Россия, г. Новосибирск, 08 декабря 2014 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
КИНЕТИКА ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ В ЭЛЕКТРОЛИТИЧЕСКОМ МЕТОДЕ РАФИНИРОВАНИЯ МЕДИ
Надиров Ермурат Галимбекович
канд. хим. наук, доцент Алматинского университета энергетики и связи, Республика Казахстан, г. Алматы
Айдымбаева Жанар Абдешевна
старший преподаватель Алматинского университета энергетики и связи, Республика Казахстан, г. Алматы
Нурмадиева Эльмира Амиржановна
ассистент Алматинского университета энергетики и связи,
Республика Казахстан, г. Алматы
Процесс прохождения электрического тока через электролит является неравновесным, и явления, связанные с прохождением тока, зависят от времени. С течением времени состояние электрохимической системы изменяется, а параметры, характеризующие процесс, зависят от протекающего тока.
Изучение электрических процессов в зависимости от тока, их изменения с течением времени, установление механизма составляет предмет кинетики электрохимических процессов.
Электрический ток может протекать в электрохимическом элементе, состоящем из электродов и электролита, в результате замыкания этого элемента накоротко или под влиянием приложенной к системе внешней разности потенциалов. В последнем случае на границах электрод-электролит возможно выделение металла из электролита на электродах, изменение состава электролита вблизи электрода, т. е. возникновение явления электролиза.
Так как реакция в электрохимической системе состоит из электродных реакций, процессы на каждом из электродов в неравновесных условиях отличаются от равновесных:
a) скорость электрохимических реакций на катоде и анода различна, т. е. сила анодного и катодного токов различна; одна из двух возможных электродных реакций идет преимущественно в анодном направлении, и для нее Ia>Ik , а вторая преимущественно в катодном направлении, и для нее Ia<Ik ;
b) в результате преимущественного протекания реакции в данном направлении масса электрода, а также состав раствора около него меняются по сравнению с равновесными;
c) потенциал электрода при протекании тока в общем случае не равен равновесному электродному потенциалу; его величина зависит от природы системы, температуры и от силы тока.
Скорость электрохимической реакции ![]() определяется изменениями количества вещества в единице времени:
определяется изменениями количества вещества в единице времени:
![]() (1)
(1) ![]()
На основе уравнения (1) можно записать, что
![]() (2)
(2)
Таким образом, скорость электрохимической реакции пропорциональна току.
Все электрохимические реакции протекают на границе раздела электрод-электролит, и их скорость зависит от площади границы раздела, S [3].
Тогда удобно скорость реакции относить к единице поверхности раздела и определять как плотность тока:
![]() (3)
(3)
Потенциал и плотность тока являются основными параметрами, с помощью которых выбираются методы исследования кинетики электрохимических процессов.
Любой электродный процесс представляет собой сложную гетерогенную реакцию, состоящую из нескольких последовательных стадий. Реакция может протекать несколькими путями.
Скорость стадий и всего химического процесса зависит от состава ионопроводящей среды, температуры, времени от начала реакции, от тех факторов, которые определяют скорость реакции.
Нужно учитывать и некоторые факторы, характерные только для электрохимических процессов. Это потенциал электрода, который сильно влияет не только на скорость, но и на направление протекания реакции и на природу ее продуктов. Кроме потенциала, на протекание реакции влияние оказывает и заряд электрода [3].
Электрохимическая поляризация
Протекание электрического тока через электролиты, а также разложение веществ происходит только при достижении определенной величины напряжения. При постепенном увеличении напряжения от внешнего источника величина тока в цепи остается незначительной до тех пор, пока напряжение не достигнет определенного значения.
После этого происходит быстрое нарастание величины тока, и наступает процесс электролиза (рисунок 1).
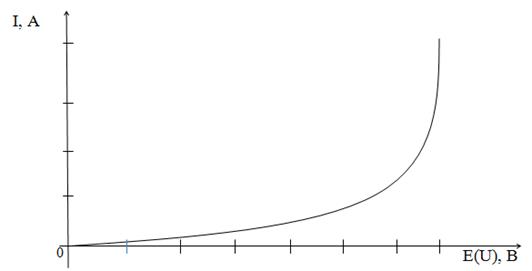
Рисунок 1. Зависимость тока от напряжения
Это противоречит закону Ома.
При увеличении внешнего напряжения происходит дальнейший процесс заряжения, и изменения потенциалов электродов до тех пор, пока поляризация не приведет к протеканию электрохимических процессов, сопровождающихся выделением и поглощением электронов. Начинается электролиз, и через систему протекает установившийся стационарный ток. В этом случае полностью проявляется электрохимическая поляризация. ЭДС поляризации направлена против внешней разности потенциалов (Uвнеш.).
Это и приводит к кажущемуся противоречию с законом Ома:
![]() (4)
(4)
где: Еп — ЭДС поляризации.
Итак, разложение веществ путем электролиза происходит лишь при определенном напряжении, зависящим от природы электролита и условий проведения электролиза.
Распределение плотности тока и потенциала
Раствор вблизи электрода можно считать полем сочетания эквипотенциальных поверхностей [1].
Рассмотрим решение на двух электродах, расположенных друг напротив друга на стенках проточного клина (рисунок 2).
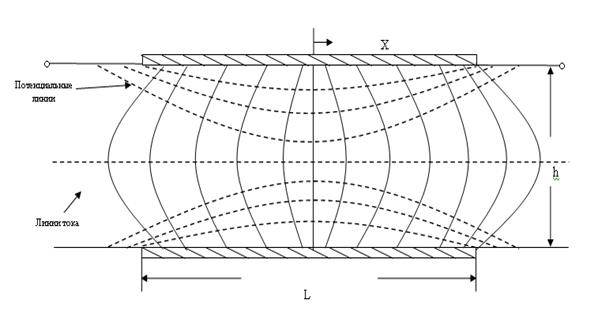
Рисунок 2. Схема расположения двух электродов на стенках проточного клина с распределением токов и потенциалов
Распределение токов при падении потенциала на сопротивлении ячейки описывается уравнением:
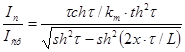
где: t=pL/2h, х — продольная координата, отсчитываемая от центра электрода,
кm — полный эллиптический интеграл первого рода (данные взяты из справочника).
Сложность этого выражения дает некоторое представление о трудности получения распределения потенциала.
Для сравнения показано на рисунке также распределение предельного диффузного тока в случае ламинарного течения (рисунок 3,1).
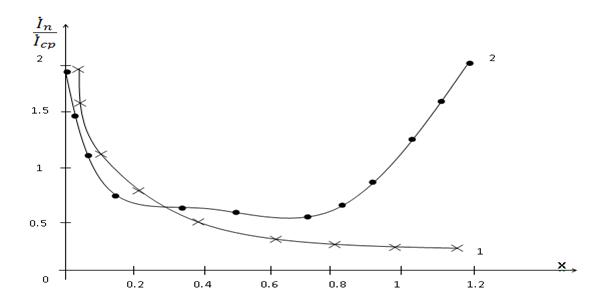
Рисунок 3. Распределение токов на поверхности электродов: 1 — токи конвективной диффузии; 2 — токи при падении потенциала на сопротивлении ячейки.
Мы полагаем, что распределение тока не зависит от скорости течения. На это указывает и симметричность распределения (рисунок 3,2).
В случае двух электродов при исчезновении промежутков между электродами (дендритное замыкание), полный ток становится бесконечным. Следовательно, решение о распределении плотности тока в случае контакта двух электродов, находящихся при различных потенциалах, становится сложной задачей.
Поэтому следует искать другие методы исследования распределения тока на поверхности электрода. Таким методом может стать метод моделирования.
В нашем случае метод моделирования предусматривает знание отдельных ведущих элементов процесса, протекающего в естественных условиях.
К таким элементам можно отнести конфигурацию электрического поля, от которой зависит плотность тока на поверхности катода, а следовательно, рельеф осадка, его качество.
На конфигурацию электрического поля, кроме формы и расположения электродов, оказывают влияние физико-химические свойства электролита, которые оцениваются по фактору его рассеивающей способности.
Рассеивающая способность электролита зависит от электродных поляризаций, выхода по току и влияния электролита в межэлектродном пространстве.
В ранних исследованиях последний фактор не учитывался. Считали, что электролит в межэлектродном пространстве представляет собой однородную и изотропную среду, в электрическом отношении полностью подчиняющуюся закону Ома [2; 3].
Зависимость удельного сопротивления от конфигурации электрического поля в межэлектродном пространстве изучалась нами методом моделирования.
Эксперименты, поставленные нами на лабораторных моделях, показали, что существует зависимость удельного сопротивления электролита от величины градиента потенциала и конфигурации электрического поля в межэлектродном пространстве, проводящие к аномальным явлениям.
Влияние градиента потенциала на удельное сопротивление рассматривалась как изменение проводимости при переменной напряженности поля.
На практике градиент электрического потенциала составляет несколько вольт на сантиметр, при этом для растворов электролитов справедлив закон Ома:
![]()
Полный ток определяется по формуле, приведенной в работах [1; 3].
![]()
где Н — глубина раствора, связанная с действием электрического поля. В этой формуле проводимость не зависит от напряженности электрического поля. Связь прослеживается между током и градиентом потенциала. При высокой напряженности поля порядка 103– 105 В/см проводимость растворов электролитов резко повышается (рисунок 4).
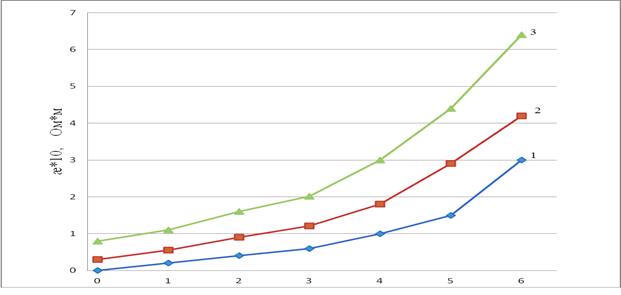
Рисунок 4. Зависимость проводимости растворов от напряженности электрического поля: 1 — СН3 СООН, 2 — Н2SO4,160 г/л, 3 — С uSO4,250 г/л в сернокислом растворе 160 г/л
Возможные факторы, влияющие на такую зависимость:
1. изменение подвижности вследствие электролитического взаимодействия между ионами, т. е. создается высокая скорость миграции ионов;
2. столкновение нейтральных молекул растворов с ионами, разогнанными электрическим полем до высоких скоростей, приводящих к лавине ионов.
Выводы
1. Градиент потенциала влияет на гидратные оболочки ионов, и при этом создаются различные виды торможения движущимся ионов в электролите.
2. В неоднородной части электрического поля с резким изменением градиента потенциала можно ожидать аномальную подвижность ионов.
3. Вызвать неоднородность электрического поля могут краевые эффекты на электродах, неравномерность тока у параллельно включенных электродов из-за различия контактах сопротивлений, а также смещение электрического поля между электродами.
Список литературы:
1.Грабова Е.И. Распределение концентрации электролита в электродных зонах при электролизе. Волгоград: Химия и химическая технология, 1968, — С. 81—87.
2.Епископосян М.Л., Карибян А.Н., Тоноян А.К. Влияние некоторых факторов на падения напряжения, удельный расход электроэнергии и выход по току при электрорафинировании меди. Ереван: Амянипроцветме, 1976. — С. 22—29.
3.Иоффе И.В. О влиянии внешних полей на термодинамические свойства растворов // Журнал экспериментальной и теоретической физики. — 1969. — № 2. — С. 529—533.
4.Щербаков В.В. Закономерности в электропроводности концентрированных растворов сильных электролитов // Электрохимия. — 2009. — Т. 45, — № 11. — С. 1394—1397.
5.Щербаков В.В., Артемкина Ю.М., Понамарева Т.Н. и др. Электропроводность системы аммиак-вода // Журнал неорг. химии. — 2009. — № 2. — С. 321—325.
6.Юшков И.Г., Левин А.И., Чубарова М.С. Процессы при электролитическом рафинированный меди. Тбилиси: Мециереба, 1969. — С. 376—379.
дипломов


Оставить комментарий