Статья опубликована в рамках: XI Международной научно-практической конференции «Наука вчера, сегодня, завтра» (Россия, г. Новосибирск, 07 апреля 2014 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ПОВЕДЕНИЕ ДИГИДРАТА АЦЕТАТА ЛИТИЯ И ДИГИДРАТА АЦЕТАТА ЦИНКА ПРИ НАГРЕВАНИИИ
Надиров Ермурат Галымбекович
канд. хим. наук, доцент Алматинского Университета Энергетики и Связи, Республика Казахстан, г. Алматы
Мустафаева Назира Маматкуловна
старший преподаватель Алматинского Университета Энергетики и Связи, Республика Казахстан, г. Алматы
Онгар Булбул
старший преподаватель Алматинского Университета Энергетики и Связи, Республика Казахстан, г. Алматы
Нурмадиева Эльмира
ассистент Алматинского Университета Энергетики и Связи, Республика Казахстан, г. Алматы
Термическая устойчивость и свойства дигидратов ацетата лития и ацетата цинка при нагреве представляет научный и практический интерес в теории комплексообразования. В большинстве работ исследователи рассматривали только влияние механизма реакции и структурных факторов на процессы кетонизации и разложения ацетатов и щелочных металлов. В данной работе экспериментально определены коэффициенты светопреломления, плотности и межплоскостные расстояния ацетатов лития и цинка.
При нагреве двухводного ацетата лития до 116 ºС происходит эндотермический эффект, что, по нашему мнению, соответствует удалению одной молекулы воды. При температуре 124 ºС происходит второй эндотермический эффект, что соответствует уходу второй молекулы кристаллизационной воды. Расчёт по суммарной потере в весе (35,29 %) подтверждает наличие двух молекул воды в ацетате лития и действительно соответствует экспериментальным данным (34,5 %) в температурной области (110—130 ºС). Далее в интервале температур 200—365 ºС потерь в весе не обнаружено, хотя на термограмме в этой области видно два эндоэффекта, которые соответствуют полиморфному изменению индивидуальной соли при 229 ºС и плавлению самого ацетата при 266 ºС. Кривая изменения веса двухводного ацетата лития представлена на рисунке 1.
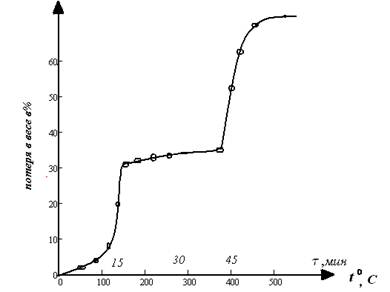
Рисунок 1. Кривая изменения веса двухводного ацетата лития
Безводный ацетат лития кристаллизуется в низшей сингонии: триклинной и моноклинной. Под микроскопом представлен кристаллами с чётко очерченными гранями. Цвета интерференции высокие зональные. Погасание пластин прямое, удлинение переменное, различаются трещинки спаянности вдоль кристаллов. Соединение оптически двухосное, угол 2υ = 83º. Коэффициенты светопреломления: Np = 1,467, Nq = 1,548.
Удельный вес высушенных проб, определённый пикнометрическим ходом, равен 1,453 г/см3. Межплоскостные расстояния приведены в таблице 1
Таблица 1.
Межплоскостные расстояния двухводного ацетата лития
|
J/J0. % |
d/n , Aº |
J/J0. % |
d/n , Aº |
J/J0. % |
d/n , Aº |
J/J0. % |
d/n , Aº |
|
61,8 |
8,724 |
7,9 |
6,357 |
30,2 |
4,343 |
30,2 |
3,676 |
|
100,0 |
8,698 |
19,6 |
5,514 |
21,0 |
4,142 |
18,4 |
3,301 |
|
72,2 |
7,898 |
7,9 |
5,129 |
52,6 |
3,790 |
11,8 |
2,845 |
|
— |
— |
— |
— |
— |
— |
3,9 |
2,393 |
При термическом разложении соли при температуре 365—380 ºС происходит бурное выделение ацетона (характерный запах и горение) потери в весе значительны, 33—36 %. Образуется белый осадок. Результаты химического анализа осадка подтвердили наличие карбоната лития (С — 16,75 %, О — 64,88 %, Li — 18,375 %). На термограмме процессу термического разложения соответствует эндоэффект при температуре 369 ºС
Последующие два эндоэффекта при температуре 579 ºС и 641 ºС, по- видимому, относятся к структурной перестройке карбоната без убыли в весе. Таким образом, можно предположить, что разложение ацетата лития происходит по следующей схеме:

Теоретическая потеря в весе, соответственно предложенной схеме, составляет 79,24 %, а экспериментальные данные по термогравитограмме — 77,86 %. Процесс кетонного разложения ацетата лития является прямым потверждением образования активированного комплекса с участием двух молекул ацетата
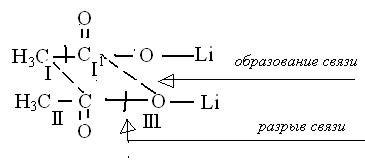
Образование и разложение активированного комплекса, как известно, связанно с согласованным циклическим переносом электронов. Однажды начавшееся электронное смещение дальше протекает самопроизвольно, а полярность связи только благоприятствует. Таким образом, можно предложить схему вероятного перераспределения связей при разложении:
1. разрыв связи С-С в первой молекуле и С-О во второй молекуле;
2. ![]()
![]() образование новых связей в местах разрыва
образование новых связей в местах разрыва  , разных молекул.
, разных молекул.
Термическая устойчивость безводного ацетата цинка так же рассматривалась многими авторами. Безводный ацетат цинка представляет собой мелкие октаэдрические кристаллики. Плавится приблизительно 240 ºС, разлагается в вакууме при 270—280 ºС, нерастворим в бензоле, эфире, в СНСl3. В воде растворяется с образованием дигидрата. При нагреве безводного ацетата цинка потеря обеих молекул воды происходит непрерывно и заканчивается около 110—120 ºС.
Термический анализ Zn(CH3COO)2*2H2O позволил установить наличие двух тепловых эффектов на кривых нагревания:
1. При 110 ºС — связанных, видимо, с потерей воды и образованием безводной соли;
2. При 235 ºС — эффект плавления.
![]() Под микроскопом двухводный ацетат цинка представлен удлинёнными полупрозрачными пластинками и их обломками. Цвета интерференции высокие зональные. Погасание пластин прямое, удлинение переменное, отчётливо видны трещинки спайности вдоль длинной оси кристаллов. Соединение оптически двухосное, угол 2υ бо к 90º. Коэффициенты светопреломления: Np = 1,488, Nm = 1,513, Nq = 1.537. В работе [5, с. 645] двухводный ацетата цинка описан как двухосный положительный с углом 2υ = 87º. Коэффициенты светопреломления: Np = 1,432, Nm = 1,492, Nq = 1,553. Таким образом, полученное нами соединение довольно существенно отличается от описанного в литературе. Значительное расхождение наблюдается и в наборе межплоскостных расстояний (таблица 2).
Под микроскопом двухводный ацетат цинка представлен удлинёнными полупрозрачными пластинками и их обломками. Цвета интерференции высокие зональные. Погасание пластин прямое, удлинение переменное, отчётливо видны трещинки спайности вдоль длинной оси кристаллов. Соединение оптически двухосное, угол 2υ бо к 90º. Коэффициенты светопреломления: Np = 1,488, Nm = 1,513, Nq = 1.537. В работе [5, с. 645] двухводный ацетата цинка описан как двухосный положительный с углом 2υ = 87º. Коэффициенты светопреломления: Np = 1,432, Nm = 1,492, Nq = 1,553. Таким образом, полученное нами соединение довольно существенно отличается от описанного в литературе. Значительное расхождение наблюдается и в наборе межплоскостных расстояний (таблица 2).
На термограмме водного ацетата цинка эндотермические эффекты отмечены при температурах от 80—100 ºС, 215—235 ºС, 290—330 ºС, а экзотермический эффект при температуре 400 ºС.
В таблице 3 приведены результаты кристаллооптических и рентгенофазовых исследований проб, нагретых при различных температурах, из которых следует, что первый эндоэффект соответствует обезвоживанию соединения. При этом образуются игольчатые изогнутые кристаллы, собранные в спутанно-волокнистые агрегаты. Погасание иголок косое, цвета интерференции до красных. Коэффициенты светопреломления: Np = 1,450, Nq = 1,520. Безводная соль плавится при температуре 235 ºС. Таким образом температура обезвоживания и плавления соответствует литературным данным .
Третий эндотермический эффект соответствует разложению соединения с образованием продукта, который горит при темпертуре 400 ºС (что сопровождается экзоэффектом).
Пробы, прокалённые при температурах выше 300 ºС, состоят только из окиси цинка (таблица 3). Для того, чтобы выяснить характер промежуточного продукта, вызывающего экзотермический эффект, безводный ацетат цинка был нагрет в автоклаве при температуре 350 ºС в течении одного часа.
Таблица 2.
Сравнительные данные межплоскостных расстояний Zn (CH3COO)2*2H2O
|
Наши данные |
В литературе |
Наши данные |
В литературе |
Наши данные |
В литературе |
||||||
|
J/J,% |
d/n, Aº |
J/J,% |
d/n, Aº |
J/J,% |
d/n, Aº |
J/J,% |
d/n, Aº |
J/J,% |
d/n, Aº |
J/J,% |
d/n, Aº |
|
100 |
7,08 |
— |
— |
1 |
2,84 |
13 |
2,85 |
2 |
1,949 |
— |
— |
|
— |
— |
93 |
6,8 |
2 |
2,68 |
17 |
2,7 |
4 |
1,917 |
— |
— |
|
4 |
5,38 |
100 |
5,4 |
2 |
2,5 |
— |
— |
2 |
1,8 |
3 |
1,8 |
|
— |
— |
3 |
5,0 |
3 |
2,41 |
17 |
2,4 |
3 |
1,776 |
— |
— |
|
2 |
4,65 |
27 |
4,7 |
5 |
2,36 |
— |
— |
2 |
1,758 |
— |
— |
|
5 |
4,41 |
83 |
4,45 |
1 |
2,31 |
3 |
2,3 |
3 |
1,707 |
— |
— |
|
7 |
3,96 |
20 |
4,0 |
4 |
2,15 |
7 |
2,14 |
2 |
1,678 |
— |
— |
|
2 |
3,78 |
— |
— |
3 |
2,04 |
7 |
2,04 |
2 |
1,601 |
3 |
1,6 |
|
10 |
3,53 |
27 |
3,58 |
- |
— |
3 |
2,00 |
— |
— |
3 |
1,58 |
|
8 |
3,23 |
27 |
3,28 |
2 |
1,982 |
— |
— |
— |
— |
3 |
1,5 |
|
3 |
3,14 |
— |
— |
— |
— |
7 |
1,96 |
1 |
1,481 |
— |
— |
После охлаждения автоклава до комнатной температуры в нём были обнаружены порошок белого цвета (окись цинка) и жидкая фаза, которая была идентифицирована как ацетон (по запаху, летучести и способности гореть).
Разложение двухводного ацетата цинка при нагревании происходит, таким образом, по следующей схеме:
В данном случае имеет место образование внутримолекулярного активированного комплекса

где усиление поляризующего действия катиона (Zn++ ), особенно с повышением температуры, приводит к ослаблению связи Ме-О внутри ацетата и облегчает его распад. Поэтому термическое разложение ацетата цинка не останавливается на стадии карбоната, а идёт до образования окиси цинка. Предполагаемые разрывы связей С-С, С–О и Ме-О находятся в хорошем согласии с результатами экспериментов.
Таблица 3.
Межплоскостные расстояния дигидрата ацетата цинка, прокалённого при различных температурах
|
50º |
100º |
200º |
230º |
300º |
Zn окись по источ. |
||||||
|
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
|
100 |
7,42 |
100 |
7,44 |
100 |
7,44 |
100 |
7,41 |
— |
— |
— |
— |
|
60 |
7,04 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
— |
— |
2 |
4,65 |
1 |
4,65 |
— |
— |
— |
— |
— |
— |
|
5 |
4.53 |
10 |
4.53 |
10 |
4.53 |
15 |
4.53 |
— |
— |
— |
— |
|
— |
— |
— |
— |
— |
— |
2 |
4,19 |
— |
— |
— |
— |
|
— |
— |
4 |
4 |
5 |
4,00 |
6 |
4 |
— |
— |
— |
— |
|
6 |
3,72 |
10 |
3,71 |
10 |
3,71 |
9 |
3,71 |
— |
— |
— |
— |
|
5 |
3,67 |
11 |
3,65 |
10 |
3,65 |
10 |
3,65 |
— |
— |
— |
— |
|
4 |
3.54 |
— |
— |
— |
— |
— |
— |
|
|
|
|
|
— |
— |
4 |
3,44 |
2 |
3,42 |
8 |
3,43 |
|
|
|
|
|
2 |
3,22 |
2 |
3,26 |
2 |
3,26 |
1 |
3,28 |
|
|
|
|
|
— |
— |
3 |
3,1 |
2 |
3,10 |
2 |
3,10 |
|
|
|
|
|
— |
— |
— |
— |
— |
— |
— |
— |
80 |
2,80 |
71 |
2,81 |
|
3 |
2,72 |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
2 |
2,69 |
3 |
2,69 |
1 |
2,7 |
3 |
2,7 |
— |
— |
— |
— |
|
— |
— |
— |
— |
— |
— |
— |
— |
55 |
2,59 |
56 |
2,6 |
|
— |
— |
1 |
2,51 |
1 |
2,5 |
4 |
2,51 |
— |
— |
— |
— |
|
11 |
2,48 |
1 |
2,47 |
1 |
2,47 |
8 |
2,48 |
100 |
2,46 |
100 |
2,47 |
|
2 |
2,37 |
2 |
2,39 |
1 |
2,36 |
2 |
2,36 |
— |
— |
— |
— |
|
2 |
2,27 |
3 |
2,28 |
2 |
2,27 |
2 |
2,.27 |
— |
— |
— |
— |
|
1 |
2,21 |
1 |
2,19 |
1 |
2,21 |
2 |
2,21 |
— |
— |
— |
— |
|
2 |
2,05 |
2 |
2,06 |
1 |
2,06 |
3 |
2,05 |
— |
— |
— |
— |
|
— |
— |
2 |
2,01 |
1 |
1,998 |
1 |
1,993 |
— |
— |
— |
— |
|
— |
— |
— |
— |
— |
— |
— |
— |
35 |
1,904 |
29 |
29 |
|
— |
— |
1 |
1,784 |
1 |
1,78 |
1 |
1,78 |
— |
— |
— |
— |
|
— |
— |
1 |
1,616 |
2 |
1,612 |
2 |
1,613 |
50 |
1,619 |
40 |
1,626 |
|
— |
— |
— |
— |
— |
|
|
|
40 |
1,472 |
35 |
1,477 |
|
|
|
|
|
|
|
|
|
10 |
1,402 |
6 |
1,407 |
|
|
|
|
|
|
|
|
|
35 |
1,374 |
28 |
1,379 |
Список литературы:
1.Пантелеев И.А., Семёнов С.Г., Глебовский Д.Н. Природа мостиковых связей в диамерах ацетатов лития и калия // ЖОХ. — 2005. — т. 75, — вып. 9. — 1479—1484 с.
2.Пантелеев И.А., Семёнов С.Г., Глебовский Д.Н. Проявление особенностей элементов первой группы периодической системы в свойствах и их стеклообразных солей в мезофазе. Труды // научной сессии УНЦХ СПБГУ, СПб. 27—28 0ктября. 2004. — с. 325—326.
3.Рубинштейн А.М., Якерсон В.И. Процессы кетонизации и разложения ацетатов щелочных металлов // Кинетика и катализ — 1960. — Вып. 30. — 2789 с.
4.Якерсон В.И., Рубинштейн А.М. Процессы кетонизации и разложения ацетатов щелочных металлов // Кинетика и катализ — 1960. — Вып. 2. — 1961. — 181 с.
5.Mt. Crone W.C. and Kre.J. // Analytical chemistry — 1945. — 21 — Вып. 5. — 645 с.
дипломов


Оставить комментарий