Статья опубликована в рамках: VII Международной научно-практической конференции «Наука вчера, сегодня, завтра» (Россия, г. Новосибирск, 11 декабря 2013 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ВЛИЯНИЕ ВНЕКЛЕТОЧНЫХ МЕТАБОЛИТОВ МИКОФИЛЬНОГО ГРИБА HYPOMYCES ROSELLUS НА РОСТ И РАЗВИТИЕ РАСТЕНИЙ ПШЕНИЦЫ
Буракаева Айгуль Дикатовна
канд. биол. наук, доцент НОУ ВПО МТИ «ВТУ» Филиал в г. Оренбурге, РФ, г. Оренбург
E-mail: aigulburakaeva@mail.ru
Все этапы роста и развития растений находятся под гормональным контролем. В результате искусственного введения регуляторов роста можно в целом повысить урожайность сельскохозяйственных культур [7, c. 366].
Свойства микроскопических грибов образовывать в среде культивирования фитогормоны и гормоноподобные вещества наряду с другими биологически активными соединениями (антибиотиками, аминокислотами, витаминами, ферментами, органическими кислотами) широко используется при создании микробиологических препаратов [11, с. 135].
Микофильные грибы рода Hypomyces, помимо перспективы их использования в качестве естественных антагонистов фитопатогенных грибов, представляют несомненный научный и практический интерес как продуценты биологически активных соединений [3, c. 323; 5, с. 20].
Целью исследований явилось определение фитотоксичности и степени гормональной активности физиологически активной культуральной жидкости Hypomyces rosellus на рост и развитие растений.
Материал и методы исследований.
В экспериментах использовали семена сортов мягкой яровой пшеницы Башкирская 26, твердой яровой пшеницы Харьковская 46 и огурцов сорта Нежинский 12. Семена получены из Башкирского НИИ сельского хозяйства и семенного комплекса Оренбургского аграрного колледжа.
Штамм Hypomyces rosellus штамм ВКПМ F-242 выращивали в глубинных условиях на питательной среде в течение трех суток. Состав питательных сред и способ культивирования гриба описаны нами ранее [9, с. 411; 10, с. 99]. Затем мицелий отделяли фильтрацией и готовили следующие разведения культуральной жидкости (к/ж): 0,1 %, 0,01 %, 0,001 %.
Наличие ауксинов определяли с помощью биотестов, предложенных А.Н. Бояркиным (1966) по приросту колеоптилей, выращенных в растворах культуральной жидкости и индолилуксусной кислоты [4, с. 20]. О содержании в культуральной жидкости гиббереллиноподобных веществ судили по удлинению гипокотиля проростков огурцов [1, с. 1037].
Определение фитотоксичности культуральной жидкости и соответствующих её разведений проводили согласно методу, предложенному Н.А. Красильниковым (1966) [8, c. 178]. Для этого семена предварительно промывали водопроводной и дистиллированной водой, затем по 50 штук раскладывали в подготовленные чашки Петри с фильтровальной бумагой и замачивали растворами различной концентрации культуральной жидкости, контрольные варианты соответствующим объемом питательной среды. Чашки Петри закрывали крышками и ставили в термостат при температуре 25 °С на 24 часа. По истечении суток семена снова промывали водопроводной и дистиллированной водой, вновь раскладывали в чашках Петри на фильтровальной бумаге, заливали дистиллированной водой и оставляли в растительной камере при 25 0С, создавая в ней увлажненную атмосферу. Вегетационные эксперименты проводили в строго контролируемых одинаковых условиях [2, c. 184]. Для этого сосуды наполняли 3 кг сырой лесной легко суглинистой почвой с посевной площадью 314 см2 , рН=6,0—6,2. Растения выращивали при комнатной температуре и круглосуточном освещении люминесцентными лампами, влажность почвы поддерживали в пределах 60 % полной влагоемкости. В процессе динамики роста и развития растений определяли энергию прорастания семян, высоту растения, длину и объем корневой системы. Все опыты закладывали в четырехкратной повторности и повторяли не менее трех раз. Результаты обрабатывали статистически [6, с. 30].
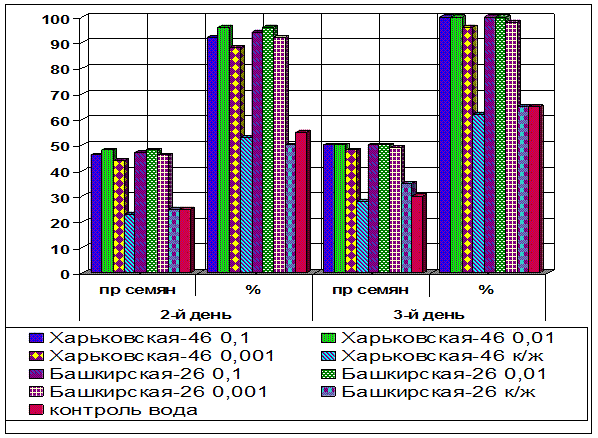
Рисунок 1. Влияние различной концентрации к/ж на прорастание семян пшеницы
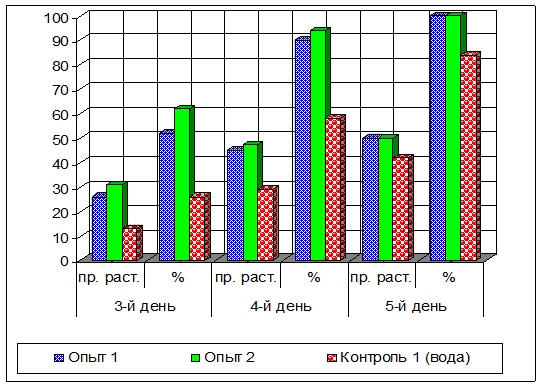
Рисунок 2. Влияние предпосевной обработки на энергию прорастания семян пшеницы Харьковской 46 (опыт 1)и Башкирской 26(опыт 2)
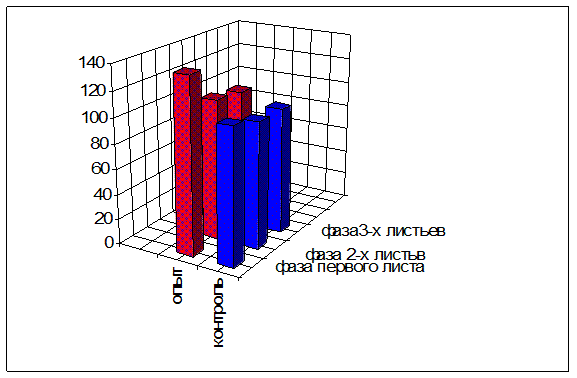
Рисунок 3. Влияние предпосевной обработки семян на высоту растений пшеницы сорта Башкирская 26
Результаты и обсуждение
Как показали результаты, культуральная жидкость Hypomyces rosellus не является токсичной для растений пшеницы, даже при определенных концентрациях оказывает стимулирующее воздействие. Наиболее эффективными для прорастания семян, в условиях данного опыта, оказались разведения культуральной жидкости 0,1 % и 0,01 %. Особенно большие различия отмечали на третьи сутки, в этом случае количество проросших семян составило 100 %, а в контроле оно не превышало 85 % (рисунок 1).
Проведенные эксперименты по определению гормональной активности различных концентраций культуральной жидкости дают основание предполагать, что разведение культуральной жидкости 0,01 % соответствует 0,05 мг/л индолилуксусной кислоты и 0,01 мг/л гиббереллиновой кислоты.
В дальнейшем при проведении вегетационных опытов о влиянии 0,01 % культуральной жидкости микофильного гриба на рост и развитие растений пшеницы судили по энергии прорастания семян, высоте стебля, длине и объеме корневой системы. Энергия прорастания семян в опытных вариантах в два раза превышала контрольные (рисунок 2). Более дружные всходы опытных растений пшеницы в дальнейшем росли быстрее и достигали больших размеров (рисунок 3). В фазе трех листьев общий вес растений достигал 230±0,17 мг, длина корня 73,7±0,11 мм и объем корневой системы 0,122±0,09 мг. В контрольных вариантах эти показатели были ниже и составляли 203±0,12 мг, 69,7±0,15 мм и 0,114±0,01 мг соответственно.
На основании проведенных экспериментов можно судить о том, что культуральная жидкость микофильного гриба Hypomyces rosellus при определенных концентрациях оказывает благоприятное воздействие на прорастание семян и в целом на рост и развитие растений пшеницы. Возможно, что стимулирующий эффект обусловлен наличием в культуральной жидкости гриба антибиотика с фунгицидным и антибактериальным спектром действия и присутствием других физиологически активных соединений Полученные результаты могут представлять научный и практический интерес как средство управления жизнедеятельностью растений.
Список литературы:
1.Агнистикова В.Н., Дубовая Л.П., Лекарева Т.А., Лупова Л.И., Муромцев Г.С., Кучеров В.Ф., Серебряков Э.П. Гиббереллины и гиббереллиноподобные вещества из культуральной жидкости Fusarium monilliforme // Микробиология. — 1966. — т. 35. — Вып. 6. — С. 1037—1043.
2.Баславская С.С., Трубецкова О.М. Практикум по физиологии растений. М.: Изд-во МГУ. 1964. — 328 с.
3.Буракаева А.Д., Карпова Г.В. Новый антифунгальный антибиотик, продуцируемый Hypomyces rosellus и фенотипически близкими штаммами //Вестник Оренбургского государственного университета. — 2011. — № 12 (131). — С. 323—324.
4.Кефели В.И., Турецкая Р.Х. Определение свободных ауксинов и ингибиторов роста в растительном материале // Методы определения регуляторов роста и гербицидов: сб. науч. тр. Москва. 1966. — С. 20—43.
5.Лернер Л.Е. Биологическая активность микофильных грибов и их взаимодействие с грибами в культуре: автореф. дис...канд.биол.наук. М., 1977, — 22 с.
6.Плохинский Н.А. Алгоритмы биометрии. М.: Изд-во МГУ. 1980. — 150 с.
7.Полевой В.В. Физиология растений: учеб. для биол. спец. вузов М: Высшая школа,1989. — 464 с.
8.Сэги Йожев Методы почвенной микробиологии: пер. с венг./под ред. Г.С. Муромцева. М.:Колос, 1983. — 296 с.
9.Торопова Е.Г., Максимов В.Н., Береснева Г.Г., Егоров Н.С., Буракаева А.Д. Оптимизация состава среды для биосинтеза антибиотика, протеаз и пигментов микофильным грибом Hypomyces rosellus с помощью метода математического планирования эксперимента //Антибиотики и медицинская биотехнология. — 1986. — № 6. — С. 408—411.
10.Торопова Е.Г., Мардамшина А.Д. (Буракаева), Писункова Н.Ф. Подбор посевных сред, возраста и количества мицелия, обеспечивающих одновременный биосинтез антибиотика и пигмента у гриба Hypomyces rosellus //Антибиотики и химиотерапия. — 1988. — Т. XXXIII. — № 2. — С. 96—99.
11.Цавкелова Е.А., Климова С.Ю., Чердынцева А.И., Нетрусов А.И. Микроорганизмы — продуценты стимуляторов роста растений и их практическое применение//Прикладная биохимия и микробиология. — 2006. — т. 42. — С. 133—143.
дипломов


Оставить комментарий