Статья опубликована в рамках: XXXVI-XXXVII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 07 декабря 2015 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ТРЁХКОМПОНЕНТНЫЕ РЕАКЦИИ 1,3,4,6-ТЕТРАКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ С АРИЛАМИНАМИ И КЕТОНАМИ ИЛИ АРОМАТИЧЕСКИМИ АЛЬДЕГИДАМИ
Козьминых Владислав Олегович
д-р хим. наук, профессор, зав. кафедрой химии
Пермского государственного гуманитарно-педагогического университета,
РФ, г. Пермь
E-mail: kvoncstu@yahoo.com
Муковоз Пётр Петрович
канд. хим. наук, преподаватель
Оренбургского филиала Московского технологического института,
РФ, г. Оренбург
THREE COMPONENT REACTIONS OF 1,3,4,6-TETRACARBONYL COMPOUNDS WITH ARYLAMINES AND KETONES OR AROMATIC ALDEHYDES
Vladislav Kozminykh
doctor of Chemical Sciences, Professor, Head of the Chemical Section
of the Perm State Humanitarian Pedagogical University,
Russia, Perm
Peter Mukovoz
candidate of Chemical Sciences, Teacher
of the Orenburg Division of Moscow Technological Institute,
Russia, Orenburg
АННОТАЦИЯ
Систематизированы сведения, проведён анализ данных и представлена новая информация о взаимодействии 1,3,4,6-тетракарбонильных соединений с азометинами или их синтетическими предшественниками – ариламинами и ароматическими альдегидами или кетонами. Описан альтернативный реакциям с азометинами трёхкомпонентный однореакторный синтез разнообразных производных пиррола, обсуждаются особенности строения этих соединений.
ABSTRACT
The known data are reviewed and analysed, and new information about the reaction of 1,3,4,6-tetracarbonyl compounds with azomethines or aryl amines and aromatic aldehydes or ketones as their synthetic precursors is presented. The three component one-pot synthesis of various pyrrole derivatives, being alternative to azomethine reactions, is described. The structure features of these compounds are discussed.
Ключевые слова: 1,3,4,6-тетракарбонильные соединения; азометины; амины; альдегиды; кетоны; трёхкомпонентные реакции; производные пиррола.
Keywords: 1,3,4,6-tetracarbonyl compounds; azomethines; amines; aldehydes; ketones; three component reactions; pyrrole derivatives.
Ранее нами был опубликован краткий обзор литературных данных и обсуждались результаты современных исследований по взаимодействию 1,3,4,6-тетракарбонильных соединений (ТКС) и близких полиоксо-систем с аминами, азометинами (основаниями Шиффа) и азинами [8]. В этой же работе были изложены некоторые предварительные результаты изучения реакций ТКС непосредственно с эквимолярной смесью синтетических предшественников оснований Шиффа – аминов и альдегидов или кетонов [8]. Наряду с известными данными, не вошедшими в обзор [8], приводим новые сведения о химических превращениях ТКС и их карбонильных аналогов при действии некоторых из указанных реагентов.
Целью настоящей работы является обобщение литературных данных и материалов исследований, а также анализ сведений о взаимодействии ТКС с азометинами, химических превращениях в трёхкомпонентных системах: ТКС – амины – альдегиды (кетоны) и строении продуктов этих реакций.
Имеется информация о том, что диэтоксалилацетон (1: таутомеры 1A и 1B – последний преобладает) взаимодействует с арилиденариламинами (или смесью ароматических альдегидов и ариламинов), образуя в зависимости от соотношения реагентов 3-замещённые 4-гидрокси-5-пирролиноны – эфиры (2) [1; 18] или енаминоэфиры (3) (рис. 1), которые обладают выраженным противовирусным действием. Необычным, однако, выглядит отсутствие опубликованных сведений об образовании вероятных 3,3'-бис-пирролинонов в ходе данной реакции. Основываясь на собственном опыте изучения подобных реакций ТКС (см. ниже) следует ожидать гораздо большего разнообразия продуктов этих превращений. Описана также гетероциклизация соединений (2) в условиях кислотного гидролиза [18].
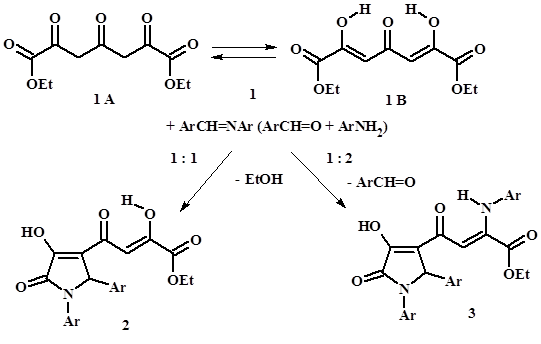
Рисунок 1. Гетероциклизация диэтоксалилацетона (1) при действии арилиденариламинов
В работе [8] сообщалось о несоответствии структуры 4-гидроксипроизводных 3,4-дигидро-2H-1,3-оксазин-4-она (4), которая ранее придавалась продуктам взаимодействия 1,6-диарил-1,3,4,6-гексантетраонов (5: таутомеры 5A и 5B, R1 = R2 = Ar) с арилиденариламинами [2; 5; 6; 13] (рис. 2). Однако в недавно вышедших публикациях С.С. Зыковой с соавторами [3; 4; 12] эта же структурная ошибка повторяется, что вынуждает нас вновь обратиться к доводам по поводу выделенных продуктов. Считаем важным снова отметить, что и химическая часть работ [6; 12], и результаты биологического скрининга [2–6; 12; 13] не вызывают доверия. Приводимые в публикациях соединения (4), как выяснилось, являются тетракетонами (5), исходно вовлечёнными в синтез, но вновь выделенными в недостаточно очищенном виде (реакция в описанных условиях не была завершена). Об этом, в частности, свидетельствуют температуры плавления и приборные характеристики (ИК, ЯМР 1H, масс-спектры) выделенных веществ [6; 12], которые по сути являются сходными, учитывая низкую степень чистоты соединений, с таковыми 1,6-диарилзамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов (5) (для сравнения см., например, данные в обзоре [7]). Как следствие, все сведения о биологической активности описываемых соединений (4) – антигипоксической [2; 3], противомикробной [5], антиоксидантной [4; 6; 12; 13] – должны относиться именно к загрязнённым исходным тетракетонам (5), но не соответствуют декларируемой структуре оксазинов (4). Добавим, что критические замечания по структуре (4) изложены нами не только в обзоре [8], но и в работах [14; 16].
Трёхкомпонентные реакции ТКС с аминами и альдегидами или кетонами до наших исследований не изучались. О предварительных не опубликованных к тому времени результатах этих исследований вкратце сообщалось в обзоре [8]. Однореакторное вовлечение ариламинов и ароматических альдегидов или кетонов (например, ацетона) как синтетических предшественников азометинов во взаимодействие с 1,6-дизамещёнными 3,4-дигидрокси-2,4-гексадиен-1,6-дионами (5) приводит к образованию разнообразных оксо(гидрокси) функционализованных структур на основе пиррола. Таким образом, нами предлагаются новые методы синтеза этих соединений, и некоторые результаты исследований обсуждаются в настоящей статье.
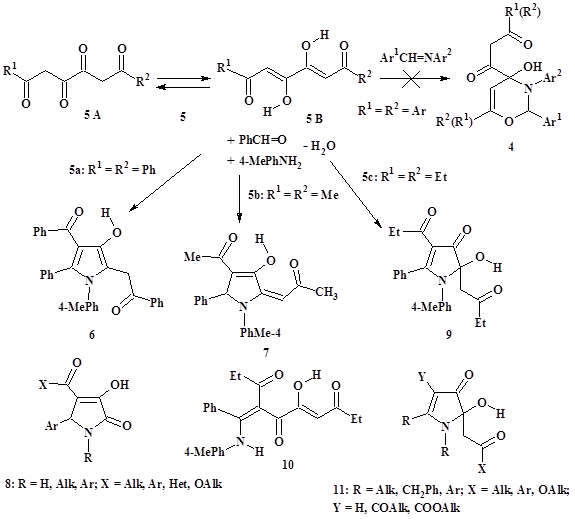
Рисунок 2. Синтез производных пиррола (6, 7, 9) на основе трёхкомпонентных реакций 1,6-дизамещённых 1,3,4,6-тетракарбонильных соединений (5: R1 = R2 = Alk, Ph) с п-толуидином и бензальдегидом, структуры для сравнения
Рассеивая известные сомнения, в результате трёхкомпонентной реакции 1,6-дифенил-1,3,4,6-гексантетраона (5a: R1 = R2 = Ph; сведения о его синтезе – см. обзор [7]) с п-толуидином и бензальдегидом выделен не соответствующий оксазинон (4: R1 = R2 = Ph), а замещённый 3-гидроксипиррол (6) (табл. 1) [15, 16]. Строение соединения (6) установлено на основании данных ИК, ЯМР 1H спектроскопии, масс-спектрометрии и рентгеноструктурного анализа (РСА) [15; 16] (рис. 2).
В результате проводимой в мягких условиях однореакторной конденсации 4,5-дигидрокси-3,5-октадиен-2,7-диона (5b: R1 = R2 = Me; данные о его синтезе см. в работах [7; 19]) с п-толуидином и бензальдегидом получено 2-оксопропилиденпроизводное 3-гидроксипирролина (7) [16] (рис. 2, табл. 1). Соединение (7) можно рассматривать как оксоилиденовый аналог препаративно доступных 3-гидрокси-1,5-дигидро-2H-пиррол-2-онов (8), обладающих широким спектром биологического действия [8; 18]. Высокая вероятность проявления фармакологической активности аналогом (8) подчёркивает перспективность химических и биологических исследований соединений близкого ряда илиденпирролинов, представленного на примере соединения (7).
Ожидаемое химическое разнообразие производных пиррола, образующихся при конденсации, подтверждается трёхкомпонентным синтезом 2-гидрокси-3-пирролинона (9), региоизомерного по положению гидроксильной группы соединениям (6) и (7). Продукт (9) получен исходя из эквимолярных количеств взаимодействующих 5,6-дигидрокси-4,6-декадиен-3,8-диона (5c: R1 = R2 = Et; данные о его синтезе приведены в обзоре [7]), п-толуидина и бензальдегида [16] (рис. 2, табл. 1). В отличие от пирролов (6), (7), имеющих енольную гидроксильную группу, в соединении (9) присутствует качественно иной O,N-полуацетальный гидроксил, определяющий своеобразие его структуры. Гидроксипирролинон (9) представлен стабилизированной пиррольным кольцом формой линейного енаминопроизводного ТКС (10), не отмеченного в спектрах и не выделенного индивидуально. Соединение (9) оказалось устойчивым к дегидратации, что не часто встречается у классических полуацеталей, но известно для некоторых гетероциклических производных (см., например, статьи [9; 10]).
Особенности строения соединений (7) и (9) описаны по данным ИК, ЯМР 1H спектроскопии, масс-спектрометрии высокого разрешения и РСА [16]. Схемы предполагаемого механизма образования пирролов (6), (7) и (9) приводятся и обсуждаются в работе [16].
Способ получения соединения (9) является удобным и простым по сравнению с более трудоёмкими методами синтеза гидроксипирролинонов этого ряда (11) [10; 11; 20], в том числе биологически активных [11; 20]. Обсуждению своеобразных по строению и свойствам кольчатых полуацеталей (9), (11) и подобных им соединений планируется посвятить отдельную статью.
В результате однореакторного взаимодействия ТКС, имеющих терминальные сложноэфирные группы, – 3,4-дигидрокси-2,4-алкадиеноатов (5: таутомеры 5A и 5B, последний преобладает; R1 = Alk, R2 = OAlk; R1 = OAlk, R2 = Alk; R1 = R2 = OAlk) с п-толуидином и ацетоном с невысоким выходом получены замещённые 4-гидрокси-5-(2-оксоэтилиден)-2,5-дигидро-1H-пирролы (12a-k) [14; 17] (рис. 3, табл. 1).
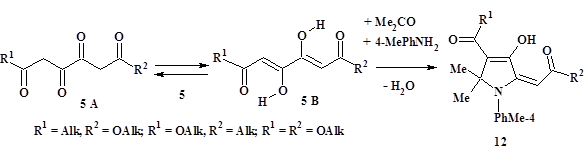
Рисунок 3. Трёхкомпонентная конденсация 1,3,4,6-тетракарбонильных соединений, имеющих терминальные сложноэфирные группы (5: R1 / R2 = Alk, OAlk), с п-толуидином и ацетоном в синтезе 2-оксоэтилиденпроизводных 2,5-дигидро-1H-пиррола (12)
В твёрдом состоянии и растворах эфиры (12) представлены (E)-изомерами по 2-илиденовому звену, другие детали их строения установлены на основании данных ИК, ЯМР 1H спектроскопии и РСА и обсуждаются в работах [14; 17]. Характерным отличительным признаком реакции с участием исходных триоксоэфиров (5: R1 = R2 = OAlk) является отсутствие хемоселективности. Так, в результате с сопоставимыми, хотя и низкими, выходами нами выделены четыре пары региоизомерных гидроксипирролинов (12a и 12e, 12b и 12i, 12c и 12f, 12d и 12g) [17] (табл. 1). Отметим, что соединения (12) имеют структурную аналогию с хорошо известными биологически активными 2-пирролинонами (8) [8, 18] (рис. 2), что может быть стимулом для их дальнейшего изучения.
Таблица 1.
Матрица характеристик производных пиррола (6), (7), (9), (12a-k)
|
|
|
|
|
||||
|
Соединение |
R1 |
R2 |
Т. пл., °С |
Выходы, % |
Литературные источники |
||
6 |
– |
– |
175–177 |
74 |
[15, 16] |
||
7 |
– |
– |
167–170 |
69 |
[16] |
||
9 |
– |
– |
125–127 |
57 |
[16] |
||
12a |
CH3 |
OCH3 |
135–137 |
10 |
[17] |
||
12b |
CH3 |
OC2H5 |
142–144 |
12 |
[17] |
||
12c |
C2H5 |
OCH3 |
130–132 |
8 |
[17] |
||
12d |
н-C3H7 |
OCH3 |
128–130 |
9 |
[17] |
||
12e |
OCH3 |
CH3 |
230–231 |
13 |
[17] |
||
12f |
OCH3 |
C2H5 |
190–193 |
7 |
[17] |
||
12g |
OCH3 |
н-C3H7 |
157–159 |
11 |
[17] |
||
12h |
OCH3 |
OCH3 |
150–152 |
52 |
[14] |
||
12i |
OC2H5 |
CH3 |
150–152 |
14 |
[17] |
||
12j |
OC2H5 |
OC2H5 |
148–150 |
63 |
[14] |
||
12k |
OC3H7-н |
OC3H7-н |
86–88 |
37 |
[14] |
||
Таким образом, подведены предварительные итоги исследований и представлен краткий анализ данных по реакциям 1,3,4,6-тетракарбонильных соединений и некоторых оксо-аналогов с азометинами и их синтетическими предшественниками – ариламинами (на примере п-толуидина) и ароматическими альдегидами (бензальдегид) или метилкетонами (ацетон). Описаны особенности трёхкомпонентного однореакторного синтеза, отмечены детали строения продуктов реакций – разнообразных производных пиррола.
Список литературы:
- Андрейчиков Ю.С., Гейн В.Л., Коньшина Л.О., Шапетько Н.Н. Синтез 1,4-дизамещённых 5-арилтетрагидропиррол-2,3-дионов на основе взаимодействия диэтоксалилацетона с азометинами // Журнал органической химии. – 1989. – Т. 25. – № 12. – С. 2494–2500.
- Зыкова С.С. Антигипоксическая активность 6-арил-4-гидрокси-5,6-дигидро-4H-1,3-оксазинов // Вестник современной клинической медицины. – 2014. – Т. 7. – № 2. – С. 70–73.
- Зыкова С.С., Балыбердин А.О., Шарапова Ю.С. 3-Замещённые 2H-1,3-оксазины – перспективные объекты для поиска антигипоксантов // Международный студенческий научный вестник. Пенза: изд-во "Информационно-технический отдел Академии Естествознания". – 2015. – № 2–3. – С. 399–401.
- Зыкова С.С., Даровских А.А., Карманова О.Г., Игидов Н.М., Загулова Д.В. Синтез и биологическая активность некоторых продуктов реакций 1,3,4,6-тетракарбонильных соединений с бинуклеофилами // Научное обозрение. – 2015. – № 14. – С. 255–261.
- Зыкова С.С., Одегова Т.Ф. Микробиологические характеристики новых продуктов синтеза 1,6-диарил-3,4-дигидрокси-2,4-гексадиен-1,6-диона с арилиденариламинами // Вопросы биологической, медицинской и фармацевтической химии. – 2014. – Т. 12. – № 2. – С. 37–41.
- Зыкова С.С., Одегова Т.Ф., Бойчук С.В., Галембикова А.Р. Синтез и фармако-токсикологические характеристики 3-замещённых 3-гидрокси-6-фенил-3,4-дигидро-2H-1,3-оксазинов // Химико-фармацевтический журнал. – 2014. – Т. 48. – № 11. – С. 10–14.
- Козьминых В.О., Гончаров В.И., Козьминых Е.Н. Конденсация Клайзена метилкетонов с диалкилоксалатами в синтезе биологически активных карбонильных соединений (обзор, часть 3) // Вестник Оренбургского гос. ун-та. – Оренбург, 2007. – Вып. 5 (69). – С. 138–148.
- Козьминых В.О., Муковоз П.П. Новые представления о взаимодействии 1,3,4,6-тетракарбонильных систем с азометинами, краткий обзор реакций с аминами и азинами // Приволжский научный вестник. Научно-практический журнал. Ижевск: изд-во "Издательский Центр Научного Просвещения", май 2015. – № 5-1 (45). – С. 33–43.
- Козьминых В.О., Муковоз П.П. Устойчивые полуацетали на основе 2H-1,4-бензоксазинов – продукты реакции некоторых 1,3,4,6-тетракарбонильных соединений с 2-аминофенолами // Инновации в науке. Сборник статей по материалам LI международной заочной науч.-практ. конф., Новосибирск, 30 ноября 2015 г. – Новосибирск: изд-во "СибАК", 2015 (в печати).
- Козьминых Е.Н., Армагинова В.Г., Шавкунова Г.А., Игидов Н.М., Березина Е.С., Козьминых В.О. Взаимодействие 5-арил-2,3-дигидро-2,3-фурандионов с эфирами b-аминокротоновой и 2-ариламино-4-оксо-2-бутеновой кислот // Журнал органической химии. – 1997. – Т. 33. – № 2. – С. 256–259.
- Козьминых Е.Н., Игидов Н.М., Шавкунова Г.А., Яковлев И.Б., Шеленкова С.А., Колла В.Э., Воронина Э.В., Козьминых В.О. 1,3,4,6-Тетракарбонильные соединения. 2. Синтез биологически активных 2-гидрокси-2,3-дигидро-3-пирролонов и замещённых амидов ароилпировиноградных кислот // Химико-фармацевтический журнал. – 1996. – Т. 30. – № 7. – С. 31–35.
- Лапин А.А., Зыкова С.С., Любосеев В.Н. Сравнительная оценка тестов определения антиоксидантной активности на примере биологически активных 3-замещённых 3-гидрокси-6-фенил-3,4-дигидро-2H-1,3-оксазинов // Бутлеровские сообщения. – 2014. – Т. 39. – № 10. – С. 127–134.
- Любосеев В.Н., Неселевский С.М., Зыкова С.С. Изучение антиоксидантной активности соединений на основе некоторых реакций тетракетонов с основаниями Шиффа // Успехи современного естествознания. – 2013. – № 8. – С. 19.
- Муковоз П.П., Козьминых В.О., Андреева В.А., Ельцов О.С., Слепухин П.А., Козьминых Е.Н. Способ получения и строение эфиров (5E)-4-гидрокси-5-(2-алкокси-2-оксоэтилиден)-2,2-диметил-1-(4-метилфенил)-2,5-дигидро-1H-пиррол-3-карбоновых кислот // Журнал органической химии. – 2015. – Т. 51. – № 6. – С. 877–879.
- Муковоз П.П., Козьминых В.О., Горбунова А.В., Слепухин П.А., Ганебных И.Н., Ельцов О.С. Трёхкомпонентный синтез и строение 4-бензоил-2-(3-гидрокси-1-(4-метилфенил)-5-фенил-1H-пиррол-2-ил)-1-фенилэтанона // Инновационные процессы в области естественнонаучного и социально-гуманитарного образования. Материалы III Международной науч.-практ. конф. Оренбург, Оренбургский гос. педагогический университет, 17–18 марта 2016. – Оренбург, 2016 (в печати).
- Муковоз П.П., Козьминых В.О., Козьминых Е.Н., Горбунова А.В., Слепухин П.А., Ганебных И.Н., Ельцов О.С. Особенности взаимодействия 1,3,4,6-тетракетонов с п-толуидином и бензальдегидом // Журнал органической химии. – 2016 (в печати).
- Муковоз П.П., Слепухин П.А., Козьминых В.О., Андреева В.А., Ельцов О.С., Ганебных И.Н., Козьминых Е.Н. Особенности реакции эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот с ацетоном и п-толуидином // Журнал общей химии. – 2015. – Т. 85. – № 12. – С. 1983–1988.
- Перевалов С.Г., Бургарт Я.В., Салоутин В.И., Чупахин О.Н. (Гет)ароилпировиноградные кислоты и их производные как перспективные "строительные блоки" для органического синтеза // Успехи химии. – 2001. – Т. 70. – № 11. – С. 1039–1058.
- Тарасова В.А., Кузьмин А.В., Муковоз П.П., Козьминых В.О. Синтез и особенности строения 4,5-дигидрокси-3,5-октадиен-2,7-диона // Башкирский химический журнал. – 2014. – Т. 21. – № 4. – С. 15–19.
- Kozminykh V.O., Igidov N.M., Kozminykh E.N., Semenova Z.N., Andreichikov Yu.S. Synthesis and antimicrobial activity of new 5-aryl-2-hydroxy-3(2H)-pyrrolinone derivatives // Pharmazie. – 1992. – Bd. 47. – № 4. – S. 261–263.
дипломов


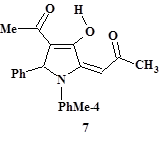
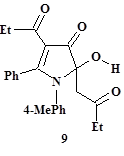
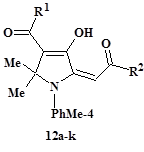
Оставить комментарий