Статья опубликована в рамках: XVIII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 06 мая 2014 г.)
Наука: Химия
Секция: Медицинская химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
НЕЙРОСЕТЕВОЙ АНАЛИЗ ИНДИКАТОРОВ ОКСИДАТИВНОГО СТРЕССА ПРИ КАНЦЕРОГЕНЕЗЕ
Садвакас Айман Садвакасовна
старший научный сотрудник Научной клинико-диагностической лаборатории Казахского Национального Медицинского Университета им. С.Д. Асфендиярова, Республика Казахстан, г. Алматы
E -mail: aiman.sadvakas@gmail.com
NEURAL NETWORK ANALYSIS OF INDICATORS OF OXIDATIV STRESS IN CARCINOGENESIS
Aiman Sadvakas
senior Research Associate of Scientific clinical diagnostic laboratory of Kazakh National Medical University named after S. Asfendiyarov , Republic of Kazakhstan Almaty
АННОТАЦИЯ
Цель: Определение степени корреляционной зависимости изменений производных гемоглобина в зависимости от стадии протекания канцерогенеза у 50 онкологических больных. Проводился анализ крови на анализаторе газов и кислотно-щелочного состояния. В результате исследования были получены данные об изменении фракций гемоглобина в зависимости от стадии канцерогенеза. При I и II стадии канцерогенеза результатом ответа на тканевую гипоксию является снижение сродства гемоглобина к кислороду. В дальнейшем повреждаются дыхательные функции гемоглобина.
ABSTRACT
Aim: To define the degree of correlation dependence the changes in a range of hemoglobin derivatives depending on the stage of carcinogenesis in 50 cancer patients. Blood gas analysis was carried out and the alkaline status was obtained. The data confirmed the change of fractions of hemoglobin depending on the stage of malignancy. In the first and second stage of carcinogenesis, there is a decrease in the affinity of hemoglobin to oxygen, which results in tissue hypoxia. There are conformational changes to the structure of hemoglobin due to an imbalance of its fraction in the different stages of carcinogenesis.
Ключевые слова: нейросетевой анализ; фракции гемоглобина; канцерогенез; тканевая гипоксия; оксидативный стресс.
Keywords: neural network analysis; hemoglobin fractions; carcinogenesis; tissue hypoxia; oxidative stress.
В последнее время в вычислительных технологиях интенсивно развивается область исследования с помощью нейронных сетей, которые выполняют функции искусственного интеллекта путем реализации интеллектуальных вычислительных систем. С математической точки зрения нейронные сети осуществляют многопараметрическую задачу нелинейной оптимизации, а с точки зрения вычислительной техники нейронные сети решают проблемы эффективного параллелизма. Возможность обучения - одно из главных преимуществ нейронных сетей перед традиционными алгоритмами, так как в процессе обучения нейронная сеть способна выявлять сложные зависимости между входными и выходными данными с последующим их обобщением. Неслучайно в виду этих особенностей нейронные сети находят в последнее время широкое применение в различных областях науки, в том числе и в медицине.
Многочисленными исследованиями доказано, что развитие канцерогенеза во многих случаях может быть инициировано механизмами оксидативного стресса в результате значительного дисбаланса между свободными радикалами и антиоксидантами. Спектр свободных радикалов, ответственных за биологическую кислородную токсичность, включает такие промежуточные звенья неполного восстановления кислорода, как супероксидный радикал (O2▪), перекись водорода (H2O2), гидроксильные радикалы (HO▪), радикальный пероксид (ROO▪), оксид азота (NO), пероксинитрит (ONOO¯) и синглетный кислород (1O2) [3, с. 290].
Свободнорадикальное окисление является основным фактором активации перекисного окисления липидов (ПОЛ) в мембранах в результате цепной реакции воздействия радикалов HO▪ и RO▪:
R1H + R▪ → R1▪ + RH
R▪ + O2 → ROO
R1H + ROO¯ → R1▪ + ROOH
Эти реакции приводят к окислительному разрушению липидов, в результате чего повреждается ДНК и инактивируются ферменты [2, с. 2588].
Из-за способности перемещать электроны значительную роль в образовании свободных радикалов играют состояния переходов валентности металлов. Например, переход валентности железа Fe, известный как реакция Хабер-Вейсса или химия Фентона, является токсичным из-за продукции радикальных гидроксилов [4, с. 768]:
Fe 3+ + O2¯ → Fe 2+ + O2
Fe 2+ + H2O2 → ▪OH + OH¯
Как известно, железо Fe с валентностью (II) содержится в гетероциклическом кольце порфирина, который входит в состав гемоглобина. Поэтому специфическая функция гемоглобина, как переносчика кислорода, непосредственно связана с его молекулярной структурой (рис. 1).
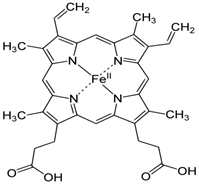
Рисунок 1. Структура гемоглобина
По разным лигандам, присоединяемым к гетероциклическому кольцу, различаются также и формы гемоглобина. Если присоединяется кислород, то такая форма гемоглобина называется оксигемоглобин (HbO2), а если она свободна, то это — дезоксигемоглобин (НHb). Кислород в HbO2 может заменяться и другими нейтральными лигандами, такими как СO и NO. Эти формы соответственно называются — карбоксигемоглобин (HbСО), нитрозогемоглобин (HbNO). В перечисленных формах валентность железа обычно не меняется (рис. 2) [1, с. 56].
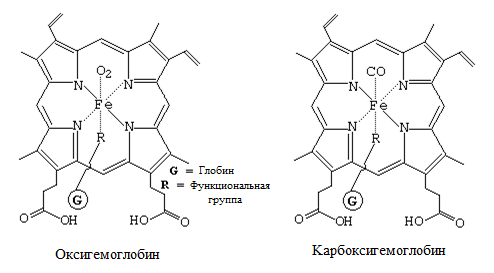
Рисунок 2. Валентность железа Fe2+ не меняется
Однако железо (II) в гемоглобине может окисляться до трехвалентного (III) состояния с образованием метгемоглобина (MetHb), не способного переносить кислород. В нормальных условиях в крови обычно содержатся незначительные количества метгемоглобина. При развитии же оксидативного стресса (рис. 3) и взаимодействии со свободными радикалами содержание метгемоглобина значительно повышается [6, с. 156]:
HbO2 + NO2- → MetHb + O22- + NO2
HbO2 + NO2• → MetHb + O2NOO-
O2NOO- + O22- → NO2 + 2O22-
O2- + NO2 → 1O2 + NO2

Рисунок 3. Изменение валентности железа при оксидативном стрессе
Активация свободнорадикального окисления, при котором органические вещества подвергаются неферментативному окислению молекулярным кислородом, приводит к возникновению тканевой гипоксии. При тканевой гипоксии присутствие множества митохондрий в эритроцитах несовместимо с функцией переноса этими клетками кислорода из-за неизбежной конкуренции за кислород между митохондриями и армадой молекул гемоглобина и, следовательно, нереализуемости в составе таких эритроцитов «гемоглобинового» механизма депонирования и транспорта кислорода [6, с. 161].
Гипоксия является одним из важных факторов развития канцерогенеза, так как приводит к повышенной метаболической активности. При этом гипоксия становится мощным индуктором экспрессии генов, вовлекающихся в гликолиз для поддержания клеточной энергии, приводя в дальнейшем к угнетению процессов окислительного фосфорилирования. Согласно известной концепции (Warburg, 1930, 1957) ослабление клеточного дыхания и разобщение окислительного фосфорилирования являются начальным этапом возникновения неоплазм. В этих процессах отмечается высокая скорость гликолиза с повышенным поглощением глюкозы и увеличением образования лактата (рис.4). Разобщение дыхания и фосфорилирования в процессе канцерогенеза приводит, как правило, к энергетическому голоданию клетки и к дальнейшему преобладанию процессов распада над процессами синтеза, т. е. к дедифференциации клетки, что является одним из основных проявлений малигнизации [2, с. 2592].
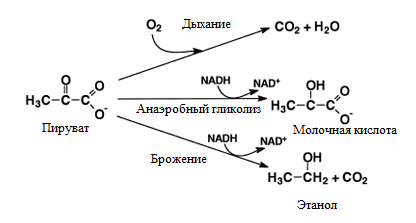
Рисунок 4. Механизмы тканевой гипоксии, развивающейся при оксидативном стрессе
У 50 онкологических больных, разделенных на 2 группы: 15 человек с I и II стадией, 35 человек — с III стадией была исследована кровь на анализаторах газов Cobas B 221(Roche, Германия) и ABL 800 Flex (Radiometer, Дания) для определения следующих показателей: рН; парциального давления газов pCO2 и pO2; полной оксиметрии — общего гемоглобина tHb, карбоксигемоглобина COHb, дезоксигамоглобина HHb, оксигемоглобина O2Hb, метгемоглобина MetHb, индекса сатурации sO2; кислотного и щелочного статуса — буферной емкости BC и содержания угольной кислоты HCO3; содержание лактата Lactat (молочной кислоты). Больные были со следующими нозологическими формами рака: кожи, мягких тканей, костей, легких, желудка, пищевода, тонкого и толстого кишечника, поджелудочной железы, печени, желчного протока, почек, надпочечников, мочевого пузыря, предстательной железы, молочных желез, яичников, маточной трубы; со следующими морфологическими формами: аденокарцинома, внутри-протоковый рак, плоскоклеточный рак, базальноклеточный рак, хромофильный рак почки, гепатобластома, мезенхимальная хондросаркома, остеогенная саркома, медуллярный рак.
Полученные данные представлены в Таблице 1.
Таблица 1.
Параметры газов, оксиметрии и кислотно-щелочного состояния крови
|
Стадия канцерогенеза |
pH |
Парциальное давление газов |
Оксиметрия % |
Кислотный и щелочной статус |
Молочная кислота
|
|||||||
|
pCO2 |
pO2 |
tHb |
sO2 |
O2Hb |
COHb |
HHb |
MetHb |
BC |
HCO3 |
Lactat |
||
|
I |
N |
N |
N |
N |
↓ |
↓ |
N |
N |
N |
↓ |
N |
↑ |
|
II |
N |
↓ |
↑ |
N |
↓ |
↓ |
↑ |
↑↑ |
↑ |
↓ |
↓ |
↑↑ |
|
III |
↓ |
↓↓ |
↑↑ |
↓↓ |
N |
N |
↑↑↑ |
↑↑↑ |
↑↑ |
↓↓↓ |
↓↓ |
↑↑↑ |
|
IV |
↓ |
↓↓ |
↑↑↑ |
↓↓↓ |
N |
N |
↑↑↑ |
↑↑↑ |
↑↑↑ |
↓↓↓ |
↓↓↓ |
↑↑↑ |
↓ или ↑ — одна стрелка указывает на тенденцию снижаться или повышаться от нормальных значений от 5 до 15 %;
↓↓ или ↑↑ — две стрелки указывают на тенденцию снижаться или повышаться от нормальных значений от 16 до 30 %;
↓↓↓ или ↑↑↑ — три стрелки указывают на тенденцию снижаться или повышаться от нормальных значений свыше 30 %.
Обработка данных проводилась в БГУ (Белорусском Государственном Университете) профессором факультета физики Э.А. Чернявской и профессором факультета радиофизики и компьютерных технологий В.А. Саечниковым.
Последовательно использовался итерационный метод обработки данных:
· сначала весь массив данных был обработан на восстановление пропущенных данных;
· из массива данных методом главных принципиальных компонент были выделены интегрированные переменные, имеющие наибольшую корреляцию;
· каждый двухкомпонентный массив был обработан нейронной сетью — многослойным персептроном по двум группам больных: первая — с I и II стадией, вторая — с III стадией.
В итоге корреляция первой компоненты составила 67,4 % (рис. 5); второй компоненты — 13,2 % (рис. 6); корреляция третьей компоненты — 6,2 % (рис. 7). Корреляционная зависимость по всем 3-м компонентам составила 86,9 % (рис. 8) [5, с. 222].
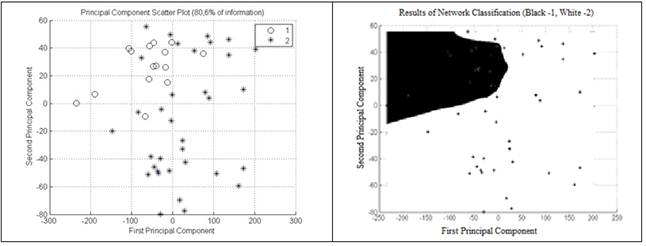
Рисунок 5. Корреляция 1-й компоненты составляет 67,4 % (Э.А. Чернявская и А.В. Саечников, 2013)
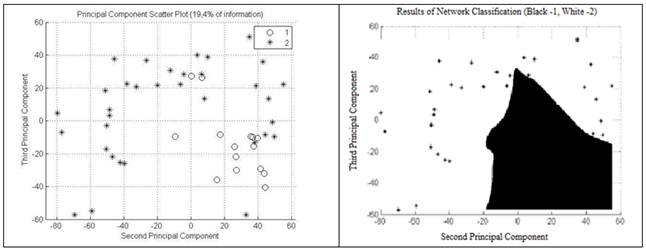
Рисунок 6. Корреляция 2-й компоненты составляет 13,2 % (Э.А. Чернявская и А.В. Саечников, 2013)
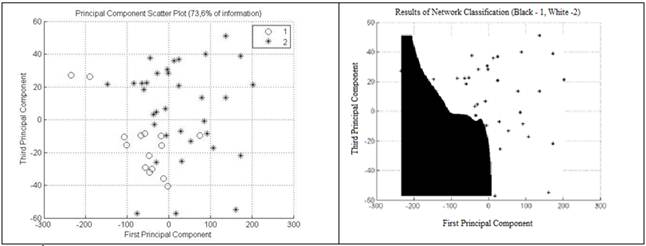
Рисунок 7. Корреляция 3-й компоненты составляет 6,2 % (Э.А. Чернявская и А.В. Саечников, 2013)
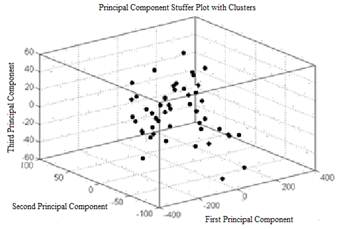
Рисунок 8. Корреляция по всем 3-м компонентам составляет 86,9 % (Э.А. Чернявская и А.В. Саечников, 2013)
В результате исследования были получены данные, косвенно подтверждающие повреждение дыхательной функции гемоглобина в виде дисбаланса его фракций в зависимости от выраженности оксидативного стресса и стадии протекания канцерогенеза: при I стадии и II стадии снижаются показатели оксигемоглобина и индекса сатурации (показывающего степень насыщения кислородом), повышается содержание дезоксигеимоглобина HHb; при III стадии повышаются показатели карбоксигемоглобина COHb, дезоксигемоглобина HHb и метгемоглобина MetHb. В начальных I и II стадиях снижение сродства гемоглобина к кислороду sO2 показывает об образовании прочных комплексов с радикалом, что характеризует начальные стадии оксидативного стресса.
Повышение метгемоглобина MetHb характеризует состояние метгемоглобинемии, при которой не только часть гемов выключается из транспорта кислорода, но и оставшийся оксигемоглобин имеет искаженную гиперболическую кривую диссоциации и отдает тканям меньше кислорода. Повышение карбоксигемоглобина COHb, не способного переносить кислород, усугубляет течение тканевой гипоксии. Полученные параметры при III стадии канцерогенеза характеризуют конформационные изменения в структуре гемоглобина в связи с глубокими нарушениями тканевого дыхания.
В заключение можно сделать следующий вывод. Проведенные исследования позволяют рассматривать поврежденные фракции гемоглобина как индикаторы оксидативного стресса при канцерогенезе. Используя аналогичную обработку данных можно определять принадлежность больных к группе риска по канцерогенной заболеваемости.
Список литературы:
1.Трегубов A.A. Нарушение дыхательной функции крови при некоторых патологических состояниях, Ленинград: Военно-медицинская академия им. С.М. Кирова, 1947. — 123 с.
2.Floyd R.A. Role of oxygen free radicals in carcinogenesis and brain ischemia. FASEB J. 1990 Jun; 4(9): 2587-97. — P. 2587.
3.Klauning J.E. et al. The Role of Oxidative Stress in Chemical Carcinogenesis. Environmental Health Perspectives V.106 Supplement 1 February 1998 — P. 289—295.
4.Nelson R.L. Dietary iron and cancer risk. Free Radic. Biol. Med. 12:161-168 (1992).
5.Sadvakas A., Therniavskaia E.A., and SaetchnikovA.V. International Journal of Molecular medicine. Volume 32, Supplement 1, 2013. — P. 222.
6.Stevens R.G., Nerishi K. Iron and oxidative stress in human cancer. In: Biological Consequences of Oxidative Stress: Implication for Cardiovascular Disease and Carcinogenesis (Spatz L., Bloom A.D., etc). New York: Oxford University Press, 1992, — P. 138—161.
дипломов


Оставить комментарий