Статья опубликована в рамках: XV Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 05 февраля 2014 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ПОИСК И ПЕРВИЧНАЯ ОЧИСТКА БИОЛОГИЧЕСКИ АКТИВНЫХ ПОЛИПЕПТИДОВ ИЗ АКТИНИИ URTICINA CF. CORIACEA
Кветкина Александра Николаевна
студент, кафедра биохимии, микробиологии и биотехнологии, Школа естественных наук, Федеральное государственное автономное образовательное учреждение высшего профессионального образования Дальневосточный Федеральный Университет, РФ, г. Владивосток
E-mail: sashaledy.ru@mail.ru
Гладких Ирина Николаевна
канд. хим. наук, н.с. лаборатории химии пептидов, Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук, РФ, г. Владивосток
E-mail: irinagladkikh@gmail.com
Монастырная Маргарита Михайловна
д-р хим. наук, в.н.с. лаборатории химии пептидов, Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук, РФ, г. Владивосток
E-mail:
Козловская Эмма Павловна
д-р хим. наук, профессор, Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук, РФ, г. Владивосток
E-mail:
THE RESEARCH AND PRIMARY PURIFICATION OF BIOLOGICALLY ACTIVE POLYPEPTIDES FROM ACTINIA URTICINA CF. CORIACEA
Kvetkina Aleksandra Nikolayevna
student, Far Eastern Federal University, Russia Vladivostok
Irina Gladkikh
candidate of chemical sciences, research worker of the laboratory of Peptide Chemistry, G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch, Russian Academy of Sciences, Russia Vladivostok
Margarita Monastyrnaya
doctor of Chemistry, leading research worker of the laboratory of Peptide Chemistry, G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch, Russian Academy of Sciences, Russia Vladivostok
Emma Kozlovskaya
doctor of Chemistry, professor, G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch, Russian Academy of Sciences, Russia Vladivostok
АННОТАЦИЯ
Описано выделение и определение биологической активности полипептидов, выделенных из актинии Urticina cf. coriacea.
ABSTRACT
Process of purification and determination of biologically active polypeptides from the sea anemone Urticina cf. coriacea is described.
Ключевые слова: актинии; нейротоксины; ASIC-каналы
Keywords: sea anemones; neurotoxins; ASIC-channels
В последние годы проводятся широкомасштабные исследования в области химии и фармакологии морских природных соединений (МПС), направленные на разработку лекарственных препаратов нового поколения. Интересными объектами изучения являются морские кишечнополостные, актинии, продуцирующие огромное разнообразие низко- и высокомолекулярных биологически активных полипептидов, таких как анемонотоксины структурных типов 1 и 2 (5 кДа) [3, 5—7], ингибиторы протеиназ (6 кДа), специфически взаимодействующие с различными биологическими мишенями включая определенные типы ионных каналов и ионотропных рецепторов [2, 4], а также пороформирующие токсины (актинопорины 20 кДа) [8, 13, 20]. Наиболее богатыми источниками таких соединений являются тропические виды актиний. Так, из Heteractis crispa (ранее Radianthus macrodactylus) выделен полипептид АРНС1, который, блокируя болевой ваниллоидный рецептор TRPV1, оказывает выраженное анальгетическое действие in vivo на моделях тепловой стимуляции боли [11]. Недавно из этой же актинии был выделен еще один полипептид, π-AnmTX Hcr 1b-1, который блокирует протончувствительные NaV-каналы электровозбудимых мембран (ASIC3 типа) [9] и проявляет анальгетическую активность на млекопитающих. Установлено, что TRPV1 и некоторые типы ASICs-каналов играют важную роль в приеме, обработке и передаче болевых стимулов в центральную нервную систему [14].
Не менее интересным источником таких соединений являются актинии дальневосточных морей. Недавно в лаборатории химии пептидов ТИБОХ ДВО РАН был проведен поиск биологически активных полипептидов в ядах актиний Охотского моря, Urticina sp., Stompia coccinea, и Японского моря, Cnidopus japonicus. Тестирование активности водных и этанольных экстрактов ядов методом тепловой стимуляции боли у мышей показало, что они обладают выраженной анальгетической активностью [1]. В экстрактах актиний северо-западной части Тихого океана были найдены полипептиды, обладающие гидролитической активностью, а экстракт актинии Metridium senile разрушает хитин ракообразных за счет содержащегося в нем фермента хитиназы [16]. Показано, что активность ферментов тропических видов актиний, участвующих в гидролизе глюканов, несколько ниже, чем у актиний низкобореальных вод Дальнего Востока [17].
Для поиска и последующего выделения новых биологически активных соединений белковой природы нами был выбран вид актинии Охотского моря U. cf. coriacea, который широко распространен в западной части Тихого океана на побережье Северной Америки, а также около Курильских островов. Канадские ученые из университета Альберта, исследовавшие экстракты одиннадцати видов актиний, показали, что экстракт актинии U. coriacea, собранной у побережья Канады, обладает мощным цитотоксическим действием на клеточную линию HEL 299, получаемую из легочной ткани эмбрионов, а также повышает частоту сердечных сокращений у крысы [13]. Это свидетельствует о том, что актиния U. cf. coriacea может являться потенциальным источником цитотоксинов и кардиостимулирующих соединений.
Для получения яда из U. cf. coriacea применили метод осмотического шока в сочетании с термическим шоком. Этот подход позволяет получить более чистый и концентрированный яд, не загрязненный белками и полипептидами, содержащимися в тканях тела животного. Для этого живых актиний поместили в теплую дистиллированную воду (40—45 °С) на 15—20 минут и периодически помешивали их стеклянной палочкой для дополнительной стимуляции выброса биологически активных веществ из клеток щупалец и тела. Полученный водный экстракт после фильтрования центрифугировали и лиофильно высушивали. Для дальнейшего разделения содержащихся в нем биологически активных полипептидов применяли гидрофобную хроматографию на полихроме-1. Элюцию адсорбировавшихся полипептидов осуществляли сначала водой, а затем последовательно 40 %-ным и 60 %-ным этанолом (рис. 1). Фракции, элюированные водой, были проверены на содержание в них полипептидов, обладающих гемолитической и фосфолипазной активностью. Результаты анализа показали, что эти фракции обладали только гемолитической активностью.
Полипептиды 40 %-ных этанольных фракций (спирт предварительно упаривали) были проверены на наличие трипсинингибирующей, токсической и анальгетической активности. Было установлено, что трипсинингибирующей активностью они не обладают, что связано, возможно, с примененным способом экстракции. Известно, что нейро-, цитотоксины и ингибиторы протеиназ были получены из водных и этанольных экстрактов актиний путем гомогенизации цельного организма. Примером может служить актиния H. crispa, из которой было выделено 8 нативных ингибиторов протеиназ, и для ингибитора Jn-IV была установлена полная аминокислотная последовательность [8]. Однако, согласно литературным данным, в экстракте актинии Gyrostoma helianthus ингибиторная активность также не обнаружена [19].
Для определения токсичности мышам вводили раствор полипептидов в дозе 80,5 мг/кг. Но даже в такой дозе токсичность полипептиды не проявляли. В то же время значения LD50 токсинов, выделенных из тропической актинии H. crispa, для мышей варьировали от 3000 мкг/кг до 2,5 мкг/кг [2—7].
Для определения анальгетической активности полипептидов, экстрагированных 40 %-ным этанолом, в экспериментах in vivo использовали модель химического болевого раздражения, вызываемого внутрибрюшинным введением 1 %-ной уксусной кислоты («кислотная» модель) [10]. Показано, что при введении раствора полипептидов в дозе 590 мкг/мышь среднее количество корчей у экспериментальных животных составило 25, а количество корчей у нелеченных животных — 50 (рис. 2). Это говорит о том, что полипептиды 40 %-ных этанольных фракций обладают анальгетической активностью.

Рисунок 1. Гидрофобная хроматография полипептидов водного экстракта актинии U. cf. coriacea на колонке с полихромом-1, уравновешенным водой. Пик 1 — элюция полипептидов дистиллированной водой, пик 2 — 40 %-ным этанолом, пик 3 — 60 %-ным этанолом. Границы объединенных полипептидных фракций, обладающих гемолитической активностью, отмечены сплошной линией, а анальгетической активностью — пунктирной.
Согласно данным масс-спектрометрического анализа (MALDI TOF МS) полипептиды, присутствующие во фракциях пика 1 (рис. 1), имели молекулярные массы 3822,4; 3981,8; 4132,4; 5232,8; 5379,8; 6024,9; 6952,4; 7609,1 Да (рис. 3, А).
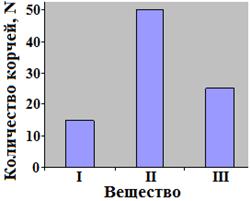
Рисунок 2. Анальгетический эффект полипептидов пика 2 (рис. 1) на «кислотной» модели: мышам вводили 100 мкл раствора исследуемого препарата полипептидов и анальгин внутрибрюшинно. Через час вводили 100 мкл 1 %-ной уксусной кислоты и подсчитывали количество корчей в течение 15 мин. I — мыши, леченные контрольным препаратом сравнения (анальгин), II — нелеченые мыши, III — мыши, леченные исследуемыми препаратом полипептидов.
Во фракциях 2-го пика (рис. 1) содержались полипептиды с молекулярными массами: 3039,6; 5376,6; 6948,6; 10559,2 Да (рис. 3, Б). Пептиды с молекулярными массами в диапазоне 3822—4132 Да могут принадлежать к группе токсичных APETx2-подобных пептидов, обнаруженных у актинии Anthopleura elegantissima [12] и H. crispa [9], обладающих анальгетической активностью, которая обусловлена их блокирующим действием на ASICs-каналы (ASIC3 и ASIC1a), в то время как полипептиды с молекулярной массой около 5000 Да, очевидно, принадлежат к нейротоксинам структурных типов 1 или 2, модуляторам Na+-каналов [18]. Наличие в масс-спектре сигналов, соответствующих 6 кДа, показывает, что во фракциях могут присутствовать полипептидные ингибиторы протеиназ [2, 4].
А Б

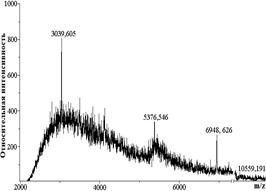
Рисунок 3. Масс-спектры полипептидов в объединенных полипептидных фракциях пика 1 (А) и пика 2 (Б) (рис. 1)
Полипептиды со значениями молекулярных масс около 7 кДа, возможно, являются низкомолекулярными цитолизинами (6—7 кДа). Так, ранее из актинии низкобореальных вод Tealia felina был выделен низкомолекулярный полипептид — теалиатоксин с молекулярной массой 7,8 кДа [15], а из водного экстракта актинии R. macrodactylus два цитолизина RmI и RmII (6 кДа) [8].
Таким образом, установлено, что экстракт актинии U. cf. coriacea содержит ряд биологически активных полипептидов, обладающих цитолитической и анальгетической активностью. Полученные данные позволяют предположить, что так же как анальгетические полипептиды Кунитц-типа APHC1-APHC3 и APETx2-подобные токсины актинии H. Crispa [9], биологически активные полипептиды из U. cf. coriacea могут обладать фармакологическим потенциалом.
Список литературы:
1.Гладких И.Н., Монастырная М.М., Табакмахер В.М., Кривошапко О.Н., Синцова О.В., Сухова И.Г., Ткачева Е.С., Чаусова В.Е., Костина Е.Е., Попов А.М., Козловская Э.П. Поиск анальгетических компонентов, продуцируемых морскими актиниями // Актуальные научные вопросы: реальность и перспективы: сб. науч. тр. по материалам Междунар. заочной науч.-практ. конф. Тамбов: Изд-во ТРОО «Бизнес-Наука-Общество». — 2012. — Ч. 2. — С. 29—33.
2.Зыкова Т.А., Винокуров Л.М., Маркова Л.Ф., Козловская Э.., Еляков Г.Б. Аминоксилотная последовательность трипсинового ингибитора IV из Radianthus macrodactylus // Биоорган. химия. — 1985. — T. 11. — № 3 — C. 293—301.
3.Зыкова Т.А., Винокуров Л.М., Козловская Э.П., Еляков Г.Б. Аминокислотная последовательность нейротоксина III из актинии Radianthus macrodactylus // Биоорган. химия. — 1985а. — Т. 11. — № 3. — С. 302—310.
4.Зыкова Т.А., Винокуров Л.М., Маркова Л.Ф. и др. Аминокислотная последовательность трипсинового ингибитора II из Radianthus macrodactylus // Биоорган. химия. — 1985б. — T. 11. — № 3. — C. 293—301.
5.Зыкова Т.А., Козловская Э.П. Аминокислотная последовательность нейротоксина I из актинии Radianthus macrodactylus // Биоорган. химия. — 1989а. — Т. 15. — № 10. — С. 1301—1306.
6.Зыкова Т.А., Козловская Э.П. Дисульфидные связи в нейротоксине III из актинии Radianthus macrodactylus // Биоорган. химия. — 1989б. — Т. 15. — № 7. — С. 904—907.
7.Зыкова Т.А., Козловская Э.П., Еляков Г.Б. Аминокислотная последовательность нейротоксинов IV и V из актинии Radianthus macrodactylus // Биоорган. химия. — 1988. — Т. 14. — № 11. — С. 1489—1494.
8.Зыкова Т.А., Монастырная М.М., Апаликова О.В., Щвец Т.В., Козловская Э.П. Низкомолекулярные цитолизины и ингибиторы трипсина из актинии Radianthus macrodactylus. Выделение и частичная характеристика. // Биоорган. химия. — 1997. — Т. 24. — С. 509—516.
9.Козлов С.А., Андреев Я.А., Кошелев С.Г., Иванова Е.А., Лейченко Е.В., Козловская Э.П., Гришин Е.В. Патент на изобретение «Полипептид актинии, обладающий анальгетическим действием», РФ № 2368621. 2009.
10.Козловская Э.П., Монастырная М.М., Гладких И.М., Табакмахер В.М., Кривошапко О.Н., Козлов С.А., Осмаков Д.И., Андреев Я.А., Кошелев С.Г., Гришин Е.В. Полипептид из морской анемоны Heteractis crispa, обладающий анальгетическим действием. Патент РФ 2012108499. 2012.
11.Andreev Y.A., Kozlov S.A., Koshelev S.G., Ivanova E.A., Monastyrnaya M.M., Kozlovskaya E.P., Grishin E.V. Analgesic compound from sea anemone Heteractis crispa is the first polypeptide inhibitor of vanilloid receptor 1 (TRPV1) // J. Biol. Chem. — 2008. — Vol. 283. — P. 23914—23921.
12.Chagot B., Escoubas P., Diochot S., Bernard C., Lazdunski M., Darbon H. Solution structure of APETx2, a specific peptide inhibitor of ASIC3 proton-gated channels // Protein Sci. — 2008 — Vol. 14. — P. 2003—2010.
13.Cline E.I., Wolowyk M.W. Cardiac stimulatory, cytotoxic and cytolytic activity of extracts of sea anemones // International Journal of Pharmacognosy. — 1997. — Vol. 35 — № 2 — P. 91—98.
14.Deval E., Gasull X., Noel J., Salinas M., Baron A., Diochot S., Lingueglia E. Acid-sensing ion channels (ASICs): pharmacology and implication in pain // Pharmacol. Ther. — 2010. — V. 128. — P. 549—558.
15.Elliott R.C., Konya R.S., Vickneshwara K. The isolation of a toxin from the Dahlia sea anemone Tealia feline // Toxicon. — 1986. — Vol. 24. — P. 117—122.
16.Elyakova L.A., Distribution of cellulase and chitinases in marine invertebrates // Comp. Biochem. Physiol. B. — 1972. — Vol. 43. — P. 67—70.
17.Elyakova L.A., Shevchenko N.M., Avaeva S.M. A Comparative Study of Carbohydrase Activities in Marine Invertebrates // Comp. Biochem. Physiol. B. — 1981. — Vol. 69. — P. 905—908.
18.Honma T., Shiomi K. Peptide toxins in sea anemones: structural and functional aspects // Mar. Biotechnol. — 2006. — Vol. 8. — P. 1—10.
19.Mebs D., Liebrich M., Beul A., Samejima Y. Hemolisins and proteinase inhibitors from sea anemones of Gulf of Aqaba // Toxicon. — 1983. — Vol. 21 — № 2 — P. 257—264.
20.Monastyrnaya M.M., Zykova T.A., Apalikova O.V., Shwets T.V., Kozlovskaya E.P. Biologically active polypeptides from the tropical sea anemone Radianthus macrodactylus // Toxicon. — 2002. — Vol. 40 — P. 1197—1217.
дипломов


Оставить комментарий