Статья опубликована в рамках: XII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 11 ноября 2013 г.)
Наука: Химия
Секция: Физическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ МИЦЕЛЛЯРНЫХ СУБСТРАТОВ В ПРИСУТСТВИИ АДРЕНАЛИНА И МЕТИЛДОФА
Перевозкина Маргарита Геннадьевна
канд. хим. наук, старший преподаватель Государственного аграрного университета Северного Зауралья, г. Тюмень
CATALYTIC OXYDATION OF MICELLAR SUBSTRATA OVER ADRENALIN AND METHYLDOPA
Margarita Perevozkina
candidate of chemical sciences, Head teacher of State Agrarian University of Northern Transurals, Tyumen
АННОТАЦИЯ
Исследована антиоксидантная активность адреналина и метилдофа в сравнении со стандартными ингибиторами окисления дибунолом (ионолом), a-токоферолом и пирокатехином в мицеллярных катализируемых субстратах. Выявлены слабые антиоксидантные свойства у адреналина и метилдофа, уступающие пирокатехину. Показана возможность адреналина и метилдофа снижать максимальную скорость окисления в 4—6 раз по сравнению с контролем, разрушать гидропероксиды молекулярным путем на 50—60 %. Установлено, что дибунол превосходит по своему действию природный антиоксидант a-токоферол.
ABSTRACT
Antioxidant activity of adrenalin and methyldopa has been studied in comparison with standard oxidation retarders by dibunol (ionol), a-tocopherol and pyrocatechin in micellar catalyzing substrata. There are defined weak antioxidant properties with adrenalin and methyldopa, which come short of pyrocatechin. There is shown the possibility of adrenalin and methyldopa to inhibit the maximum oxidation rate by 4—6 times in comparison with control and to consume hydroperoxides molecularly for 50—60 %. It is found that dibunol exceeds in its influence natural antioxidant a-tocopherol.
Ключевые слова: адреналин; метилдофа; a-токоферол; дибунол (ионол); антиоксидантная активность; каталитическое окисление; мицеллы.
Keywords: adrenalin; methyldopa; a-tocopherol; dibunol (ionol); antioxidant activity; catalytic oxydation; micelles.
В настоящее время антиоксиданты (АО) нашли широкое применение в медицине, в пищевой, косметической и химико-фармацевтической промышленности. Перечень официально разрешенных, нетоксичных АО невелик, преимущественно — это природные соединения [2, 5]. Ведется поиск перспективных АО из числа традиционных лекарственных препаратов с целью расширения спектра их фармакологического действия. Создаются новые кинетические модели для тестирования антиоксидантной активности жирорастворимых и водорастворимых соединений в условиях, приближенных к биологическим средам.
Целью данного исследования являлась разработка кинетического способа тестирования антиоксидантной активности различных классов органических соединений в условиях, приближенных к биологическим средам, изучение ингибирующих свойств производных пирокатехина: адреналина, метилдофа в сравнении с реперными антиоксидантами дибунолом (ионолом) и a-токоферолом.
Экспериментальная часть
Антиоксидантную активность (АОА) изучали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении модельного субстрата метиллинолеата (МЛ), этилолеата (ЭО) в присутствии триметилцетиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ) 1×10-3 М, с добавками раствора хлорида меди (II) в количестве 2×10-3 М при t=(60±0,2)0С. Соотношение воды и липидов составляло 3:1, а общий объем пробы 4 мл [7]. Графическим методом определяли величину периода индукции (ti), представляющей собой отрезок оси абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения касательных, проведенных к кинетической кривой. Эффективность торможения процесса окисления липидного субстрата определяется совокупностью реакций ингибитора и обозначает его антиоксидантную активность, количественно определяемой по формуле АОА= ti-tS /tS, где tS и ti — периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого АО соответственно, сравнивали с действием ингибитора, принятого за стандарт, используя отношение ti / tреп, где tреп. — период индукции реперного (стандартного) ингибитора. Из наклона кинетических кривых (КК) определяли начальную (Wнач.) и максимальную (Wмах.) скорости окисления липидного субстрата с добавками АО. Скорость инициирования определяли уравнением Wi = f [InH] / ti, где f - стехиометрический коэффициент ингибирования, [InH] — концентрация ингибитора, ti — период индукции. В качестве стандартных ингибиторов использовали a-токоферол и дибунол, при этом концентрации АО были сравнимыми.
Кинетику накопления гидропероксидов в метилолеате (МО) исследовали в условиях аутоокисления методом обратного йодометрического титрования в среде хлорбензола при t=(60±0,2) 0С. Навеску окисляемого модельного субстрата растворяли в смеси ледяной уксусной кислоты и хлороформа в соотношении 3:2, добавляли насыщенный на холоду иодид калия, смесь перемешивали и оставляли в темноте. Через равные промежутки времени отбирали пробы и определяли в них перекисное число: ![]() ; где а — объем Na2S2O3, пошедший на титрование пробы; b — объем Na2S2O3, пошедший на титрование контрольного опыта; d — масса навески субстрата окисления.
; где а — объем Na2S2O3, пошедший на титрование пробы; b — объем Na2S2O3, пошедший на титрование контрольного опыта; d — масса навески субстрата окисления.
Чистоту соединений контролировали методом высокоэффективной жидкостной хроматографии. Содержание основного вещества составляло 99,9 %. В качестве субстрата окисления применяли метиллинолеат, этилолеат и метилолеат, дважды очищенные путем вакуумной перегонки в токе аргона при 105 0С (чистота липидного субстрата после перегонки — 99,8 %). Очистку АИБН проводили последовательной перекристаллизацией из безводных этанола, ацетона и бензола. Дибунол (2,6-ди-трет-бутил-4-метилфенол) очищали двух-кратной кристаллизацией из абсолютного этанола, a-токоферол (фирмы «Serva», Германия) очищали перегонкой под вакуумом и последующим контролем методом тонкослойной хроматографии (ТСХ) в системе — петролейный : диэтиловый эфир (9 : 1 по объёму).
Результаты и их обсуждение
С целью выбора эффективных катализаторов на процесс окисления липидных субстратов было изучено влияние солей переходных металлов: FeSO4, FeCl3, NiCl2, CoCl2, CuCl2 в широком диапазоне концентраций (10-6-10-1 М) в водно-эмульсионной среде.
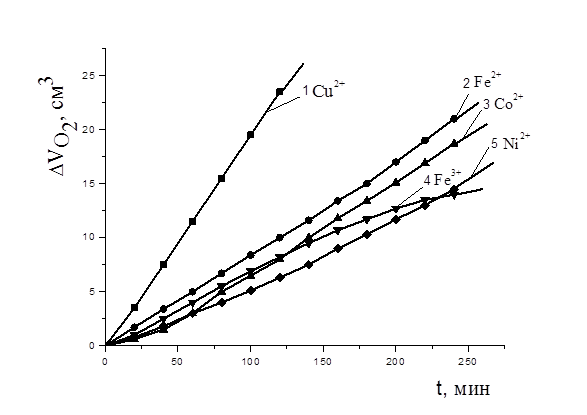
Рисунок 1. Кинетика окисления МЛ в водно-липидной среде в присутствии добавок солей металлов в концентрации 1×10-3 М: 1 — CuCl2, 2 — FeSO4, 3 — CoCl2, 4 — FeCl3, 5 — NiCl2, 1×10-3 М ЦТМАБ, t=60 0С
На рис. 1. представлены КК поглощения кислорода в присутствии равных добавок (1´10-3 М) солей железа (II,III), никеля (II), кобальта (II) и меди (II). Из рис.1 видно, что в сравнимых концентрациях наиболее эффективным катализатором является хлорид меди (II). Установлено, что скорость окисления метиллинолеата в присутствии хлорида меди была выше в 5 раз по сравнению с добавками солей других металлов и при концентрации 2×10-3М составляла (2,6±0,3)×10-4М×с-1(рис. 2). Показано, что скорость каталитического окисления МЛ выше в 1000 раз, чем в безводной среде в присутствии 6×10-3 М азо-бис-изо-бутиронитрила (АИБН), которая составляла (2,6±0,3)×10-7М×с-1.
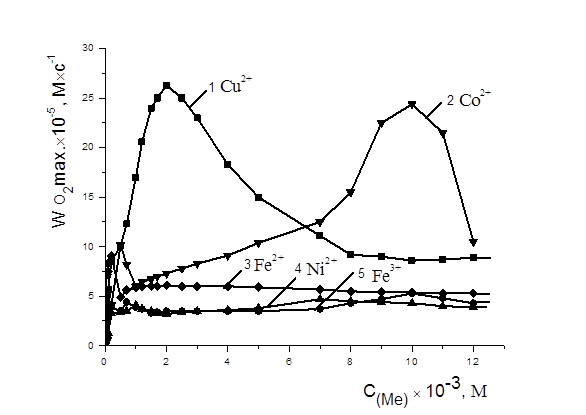
Рисунок 2. Зависимость стационарных скоростей окисления МЛ в присутствии солей катализаторов от их концентраций, М:1 — CuCl2, 2 — CoCl2, 3 — Fe2SO4, 4 — NiCl2, 5 — FeCl3, 1×10-3 М ЦТМАБ, t=600 С
Для выбора оптимальной добавки ЦТМАБ исследовали диапазон концентраций (10-4—10-2) М. Концентрация ПАВ 1×10-3 М оказалась оптимальной, дальнейшее её повышение приводило к снижению скорости окисления. Указанную концентрацию детергента, обеспечивающую наибольшую скорость реакции, можно рекомендовать для использования в гетерогенных моделях окисления. Методом Ребиндера и рефрактометрическим методом была оценена критическая концентрация мицеллообразования ЦТМАБ (1,0±0,2)×10-3 М, что соответствовало кинетическим данным. Аналогичные закономерности наблюдались при окислении других субстратов. На основе проведенных исследований была предложена новая кинетическая модель экспресс-тестирования антиоксидантов: модельный субстрат содержит 2×10-3 М хлорида меди (II), 1×10-3 М ЦТМАБ, липиды и воду 1 : 3.
Механизм каталитического окисления липидов в водно-эмульсионной среде сводится к следующему. В присутствии ЦТМАБ формируются мицеллы. Добавки катионного ПАВ усиливают мицеллообразование, при этом катионы внедряются в промежутки между углеводородными «хвостами» с образованием двойного электрического слоя. С выработкой свободных радикалов высших жирных кислот катионы катализатора должны иметь доступ к гидрофобным хвостам субстрата.
В присутствии катализатора известны следующие реакции зарождения цепей [4]:
RH + Cu2+ ![]() R● + Cu1+ + H+
R● + Cu1+ + H+
ROOH + Cu1+ ![]() RO● + OH● + Cu2+
RO● + OH● + Cu2+
ROOH + Cu2+ ![]() RO2● + H+ + Cu1+
RO2● + H+ + Cu1+
Возможно участие катализатора в продолжении цепей :
RO2● + Cu2++ H2O ![]() RO● + Cu(OH)2
RO● + Cu(OH)2
RO● + RH ![]() R● + ROOH
R● + ROOH
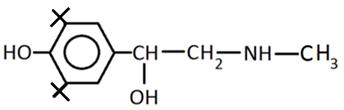
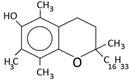
Новая кинетическая модель экспресс-тестирования антиоксидантной активности соединений была изучена на примере адреналина и метилдофа в сравнении с реперными антиоксидантами. В таблице 1 представлены формулы изучаемых соединений.
Адреналин известен как «гормон стресса». В медицине адреналин используется как гипергликемическое, бронхолитическое, гипертензивное, противоаллергическое, сосудосуживающее средство. Метилдофа применяют как гипотензивное средство при разных формах гипертонической болезни. Впервые антиоксидантные свойства адреналина и метилдофа были показаны в нашей работе [6]. По химической структуре соединения адреналин и метилдофа относятся к аминофенолам.
Таблица 1.
Химические формулы изучаемых антиоксидантов
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В соответствии с механизмом окисления аминофенолы могут участвовать в различных элементарных реакциях:
· реакции обрыва цепей, что должно приводить к увеличению периода индукции и уменьшению начальных скоростей процесса пропорционально концентрации:
RO2· + InH ![]() ROOH + In·
ROOH + In·
· реакции разветвления, продолжения, инициирования цепей, что должно приводить к увеличению скорости процесса, сокращению периода индукции:
In· + RH ![]() R· + InH
R· + InH
Iп· + RH ![]() R· + продукты
R· + продукты
· реакции разрушения гидропероксидов по молекулярному механизму, что приведет к уменьшению скорости процесса пропорционально концентрации аминофенола:
ROOH + InH ![]() молекулярные продукты
молекулярные продукты
Известно [1], что аминосодержащие соединения способствуют разрушению гидропероксидов с образованием молекулярных продуктов согласно схеме:
первичные амины ROOH + R΄-CH2NH2 → ROH + R΄-CH=NH + H2O
вторичные амины ROOH + ( R΄-CH2)2NH → ROH + R΄-CH=NH-CH2-R + H2O
третичные амины ROOH + ( R΄-CH2)3N → ROH + R΄-CHO + (R΄-CH2) 2-NH
Скорость реакции падает в ряду: третичные > вторичные > первичные.
В процессе окисления должны конкурировать различные элементарные реакции за счет фенольного гидроксила и аминогруппы, что сказывается на суммарной антиоксидантной активности соединения.
Таблица 2.
Кинетические параметры окисления субстратов в водно-липидной среде в присутствии 2×10-3 М CuCl2 в зависимости от концентрации АО, t=60°С
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
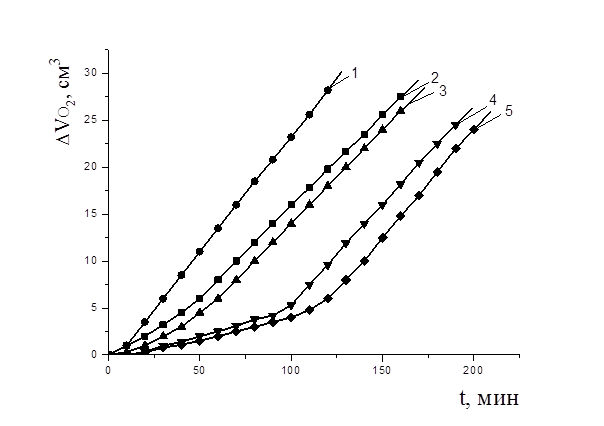
Рисунок 3. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок пирокатехина, М: 1 — контроль, 2 — 1×10-4; 3 — 1×10-3; 4 — 5×10-3; 5 — 1×10-2; 2×10-3 М CuCl2,t=600 С

Рисунок 4. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок адреналина, М: 1 — контроль, 2 — 1×10-6; 3 — 5×10-6; 4 — 1×10-5; 5 — 5×10-5; 6 — 1×10-4; 7 — 1×10-3; 8 — 1×10-2; 2×10-3 М CuCl2,t=600 С
На рис. 3 приведены типичные КК окисления этилолеата в зависимости от концентрации пирокатехина. Показано, что все добавки пирокатехина тормозят процесс окисления: наблюдается период индукции, период аутоускорения и достижения максимальной скорости окисления. При увеличении концентрации пирокатехина повышается максимальная скорость процесса. Увеличение максимальной скорости процесса окисления (табл. 2) в присутствии пирокатехина, вероятно, связана с участием гидроксильных групп в образовании хелатов с катионами меди (II), при этом снижается их эффективность в процессе ингибирования.
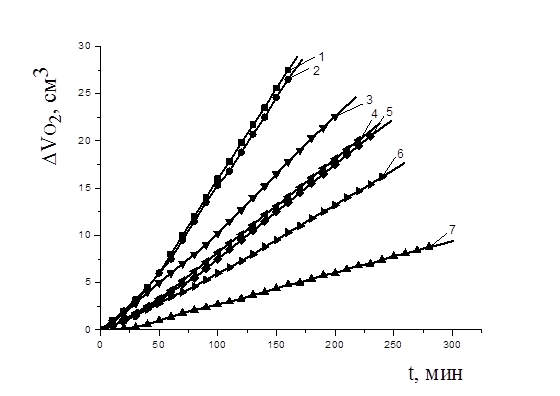
Рисунок 5. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок метилдофа, М: 1 — контроль, 2 — 1×10-6; 3 — 1×10-4; 4 — 3×10-4; 5 — 5×10-4; 6 — 1×10-3; 7 — 1×10-2; 2×10-3 М CuCl2,t=600 С
Кинетические кривые с добавками адреналина приведены на рис. 4. Наблюдается другой характер КК: небольшие периоды индукции, которые практически не зависят от концентрации адреналина, но происходит значительное снижение максимальной скорости процесса окисления в 3—4 раза. Такой характер КК предполагает подавление антиоксидантных свойств фенольного гидроксила за счет образование хелатных комплексов с катионами меди (II) и проявление ингибирующего эффекта только за счет аминогруппы.
На рис. 5. наблюдается аналогичный характер КК с добавками метилдофа: незначительные периоды индукции, снижение начальной и максимальной скоростей окисления в 3—6 раз по сравнению с контролем. Снижение начальной скорости окисления указывает на участие метилдофа в реакциях обрыва цепей. Снижение максимальной скорости окисления (табл. 2) может свидетельствовать об участии соединения в реакциях с гидропероксидами с образованием молекулярных продуктов.
На рис. 6. показаны зависимости периодов индукции антиоксидантов от их концентраций: наблюдалась экстремальная зависимость с максимумом в 5×10-4 М для a-токоферола, для пирокатехина периоды индукции возрастали с увеличением концентрации соединения, периоды индукции адреналина и метилдофа возрастали до 5×10-4 М и в дальнейшем не изменялись.
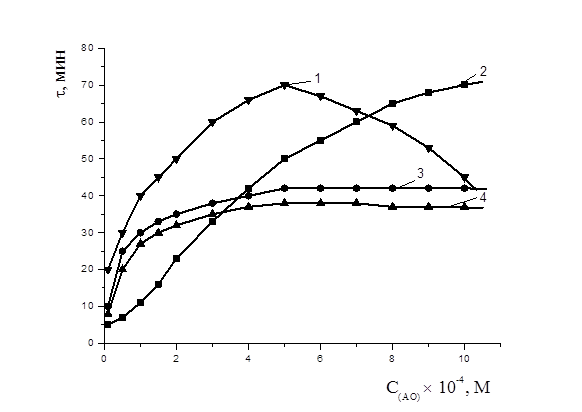
Рисунок 6. Зависимости периода индукции от концентрации антиоксидантов: 1 — a-токоферол, 2 — пирокатехин, 3 — адреналин, 4 — метилдофа; 2×10-3 М CuCl2,субстрат окисления — этилолеат, t=60 0С
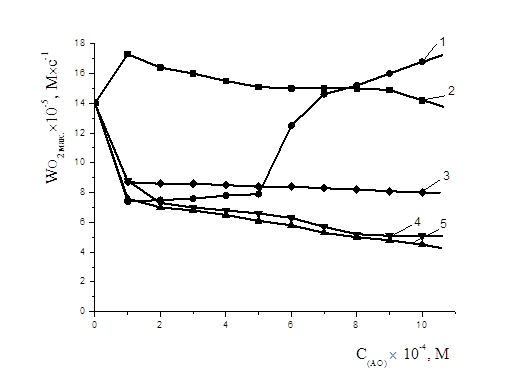
Рисунок 7. Зависимость максимальной скорости окисления этилолеата с добавками антиоксидантов: 1 — a-токоферол, 2 — пирокатехин, 3 — дибунол, 4 — адреналин, 5 — метилдофа; 2×10-3 М CuCl2, t=60 0С
В работе была проанализирована закономерность изменения максимальной скорости окисления этилолеата в присутствии различных концентраций изучаемых АО (рис. 7). Указанные кинетические параметры практически не изменялись с ростом концентрации дибунола и пирокатехина, но существенно уменьшались при введении ингибиторов, содержащих аминогруппу — адреналин, метилдофа. Для a-токоферола максимальная скорость изменяется экстремально, до концентрации 5×10-4 М снижалась и сохраняла свои значения, свыше 5×10-4 М резко увеличивалась.
Показано, что в водно-липидной среде дибунол проявляет себя как сильный ингибитор: наблюдался период полного торможения, период аутоускорения и достижение максимальной скорости окисления (рис. 8). Периоды индукции увеличивались пропорционально росту концентрации дибунола (табл. 2). Наличие торможения в присутствии добавок дибунола являлось признаком радикально-цепного механизма процесса, а отсутствие комплексообразующей способности с катионами меди было связано с экранированностью двумя трет-бутильными заместителями его донорно-акцепторного центра.
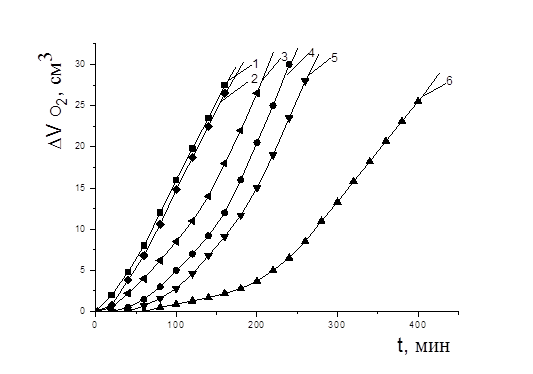
Рисунок 8. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок дибунола, М : 1 — контроль, 2 — 1×10-6, 3 — 2×10-5, 4 — 5×10-5, 5 — 1×10-4, 6 — 5×10-4; 2×10-3 М CuCl2, t=60 0С
Анализ кинетических кривых окисления этилолеата с добавками АО показал существенные отличия механизма действия a-токоферола от дибунола в зависимости от концентрации. С увеличением концентрации a-токоферола наблюдалась инверсия антиоксидантного действия (рис. 6), при этом увеличивалась максимальная скорость окисления (рис. 7). Причиной ускорения процесса может быть комплексообразование OH-группы a-токоферола с катионами меди. В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In·), способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата (RH) [3]:
In· + RH ![]() R· + InH
R· + InH
В результате этой реакции восстанавливается активная фенольная форма антиоксиданта, взаимодействующая в дальнейшем с пероксильными радикалами, ведущими цепи окисления:
RO2· + InH ![]() ROOH +In·
ROOH +In·
На основании представлений об особенностях химической структуры и кинетики окисления липидных субстратов в присутствии аминофенолов полагали, что соединения способны разрушать гидропероксиды. Для подтверждения гипотезы о возможном разрушении гидропероксидов под действием АО, был проведен эксперимент по прямому тестированию кинетики накопления гидропероксидов (ROOH) после введения соединений в частично окисленный субстрат (время эксперимента 8 часов). В течение первого часа наблюдалось снижение концентрации гидропероксидов (рис. 9), в контрольном опыте ROOH продолжали накапливаться. Установлено, что все исследуемые добавки АО способствовали разрушению гидропероксидов на 50—60 %.

Рисунок 9. Кинетика накопления гидропероксидов при аутоокислении МО в присутствии равных концентраций АО: 1 — контроль, 2 — адреналин, 3 — метилдофа. Стрелкой показан ввод АО. С (АО)=2´10-4 M, t=60 0C
На основании полученных данных можно рекомендовать осуществление синтеза потенциальных антиоксидантов, у которых экранированная двумя трет-бутильными заместителями фенольная — ОН-группа должна находиться в пара-положении к заместителю с аминогруппой, что снизит возможность образования хелатных комплексов с катионами меди, а способность аминогруппы разрушать гидропероксиды нерадикальным путем будет способствовать увеличению периодов индукции. Для повышения антиоксидантного эффекта рекомендуется разделение электронодонорной — NH2-группы и электроноакцепторной — COOH-группы, что приведет к снижению образования внутримолекулярных связей.
Химические формулы предполагаемых соединений:
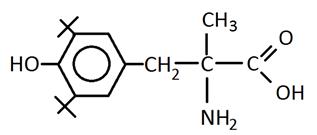
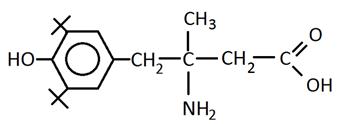
Полученные данные могут представлять интерес с целью расширения спектра применения изучаемых антиоксидантов и быть методологической основой для разработки синтеза новых высокоэффективных полифункциональных соединений.
Выводы:
1. Установлено, что синтетический ингибитор окисления дибунол в водно-липидной среде превосходит по своему действию природный антиоксидант a-токоферол.
2. Выявлены слабые антиоксидантные свойства у адреналина и метилдофа в водно-липидных катализируемых субстратах, уступающие пирокатехину.
3. Показана возможность адреналина и метилдофа снижать максимальную скорость окисления в 4—6 раз по сравнению с контролем.
4. Установлено, что адреналин и метилдофа в процессе окисления липидных субстратов разрушают гидропероксиды молекулярным путем, вероятно, за счет аминогруппы на 50—60 %.
Список литературы:
1.Антоновский В.Л. Органические перекисные инициаторы. М.: Химия, 1972. — 448 с.
2.Бурлакова Е.Б., Алесенко А.В., Молочкина А.М. / Биоантиоксиданты в лучевом поражении и злокачественном росте. М.: Наука, 1975. — 214 с.
3.Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Роль токоферолов в пероксидном окислении липидов биомембран// Биологические мембраны. — 1998. — Т. 15. — № 2. — С. 137—167.
4.Владимиров Ю.А., Суслова Т.Б., Оленев В.И. Митохондрии. Транспорт электронов и преобразование энергии. М.: Наука, 1976. — 109 c.
5.Коган А.Х., Сыркин А.Л., Дриницина С.В. Кислородные свободнорадикальные процессы в патогенезе ишемической болезни сердца и перспективы применения антиоксиданта Q10 (убихинона) для их коррекции // Кардиология. — 1997. — № 12. — С. 62—70.
6.Перевозкина М.Г., Тихонова В.В., Ушкалова В.Н. Каталитическое окисление липидных субстратов в присутствии фенолов и аминов // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Из-во Тюм.ГУ. 1997. — С. 90—104.
7.Ушкалова В.Н., Перевозкина М.Г., Барышников Э.В. Разработка способа тестирования средств антиоксидантотерапии // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Из-во Тюм.ГУ. — 1997. — С. 77—82.
дипломов



Оставить комментарий