Статья опубликована в рамках: XI Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 14 октября 2013 г.)
Наука: Физика
Секция: Теплофизика и теоретическая теплотехника
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
МЕТИЛЛИНОЛЕАТНАЯ КИНЕТИЧЕСКАЯ МОДЕЛЬ ДЛЯ ТЕСТИРОВАНИЯ АНТИОКСИДАНТНЫХ СВОЙСТВ КАПОТЕНА
Перевозкина Маргарита Геннадьевна
канд. хим. наук, старший преподаватель Государственного аграрного университета Северного Зауралья, г. Тюмень
METHYL LINOLEATE KINETIC MODEL FOR TESTING THE ANTIOXIDANT PROPERTIES OF CAPOTEN
Margarita G. Perevozkina
candidate of Science, Senior Lecturer, Department of State Agrarian University of North Zauralye, Tyumen
АННОТАЦИЯ
Исследована антиоксидантная активность капотена (1-[(2S)]-3-меркапто-2-метил-пропионил]-L-пролина) в сравнении со стандартными антиоксидантами дибунолом (ионолом) и a-токоферолом в безводных инициированных и водно-липидных катализируемых субстратах. Установлена высокая антиоксидантная активность капотена в водно-липидной среде. Показано участие капотена в процессе разрушения гидропероксидов молекулярным путем.
ABSTRACT
Studied antioxidant activity capoten (1-[(2S)]-3-mercapto-2-methyl-propionyl]-L-proline), in comparison with standard antioxidants dibunol (ionol) and a-tocopherol in waterless initiated and water-lipid catalyzed substrates. The high antioxidant activity capoten in water-lipid medium. Shows the involvement of capoten in the process of destruction of hydroperoxide by molecular means.
Ключевые слова: антиоксиданты; a-токоферол; дибунол; ионол; капотен; пероксидное окисление; антиоксидантная активность.
Keywords: antioxidants; α-tocopherol; dibunol; ionol; capoten; peroxide oxidation; antioxidant activity.
В настоящее время развитие многих патологических состояний связывают с изменением интенсивности свободно-радикального окисления липидов биомембран [1, с. 49—51, 3, 6]. Поэтому, при ряде заболеваний применяют антиоксидантотерапию. В связи с этим, актуальной является проблема предварительного тестирования антиоксидантных свойств лекарственных препаратов.
Целью работы являлось тестирование антиоксидантной активности капотена при различных способах инициирования в безводных и водно-липидных средах в сравнении с реперными (стандартными) антиоксидантами дибунолом (ионолом) и a-токоферолом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Антиоксидантную активность (АОА) изучали манометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении метиллинолеата (МЛ) в присутствии триметилцетиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ) при концентрации 1 × 10-3 М, с добавками растворов хлорида меди (II) в количестве 2×10-3 М при t=(60±0,2)0С. Соотношение воды и липидов составляло 3:1, а общий объем пробы 4 мл [7, с. 55, 9, с. 82]. Кинетику поглощения кислорода в безводной среде изучали в среде инертного растворителя хлорбензола, процесс инициировали за счет термического разложения азо-бис-изо-бутиронитрила (АИБН) в концентрации 6×10-3М. В качестве критериев оценки антиоксидантных свойств соединений использовали — периоды индукции, начальные и максимальные скорости окисления. Графическим методом определяли величину периода индукции (ti), представляющей собой отрезок оси абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения касательных, проведенных к кинетической кривой. Эффективность торможения процесса окисления липидного субстрата определяется совокупностью реакций ингибитора и обозначает его антиоксидантную активность, количественно определяемой по формуле АОА= ti-tS /tS, где tS и ti — периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого антиоксиданта (АО) соответственно. Кинетику накопления гидропероксидов изучали при аутоокислении метилолеата (МО) методом обратного йодометрического титрования в среде хлорбензола при t=(60±0,2)0С. В качестве реперных ингибиторов использовали a-токоферол и дибунол, при этом концентрации АО были сравнимыми. Критическую концентрацию мицеллообразования ЦТМАБ изучали методом Ребиндера и рефрактометрическим методом. Полученные в процессе окисления липидных субстратов экспериментальные кинетические кривые (КК) описывались функциональными зависимостями методом наименьших квадратов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
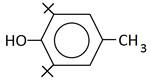
Капотен представляет собой 1-[(2S)]-3-меркапто-2-метил-пропионил]-L-пролин. Препарат применяют при лечении легкой и умеренной гипертонии, а также при тяжелых формах сердечно-сосудистых заболеваний. Химическая структура капотена позволяет прогнозировать его ингибирующую активность за счет восстановления гидропероксидов меркаптогруппой или хелатирования катализатора. Впервые антиоксидантные свойства капотена были показаны в нашей работе [8, с. 105]. Представляло интерес исследовать антиоксидантную активность капотена в процессе окисления метиллинолеата в условиях инициирования в среде хлорбензола и катализа в водно-липидной среде в сравнении с дибунолом и a-токоферолом. Формулы изучаемых соединений представлены в таблице 1.
На рис. 1. показаны КК окисления МЛ в растворе хлорбензола в присутствии широкого диапазона концентраций (1×10-6-1×10-1) М капотена. АО в безводной среде проявлял сложный механизм действия, обусловленный его вероятным участием в реакциях обрыва, продолжения и зарождения цепей. Влияние капотена заключается в том, что при одних концентрациях происходит уменьшение максимальной скорости, при других — наблюдается ускорение процесса окисления. Из таблицы 2. видно, что начальные и максимальные скорости процесса меняются экстремально: снижаются с увеличением концентрации до 1×10-4 М (соответствует соотношению инициатора и капотена 60:1) и увеличиваются при дальнейшем её повышении.
Таблица 1.
Химические формулы изучаемых антиоксидантов
|
№ п/п |
Название АО |
Формула |
|
1 |
Капотен 1-[(2S)]-3-меркапто-2-метилпропионил]-L-пролин |
|
|
2 |
Дибунол (2,6-ди-трет-бутил-4-метил-фенол) |
|
|
3 |
a-токоферол (6-гидрокси-2,5,7,8-тетраметил-2-фитилхроман) |
|
Характер воздействия капотена на процесс инициированного окисления МЛ может быть объяснен его участием в радикальном процессе. Известно [10, с. 780], что инициатор распадается с образованием радикалов по реакции:
![]()
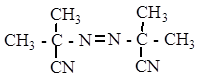

Радикал инициатора (Ri·) конкурентно взаимодействует с липидным субстратом или с меркапто-группой капотена (R1SH) по реакциям:
Ri· + RH →RiH + R·
R1SH + Ri· → RiH + R1S·
R1S·+ RH →R· + R1SH
Далее радикалы липидного субстрата (R·) и капотена (R1S·) взаимодействуют с кислородом по реакциям:
R· + O2 → RO2·
RO2· + RH → ROOH + R·
R1S· + O2 →R1SO2·
R1SO2·+ R1SH → R1SO2H + R1S·
R1S· + R1S· → R1S-SR1

Рисунок 1. Кинетика окисления метиллинолеата в безводной среде в присутствии 6×10-3 М АИБН и капотена М: 2 — контроль; 1 — 1×10-2; 3-8×10-3; 4 — 1×10-1; 5 — 5×10-4; 6 — 5×10-6; 7 — 1×10-6; 8 — 1×10-3; 9 — 8×10-4; 10 — 5×10-5, t=600 С
Наблюдаемое увеличение суммарной скорости процесса при высоких концентрациях капотена, вероятно, происходит за счет вклада более быстрого окисления АО по сравнению с окислением жирно-кислотных компонентов липидов. Снижение максимальной скорости без торможения начальных стадий окисления при небольших добавках капотена может быть связано с участием соединения в распаде гидропероксидов по молекулярному механизму:
ROOH + R1SH → ROH + R1SOH
Таблица 2.
Кинетические параметры окисления метиллинолеата в безводной среде в присутствии 6×10-3 М АИБН в зависимости от концентрации капотена, t= 600С
|
№ п/п |
[InH], М×с |
t, мин. |
Wнач.×10-8, М×с-1 |
Wmax.×10-7, М×с |
[АИБН] [InH] |
|
1 |
Контроль МЛ |
20 |
6,0 |
2,2 |
- |
|
2 |
1×10-6 |
42 |
5,0 |
1,9 |
6000 : 1 |
|
3 |
5×10-6 |
36 |
4,7 |
1,8 |
1200 : 1 |
|
4 |
5×10-5 |
90 |
4,5 |
1,7 |
120 : 1 |
|
5 |
1×10-4 |
44 |
4,5 |
1,7 |
60 : 1 |
|
6 |
5×10-4 |
36 |
4,9 |
2,0 |
12 : 1 |
|
7 |
1×10-3 |
20 |
6,0 |
2,2 |
6 : 1 |
|
8 |
1×10-2 |
30 |
7,2 |
2,4 |
1 : 1,7 |
|
9 |
1×10-1 |
22 |
8,0 |
2,8 |
1 : 17 |
На рис. 2 представлены КК каталитического окисления МЛ в водно-липидной среде в присутствии (1×10-6-1×10-1) М капотена. Показано, что все добавки АО тормозят процесс окисления. Низкие концентрации капотена (1×10-6-1×10-3) М пропорционально уменьшают начальную и максимальную скорости процесса. При концентрациях 1×10-3 М и выше происходит торможение начальных стадий процесса, увеличение периода индукции и достижение максимальной скорости после выхода из периода индукции (табл. 2). Характер влияния капотена на кинетику каталитического окисления МЛ может быть объяснен следующим образом. Капотен может участвовать в реакциях обрыва цепей, обеспечивая ингибирования процесса окисления. Снижение скорости окисления под влиянием капотена может быть обусловлено его конкурентным участием с катализатором в молекулярном распаде гидропероксидов, что сказывается на снижении скорости разветвления цепей и скорости процесса в целом:
RO2· + R1SH → ROOH +R1S·
ROOH + R1SR2 → R1SOR2 + ROH
ROOH + Cu2+ → RO2· + H+ + Cu1+

Рисунок 2. Кинетика окисления метиллинолеата в водно-липидной среде в присутствии капотена: 1 – контроль; 2 — 1×10-6 М; 3 — 1×10-5 М; 4 — 1×10-4 М; 5 — 1×10-3 М; 6 — 1×10-2 М; 7 — 1×10-1 М, 2×10-3 М CuCl2,t=600 С
Таблица 3.
Кинетические параметры окисления метиллинолеата в водно-эмульсионной среде в присутствии 2×10-3 М CuCl2 в зависимости от концентрации капотена, t= 600С
|
№ п/п |
[InH], М |
t, мин. |
Wн.×10-5, М×с |
Wмак.×10-4, М×с |
[CuCl2] [InH] |
|
1 |
Контроль |
5 |
14,4 |
2,6 |
– |
|
2 |
1×10-6 |
8 |
7,6 |
1,6 |
2000 : 1 |
|
3 |
1×10-5 |
15 |
6,9 |
1,0 |
200 : 1 |
|
4 |
1×10-4 |
26 |
6,2 |
1,6 |
20 : 1 |
|
5 |
1×10-3 |
45 |
3,6 |
1,7 |
2 : 1 |
|
6 |
1×10-2 |
95 |
2,1 |
1,7 |
1 : 5 |
|
7 |
1×10-1 |
395 |
0,6 |
1,7 |
1 : 50 |
Значимое торможение с последующим достижением максимальной скорости процесса начинается при соотношениях катализатора и капотена 1:1 и усиливается при соотношениях 1:5 и 1:50. Очевидно, что в этих условиях происходит нейтрализация катализатора за счет его восстановления в Cu1+. При большом избытке капотена восстановление Cu2+ в Cu1+ происходит быстрее, наблюдается эффективное торможение процесса окисления.
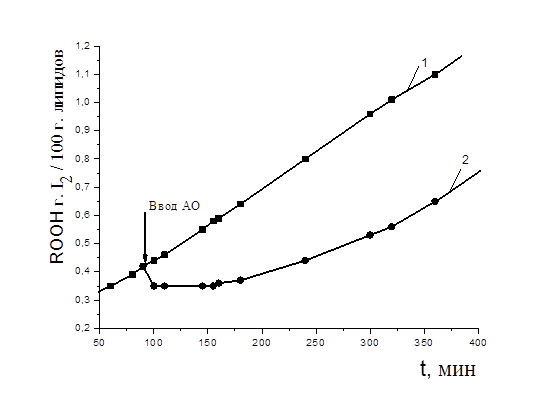
Рисунок 3. Кинетика накопления гидропероксидов при аутоокислении МО в присутствии АО: 1 — контроль, 2 — капотен. Стрелкой показан ввод АО. С (АО) = 2´10-4M, t=600 C
Для подтверждения гипотезы о возможном разрушении гидропероксидов под действием капотена, был проведен эксперимент по прямому тестированию кинетики накопления гидропероксидов (ROOH) после введения капотена в частично окисленный субстрат (время эксперимента 8 часов). В течение первого часа (рис. 3) наблюдалось снижение концентрации гидропероксидов, в контрольном опыте ROOH продолжали накапливаться. Установлено, что все исследуемые добавки капотена способствовали разрушению гидропероксидов на 50—75 %.
Сопоставление результатов двух методов (манометрического, йодометрического) показывает, что максимальное снижение начальной и максимальной скорости окисления происходило в присутствии капотена при концентрации (1-10)×10-4 М. Таким образом, указанные методы адекватно оценивают свойства исследуемого соединения и позволяют полагать, что разрушение гидропероксидов под действием капотена осуществлялось нерадикальным путем, поскольку вторичного инициирования процесса не наблюдалось.
Таблица 4.
Кинетические параметры окисления метиллинолеата в растворе хлорбензола в присутствии 6×10-3 М АИБН в зависимости от концентрации a-токоферола и дибунола, t= 600С
|
№ п/п |
[InH], М |
t, мин |
Wнач.×10-8, М×с-1 |
Wmax.×10-7, М×с-1 |
|
I |
Контроль МЛ |
15 |
4,3 |
2,6 |
|
II |
a-токоферол |
|||
|
1 |
1×10-8 |
17 |
4,3 |
2,3 |
|
2 |
1×10-7 |
20 |
3,6 |
2,0 |
|
3 |
1×10-6 |
35 |
2,5 |
1,9 |
|
4 |
1×10-5 |
44 |
2,3 |
1,8 |
|
5 |
1×10-4 |
67 |
1,1 |
1,8 |
|
6 |
5×10-4 |
120 |
0,5 |
2,0 |
|
7 |
1×10-3 |
350 |
0,6 |
1,7 |
|
8 |
1×10-2 |
405 |
0,5 |
1,8 |
|
9 |
1×10-1 |
420 |
0,2 |
1,8 |
|
III |
дибунол |
|||
|
1 |
1×10-6 |
35 |
4,3 |
2,5 |
|
2 |
1×10-5 |
45 |
3,4 |
2,4 |
|
3 |
2×10-5 |
80 |
2,8 |
2,2 |
|
4 |
5×10-5 |
140 |
2,4 |
2,2 |
|
5 |
1×10-4 |
170 |
2,1 |
2,1 |
|
6 |
2×10-4 |
190 |
1,9 |
2,0 |
|
7 |
5×10-4 |
280 |
1,7 |
1,9 |
|
8 |
8×10-4 |
590 |
1,6 |
1,9 |
|
9 |
1×10-3 |
650 |
1,6 |
1,8 |
Для доказательства свободно-радикального механизма каталитического окисления липидного субстрата использован метод ингибиторов. Проведено исследование закономерностей окисления метиллинолеата в присутствии добавок стационарных ингибиторов окисления дибунола и a-токоферола. По результатам эксперимента рассчитаны кинетические параметры окисления субстратов. Установлен идентичный характер кинетических кривых окисления липидного субстрата в растворе хлорбензола в присутствии 6×10-3 М инициатора и водно-липидной системе в присутствии 2×10-3 М хлорида меди при равных концентрациях дибунола.

Рисунок 4. Кинетика окисления метиллинолеата в присутствии добавок дибунола в водно-липидной среде, М: 1 — контроль, 2 — 1´10-5, 3 — 5´10-5, 4 — 1´10-4, 5 — 5´10-4, 2×10-3 М CuCl2,t=600 С
На рис. 4 показано, что в водно-липидной среде дибунол проявляет себя как сильный ингибитор: наблюдается период полного торможения, период аутоускорения и достижение максимальной скорости окисления. Периоды индукции увеличиваются пропорционально увеличению концентрации дибунола (табл.4). Наличие торможения в присутствии добавок дибунола является признаком радикально-цепного механизма процесса, а отсутствие комплексообразующей способности с катионами меди из-за экранированности двумя трет-бутильными заместителями его донорно-акцепторного центра. По наклону прямой в координатах t,[InH] была рассчитана скорость инициирования в обеих системах, получены значения 4,8×10-8 и 1,9×10-5 М×с-1 в безводной и водно-липидной среде соответственно (рис.5). Сравнение максимальных скоростей окисления липидных субстратов в безводной и водно-липидной средах равных 2,6×10-7 и 2,6×10-4 М×с-1 соответствует различию скоростей инициирования в 1000 раз.

Рисуннок 5. Зависимости периода индукции от концентрации дибунола в безводной среде в присутствии 6×10-3 М АИБН (1) и в водно-липидной среде в присутствии 2×10-3 М CuCl2 (2), субстрат окисления МЛ, t=600С
Известно, что a-токоферол характеризуется чрезвычайно высокой константой скорости реакции с пероксильными радикалами k7 = (3,3-3,5)´106 М-1´с-1, что на два порядка превышает аналогичные константы скорости для дибунола k7 =2,6´104 М-1ґс-1 [2]. Между тем вопрос о роли a-токоферола в биомембранах далек от своего решения. Известен сложный механизм действия a-токоферола в безводных углеводородных и липидных субстратах, его участие не только в реакциях обрыва цепей, но и реакциях продолжения цепей и распаде гидропероксидов. Последние реакции приводят к снижению антиоксидантной активности a-токоферола.
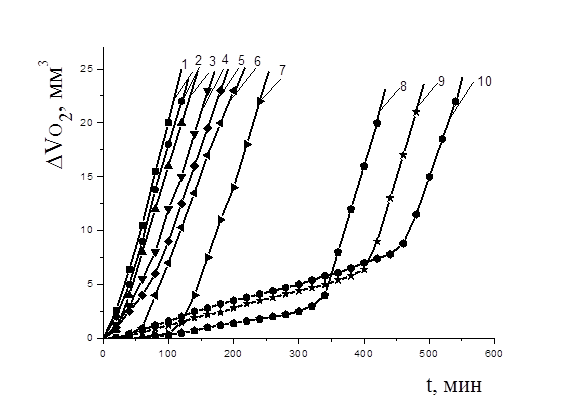
Рисунок 6. Кинетика окисления метиллинолеата в присутствии добавок α — токоферола в растворе хлорбензола, М : 1 — контроль, 2 — 1×10-8, 3 — 1×10-7, 4 — 1×10-6, 5 — 1×10-5, 6 — 1×10-4, 7 — 5×10-4. 8 — 1×10-3, 9 — 1×10-2, 10 — 1×10-1, АИБН 6×10-3 М, t= 600С
Антиоксидантную активность a-токоферола в нашем эксперименте оценивали по характеру изменения кинетических параметров по сравнению с дибунолом, для которого установлен механизм ингибирования процесса окисления в углеводородах за счет только реакций обрыва цепей [4, 5]. Анализ кинетических кривых окисления метиллинолеата показал существенные отличия механизма действия a-токоферола от дибунола в зависимости от концентрации.
КК окисления метиллинолеата в безводной среде в присутствии (1×10-8—1×10-5) М a-токоферола имеют аутоускоренный характер без периода полного торможения (рис. 6). В этом интервале концентраций начальные скорости тем меньше, чем больше добавки a-токоферола, при всех концентрациях достигается одинаковая максимальная скорость. Период полного торможения появляется только при концентрациях 1×10-4 и 5×10-4 М и меняется пропорционально концентрации. При дальнейшем повышении концентрации a-токоферола увеличивается начальная скорость окисления, сокращается период полного торможения, максимальная скорость достигается тем позже и при более высоких концентрациях поглощенного кислорода, чем выше концентрация a-токоферола. Результаты расчета начальной Wнач., максимальной Wmax. скоростей и периода индукции приведены в табл.4. Из табл.4 видно сохранение близких Wmax. при концентрациях a-токоферола от 1×10-7 до 1×10-1 М и десятикратное снижение Wнач.. Представленные результаты свидетельствуют о сложном механизме действия a-токоферола в безводном растворе МЛ, об его участии не только в реакциях обрыва, но и реакциях продолжения цепей.
На рис. 7 показано, что a-токоферол в водно-липидной среде проявлял слабые антиоксидантные свойства, в концентрациях свыше 1×10-3 М промотировал процесс окисление липидных субстратов, при концентрации 1×10-8 М a-токоферол незначительно уменьшал максимальную скорость, без заметного влияния на начальные стадии окисления. Таким же образом влияли добавки 1×10-7 и 1×10-6 М a-токоферола. В присутствии 1×10-5 и 1×10-4 М a-токоферола наблюдалось замедление начальных стадий окисления и уменьшение максимальной скорости (табл. 5). Причиной ускорения процесса может быть комплексообразование OH-группы a-токоферола с катионами меди. В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In·), способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата (RH) [2]:
In· + RH ®R· + InH
В результате этой реакции восстанавливается активная фенольная форма антиоксиданта, взаимодействующая в дальнейшем с пероксильными радикалами, ведущими цепи окисления:
RO2· + InH → ROOH +In·
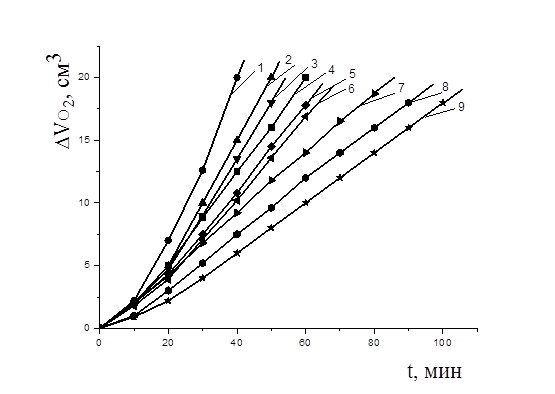
Рисунок 7. Кинетика окисления метиллинолеата в водно-липидной среде в присутствии добавок a-токоферола, М : 1 — 1×10-1, 2 — 1×10-2, 3 — 1×10-3, 4 — контроль, 5 — 1×10-8, 6 — 1×10-7,7 — 1×10-6, 8 — 1×10-5, 9 — 1×10-4; 2×10-3 М CuCl2, t=600С
Таблица 5.
Кинетические параметры окисления метиллинолеата в водно-эмульсионной среде в присутствии 2×10-3 М CuCl2 в зависимости от концентрации a-токоферола и дибунола, t=600С
|
№ п/п |
[InH], М |
t, мин |
Wнач.×10-5, М×с-1 |
Wmax.×10-4, М×с-1 |
|
I |
Контроль МЛ |
5 |
14,4 |
2,6 |
|
II |
a-токоферол |
|||
|
1 |
1×10-8 |
10 |
14,0 |
2,1 |
|
2 |
1×10-7 |
15 |
11,0 |
2,1 |
|
3 |
1×10-6 |
20 |
9,7 |
1,9 |
|
4 |
1×10-5 |
25 |
6,8 |
1,8 |
|
5 |
1×10-4 |
35 |
5,2 |
1,4 |
|
6 |
1×10-3 |
15 |
14,6 |
3,2 |
|
7 |
1×10-2 |
6 |
15,7 |
3,4 |
|
8 |
1×10-1 |
5 |
16,8 |
5,7 |
|
III |
дибунол |
|||
|
1 |
1×10-6 |
30 |
13,8 |
2,5 |
|
2 |
1×10-5 |
40 |
12,7 |
2,3 |
|
3 |
2×10-5 |
75 |
9,8 |
2,1 |
|
4 |
5×10-5 |
130 |
5,0 |
1,9 |
|
5 |
1×10-4 |
160 |
4,1 |
1,8 |
|
6 |
2×10-4 |
180 |
3,8 |
1,7 |
|
7 |
5×10-4 |
270 |
3,1 |
1,6 |
|
8 |
8×10-4 |
430 |
2,3 |
1,6 |
|
9 |
1×10-3 |
590 |
1,9 |
1,5 |
В целом, результаты настоящего исследования свидетельствуют о сложном механизме действия капотена на процесс окисления липидных субстратов. Показана возможность участия капотена в реакциях инициирования, продолжения, обрыва цепей, распада гидропероксидов и восстановления катализатора в неактивную форму. Полученные данные могут представлять интерес с точки зрения расширения спектра фармакологического действия капотена и быть методологической основой для разработки новых подходов оценки взаимодействия антиоксидантов с компонентами клетки.
Выводы:
1. Установлено, что синтетический ингибитор окисления дибунол в двух кинетических моделях в безводной и водно-липидной средах превосходит по своему действию природный антиоксидант a-токоферол.
2. Выявлена высокая антиоксидантная активность капотена в водно-липидных катализируемых субстратах, превышающая ингибирующие свойства a-токоферола и уступающая активности дибунола.
3. Установлено, что капотен в процессе окисления разрушает гидропероксиды молекулярным путем. Вероятно, что способность разрушения гидропероксидов капотеном связана с наличием меркаптогруппы.
Разработанный способ тестирования биоантиоксидантов (капотена) волюмометрическим методом с использованием каталитического окисления водно-липидных субстратов был внедрен в НИИ клинической и профилактической кардиологии СО РАМН.
Список литературы:
- Бурлакова Е.Б. Молекулярные механизмы действия антиоксидантов при лечении сердечно-сосудистых заболеваний // Кардиология. — 1980. — № 8. — С. 48—52.
- Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Кинетические особенности токоферолов как антиоксидантов. Черноголовка, 1992. — 56 с.
- Владимиров Ю.А., Суслова Т.Б., Оленев В.И. Митохондрии. Транспорт электронов и преобразование энергии. М.: Наука, 1976. — 109 с.
- Денисов Е.Т. Элементарные реакции ингибиторов окисления // Успехи химии. — 1973. — Т. 42. — № 3. — С. 361—390.
- Денисов Е.Т. Константы скорости гомолитических жидкофазных реакций. М.: Наука, 1971. — 711 с.
- Суслова Т.Б., Владимиров Ю.А. Перекисное окисление липидов в биологических мембранах // Биологические мембраны. М. — 1973. — С. 75—93.
- Перевозкина М.Г. Каталитическое окисление липидов в водных растворах в присутствии солей металлов переменной валентности // Матер. 35-й Всерос. науч. конф. «Актуальные проблемы теоретической, экспериментальной, клинической медицины и фармации». Тюмень. 2001. — С. 55—57.
- Перевозкина М.Г. / Перевозкина М.Г., Тихонова В.В., Кадочникова Г.Д., Иоанидис Н.В., Киршинбаум И.Р., Шафер М.Ж., Ушкалова В.Н. / Физико-химические закономерности окисления липидных субстратов под действием гипотензивных препаратов // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Из-во Тюм.ГУ. 1997. — С. 104—113.
- Ушкалова В.Н., Перевозкина М.Г., Барышников Э.В. Разработка способа тестирования средств антиоксидантотерапии // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Из-во Тюм.ГУ. 1997. — С. 77—82.
- Van Hook I.P., Tobolsky A.U. The thermal decomposition of 2,2’-azo-bis-iso-buthironitril // J.Amer.Chem .Coc. — 1958. — V. 80. — № 4. — P. 779—782.
дипломов




Оставить комментарий