Статья опубликована в рамках: VIII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 22 июля 2013 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
К ВОПРОСУ О ТЕРМИЧЕСКОЙ УСТОЙЧИВОСТИ АЦЕТАТОВ КАЛИЯ, РУБИДИЯ И ЦЕЗИЯ
Надиров Ермурат Галымбекович
канд. хим. наук, доцент Алматинского университета энергетики и связи, г. Алматы
Иманбекова Тохтабуби Джумадиловна
канд. техн. наук, доцент Алматинского университета энергетики и связи, г. Алматы
E-mail:
Мустафаева Назира Маматкуловна
старший преподаватель Алматинского университета энергетики и связи, г. Алматы
E-mail:
TO THE QUESTION OF THERMAL STABILITY OF POTASSIUM, RUBIDIUM AND CESIUM ACETATES
Ermurat Nadirov
candidate of chemical sciences associate professor of Almaty University of Power Engineering and Telecommunications, Almaty
Tokhtabuby Imanbekova
candidate of engineering sciences associate professor of Almaty University of Power Engineering and Telecommunications, Almaty
Nazira Mustafayeva,
senior Lecturer of Almaty University of Power Engineering an Telecommunications, Almaty
АННОТАЦИЯ
В данной работе рассматриваются вопросы термического разложения ацетатов калия, рубидия и цезия методами термографического и термогравиметрического анализов, рассматриваются два типа разложения ацетатов: кетонное и метанное, впервые определяются плотности и межплоскостные расстояния ацетатов рубидия и цезия.
ABSTRACT
This article reviews the issues of thermal decomposition of potassium, rubidium and cesium acetates using thermographic and thermogravimetric analysis; ketonic and methane methods of acetates decomposition. For the first time Rubidium and Cesium acetates’ density and interplanar spacing figures were defined.
Ключевые слова: термическая устойчивость; термограмма; экзоэффекты; пикнометрические методы; эндоэффекты.
Keywords: thermal stability; thermogram; exoeffects; pycnometric methods; endoeffects.
Термическая устойчивость и свойства ацетатов калия, рубидия и цезия изучены недостаточно. В работах [1—3] рассмотрены только влияние механизма реакции и структурных факторов на процессы кетонизации и разложения ацетатов щелочных металлов, в частности ацетатов калия, рубидия и цезия.
Изучение свойств ацетатов калия, рубидия и цезия представляет научный и практический интерес в теории комплексообразования.
Результаты исследования образований ацетона при термическом разложении ацетатов описаны в работах [1—3]. В литературе указывается, что продуктом сухой перегонки может быть и метан [3]. Однако, в этих работах мы не обнаружили подробного исследования свойств и структуры разложения ацетатов щелочных металлов. Необходимость такого исследования возникла в связи с введением их (ацетатов ![]() ) в бинарную систему в качестве комплексообразующей компоненты.
) в бинарную систему в качестве комплексообразующей компоненты.
Исследованию подвергали готовые препараты заводского изготовления (кроме ацетата цезия). Чистота препаратов была следующая:
·гидрат ацетата калия и ацетат рубидия марки «о.с.ч.»;
·ацетат цезия получали из карбоната цезия марки «о.с.ч» при обработке его перегнанной уксусной кислотой.
Все ацетаты дополнительно очищались от примесей двойной перекристаллизацией.
Термическую устойчивость ацетатов изучали с помощью пирометра Курнакова ФПК-63. Скорость нагревания 5 град/мин. В качестве эталона брали прокаленную окись алюминия. Пробы исследовали иммерсионным методом на большом универсальном микроскопе ![]() . Рентгенограммы снимали на аппарате УРС-50 ИМ в отфильтрованном медном излучении.
. Рентгенограммы снимали на аппарате УРС-50 ИМ в отфильтрованном медном излучении.
Удельный вес (плотность) ацетатов калия, рубидия и цезия определяли пикнометрическим методом [2]. В качестве пикнометрической жидкости брали циклогексан с удельным весом 0,7758 г/см3, причиной такого выбора явилась практическая нерастворимость в нем ацетатов щелочных металлов.
1. Термическая устойчивость гидрата ацетата калия.
Термическая устойчивость ацетата калия изучалась нами методами снятия термограмм на пирометре Курнакова и весов непрерывного взвешивания. Результаты исследования представлены на рисунке 1 (кривые 1—3).
Обезвоживание ацетата калия протекает ступенчато в интервале температур 30—135 °С. В начале удаляются молекулы свободной влаги (при температуре 70 °С). Этот процесс четко фиксируется на кривой изменения веса и эндоэффектом на термограмме.
Удаление кристаллизационной воды протекает во вторую очередь в интервале 100—135 °С. В пробе, выдержанной при 130 °С, под микроскопом обнаруживаются наряду с кристаллами с четкими очертаниями и зерна неопределенных форм с матовой поверхностью. Последние не реагируют на поляризованный свет. Рентгенограммы показали, что фаза аморфна.
Другая фаза безводного ацетата калия кристаллизуется в моноклинной сингонии. Она представлена крупными обломками зерен с белой блестящей поверхностью. Зерна являются агрегатами иглообразных пластинок, с тетрагональными очертаниями, наслаивающих друг на друга. Полученная коноскопическая фигура соответствует одноосной отрицательной индикатрисе.
Угол ![]() . Коэффициенты светопреломления:
. Коэффициенты светопреломления: ![]() .
.
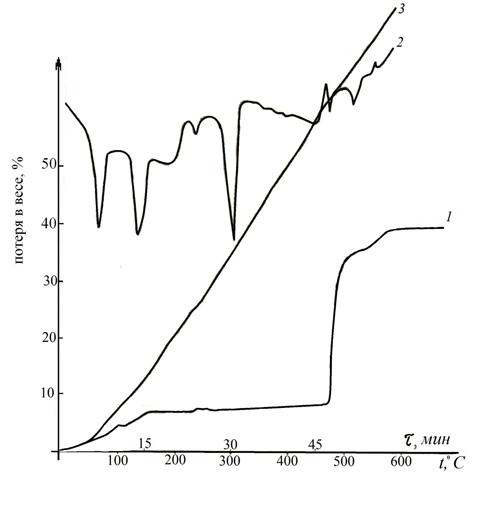
Рисунок 1. Термическое разложение ![]() : 1 — кривая изменения веса; 2,3 — термограмма с дифференциальной и простой записью
: 1 — кривая изменения веса; 2,3 — термограмма с дифференциальной и простой записью
Пикнометрическим методом определена плотность ![]() г/см3. Межплоскостные расстояния приведены в таблице 1.
г/см3. Межплоскостные расстояния приведены в таблице 1.
Безводный ацетат калия устойчив при нагревании до 466 °С. Выше 466 °С он разлагается с образованием карбоната калия, причем температурный интервал, время и степень разложения зависят от скорости нагревания.
Отщепление ![]() при температуре 475 °С (чему соответствует экзоэффект на термограмме) служит косвенным доказательством относительной прочности связи между парными молекулами. Разложение происходит по схеме:
при температуре 475 °С (чему соответствует экзоэффект на термограмме) служит косвенным доказательством относительной прочности связи между парными молекулами. Разложение происходит по схеме:
![]()
Таблица 1.
Межплоскостные расстояния одноводного ацетата калия
На термограмме нагревания ацетата калия (рисунок 1, кривые 2,3) наблюдаются пять эндотермических и два экзотермических эффектов. Эндотермические эффекты при 70 °С и 135 ° С связаны с дегидратацией соли, а эффекты при 237 °С и 303 °С связаны с превращением вещества в твердом состоянии и плавлением. Экзотермический эффект при 475 °С указывает на разложение ацетата до карбоната калия.
Убыль в весе при нагревании соли до 135 °С соответствует потере адсорбированной и кристаллизационной воды и приводит к полному обезвоживанию. В интервале 100—135 °С уменьшение в весе выражается в 4,38 %, что связано с потерей одной молекулы воды. При дальнейшем нагревании образца от 466 ° С до 510 °С наблюдается уменьшение в весе еще на 26,96 %, что указывает на интенсивное разложение ацетата калия, повторное разложение ацетата калия, повторное разложение при 548 °С уменьшает вес соли на 3,52 %.
Общая потеря в весе при разложении выражается в 30,48 %, что подтверждается теоретическими расчетами (29,58 %) при предположении следующей схемы реакции термического разложения:

2. Термическое разложение ацетатов рубидия и цезия.
На рисунке 2 (кривые 2,3) представлена термограмма разложения ацетата рубидия, которая характеризуется наличием двух эндотермических эффектов и трех экзоэффектов.

Рисунок 2. Термическое разложение ацетата рубидия: 1 — кривая изменения веса; 2,3 — термограмма с дифференциальной и простой записью
Ацетат рубидия не содержит кристаллизационной воды. Адсорбционная вода удаляется постепенно, начиная от комнатной температуры до 150 °С. Это видно по монотонному спаду кривой дифференциальной записи (рисунок 2, кривая 2) и по кривой потере в весе, 5,4 % (кривая 1). При 169 °С происходит структурное упорядочение, о чем свидетельствуют эндоэффект на термограмме, данные удельной электропроводности и рентгенограммы ацетата рубидия (таблица 2). Соль плавится при 227 °С и начинает разлагаться при 335 °С (экзоэффект на кривой 2 и скачок на кривой 1, соответствующий потере 19,58 %, по видимому, являются эффектами разложения соли на карбонат и ацетон и кипения последнего). Экзоэффекты при 439 °С и 490 °С без потери в весе, возможно, свидетельствуют о перестройках в структуре карбоната рубидия.
Теоретические расчеты потерь в весе при условии разложения ацетата рубидия на карбонат и ацетон дают значения 20,07 %, что хорошо совпадает с экспериментально полученным значением потерь.
На рисунке 3 (кривые 2,3) представлена термограмма разложения ацетата цезия. Как видно из рисунка, потеря воды сопровождается без эффекта, плавным понижением кривой дифференциальной записи. Ацетат цезия не имеет кристаллизационной воды, а происходит постепенное удаление свободной воды в интервале температур от комнатной до 100 °С.
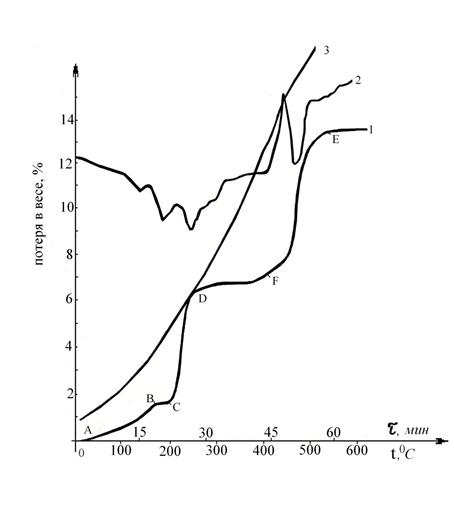
Рисунок 3. Термическое разложение ![]() : 1 — кривая изменения веса; 2,3 — термограмма с дифференциальной и простой записью
: 1 — кривая изменения веса; 2,3 — термограмма с дифференциальной и простой записью
На термограмме отчетливо проявляются четыре эндоэффекта и один экзоэффект. Эндоэффект при 136 °С соответствует полиморфному превращению ацетата цезия в твердом состоянии. Это подтверждается данными удельной электропроводности и рентгенограммами, снятыми до и после эффекта. Пробы были выдержаны по пол-часа при температурах 125 °С и 145 °С в автоклаве. Рентгенограммы различаются не только интенсивностью линий, но и их положением. Эндоэффект при 180 °С соответствует плавлению чистой соли, и при 241 °С происходит эффект разложения, а эндоэффект при 450 °С указывает на выгорание продукта разложения.
Кривая потери в весе в начальном участке АВ (рисунок 3, кривая 1) имеет монотонный характер подъема, что связано с уходом адсорбированной воды (1,45 %). В области СD скачкообразное изменение потерь (5,21 %) указывает на процесс разложения соли. На участке DF в интервале температур 241—420 °С получается термически устойчивый состав. Выше 450 °С на отрезке FE идет интенсивное повторное разложение продуктов (6,67 %), т. е. дальнейшее выгорание угля. Экспериментальные данные суммарных потерь в весе соответствуют 11,88 %.
Расчеты дают удовлетворительную сходимость с данными эксперимента при предложении разложения соли по схеме с образованием карбоната, газообразного метана, углистой фракции и воды. Потеря в весе при полном выгорании метана и удаления воды равна по расчету 9,52 % и при учете выгорания угля 13,26 %.
Таким образом, термические разложения ацетатов рубидия и цезия происходят по следующим схемам:


Как видно из сопоставления результатов термограмм и кривых потерь в весе ацетатов рубидия и цезия, характер разложения их различен. Ацетат цезия разлагается при более низкой температуре и процесс протекает в две стадии 210—240 ° С и 405—525 °С. Если схема разложения ацетата рубидия похожа на разложение других ацетатов (![]() и т.д.), то ацетат цезия разлагается иначе, и схема разложения подобна процессу разложения ацетата натрия.
и т.д.), то ацетат цезия разлагается иначе, и схема разложения подобна процессу разложения ацетата натрия.
Характер связи в ацетате цезия по сравнению с ацетатом рубидия выражен несколько слабее (вследствие значительной разницы в поляризующих действиях ионов ![]() и
и ![]() ), устойчивость ацетатов невелика, хотя вполне достаточна, чтобы измерить проявление индивидуальных свойств солей до температуры разложения.
), устойчивость ацетатов невелика, хотя вполне достаточна, чтобы измерить проявление индивидуальных свойств солей до температуры разложения.
Соли ацетата рубидия и цезия сильно гигроскопичны, и рассмотреть кристаллы под микроскопом не удается, вследствие разрушающего действия молекул воды. Однако нам удалось измерить плотность и снять рентгенограммы солей. Плотность ацетата рубидия по четырем измерениям оказалась равной 2,061 г/см3, ацетата цезия — 2,423 г/см3. Межплоскостные расстояния приведены в таблице 2.
Таблица 2.
Межплоскостные расстояния ацетатов рубидия и цезия
|
|
|
||
|
|
|
|
|
|
20,0 |
1,575 |
100,0 |
1,717 |
|
15,0 |
1,718 |
3,28 |
1,818 |
|
10,0 |
1,881 |
15,7 |
1,952 |
|
16,6 |
2,171 |
81,5 |
2,285 |
|
43,3 |
2,277 |
3,28 |
2,380 |
|
63,5 |
2,494 |
34,2 |
2,516 |
|
6,66 |
2,690 |
3,94 |
2,776 |
|
23,3 |
2,869 |
5,26 |
3,026 |
|
16,6 |
2,958 |
5,26 |
3,080 |
|
13,2 |
3,365 |
72,3 |
3,421 |
|
100,0 |
3,533 |
9,21 |
4,509 |
|
30,0 |
3,888 |
75,0 |
6,766 |
|
13,3 |
4,093 |
31,5 |
7,442 |
|
16,6 |
4,588 |
14,4 |
10,57 |
Таким образом, в стадии разложения ацетатов калия и рубидия из двух молекул ацетата образуется четырехчленный активированный молекулярный комплекс, имеющий вид, приведенный на рисунке 4, причем пунктиром показаны образующиеся связи, а волнистым значком ![]() рвущиеся при распаде этого активированного комплекса. Структура комплекса такова, что его стабильность в значительной степени является функцией ионного радиуса металла, т. е. зависит от поляризующего действия иона металла. Комплекс распадается с образованием ацетона и карбоната.
рвущиеся при распаде этого активированного комплекса. Структура комплекса такова, что его стабильность в значительной степени является функцией ионного радиуса металла, т. е. зависит от поляризующего действия иона металла. Комплекс распадается с образованием ацетона и карбоната.

Рисунок 4. Четырехчленный активированный молекулярный комплекс
Наличие воды в конечных продуктах разложения ацетата цезия, в проведенных нами опытах, подтверждает мнение, что решающее влияние на метанное разложение ацетата может оказать присутствие следов воды. Однако, в процессе разложения и конечных продуктах нами ![]() не обнаружен. Поэтому мы склонны думать, что схема термического разложения с образованием метана
не обнаружен. Поэтому мы склонны думать, что схема термического разложения с образованием метана ![]() не применима к процессу распада цезия.
не применима к процессу распада цезия.
Список литературы:
- Пантелеев И.А., Семенов С.Г., Глебовский Д.Н. Природа мостиковых связей в димерах ацетатов лития и калия // ЖОХ. — 2005. — т. 75. вып. 9. 1479—1484 с.
- Рубинштейн А.М., Якерсон В.И. Процессы кетонизации и разложения ацетатов щелочных металлов // Кинетика и катализ. — 1960. — вып. 30. 2789 с.
- Якерсон В.И., Рубинштейн А.М. Процессы кетонизации и разложения ацетатов щелочных металлов // Кинетика и катализ. — 1960. — вып. 2 1961. — 181 с.
дипломов


Оставить комментарий