Статья опубликована в рамках: VIII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 22 июля 2013 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
pН ГИДРАТООБРАЗОВАНИЯ В РАСТВОРАХ Y(III), CE(III), SM(III)
Лобачева Ольга Леонидовна
доцент, канд. хим. наук, Национальный минерально-сырьевой университет «Горный», Санкт-Петербург
Джевага Наталья Владимировна
канд. хим. наук, Национальный минерально-сырьевой университет «Горный», Санкт-Петербург
E-mail: dzhevaga331@mail.ru
pH OF THE HYDTATE FORMATION IN Y(III), CE(III), SM(III) SOLUTIONS
Lobacheva Olga Leonidovna
associate professor, PhD, National Mineral Resources University “Mining”,
Saint-Petersburg
Dzhevaga Natalia Vladimirovna
assistant, PhD, National Mineral Resources University “Mining”,
Saint-Petersburg
АННОТАЦИЯ
Методом кондуктометрического титрования определены значения рН гидратообразования в растворах нитратов Y, Ce, Sm в степенях окисления +3. Вычислены произведения растворимости и энергии Гиббса образования гидроксидов перечисленных элементов. Обнаружено, что энергия Гиббса растворения гидроксидов лантаноидов составляет в среднем 149,83 ± 0,90 кДж/моль. На этом основании оценены энергии Гиббса образования гидроксидов остальных лантаноидов.
ABSTRACT
The values of the pH hydrate formation in nitrate solutions of Y, Ce, Sm in oxidation states — (+3) were defined by the method of the conductometric titration. Solubility product and the Gibbs energy formation of the hydroxides of listed items were calculated. The Gibbs energy of dissolution of hydroxides of lanthanides are about 149,83±0,90 Kj/mol. The Gibbs energy of formation hydroxides of the rest lanthanides on this basis were estimated.
Ключевые слова: Редкоземельные элементы; рН гидратообразования; энергия Гиббс; комплексообразование
Keywords: rare-earth elements; pH values of hydrate formation; Gibb’s Energy; complex formation
В современной справочной литературе [3, с. 95; 5, с. 5; 6, с. 331; 8, с. 79] наблюдаются значительные, в некоторых случаях более 100 кДж/моль, расхождения в значениях энергий Гиббса образования гидроксидов лантаноидов. Уточнение этих величин необходимо для расчета рН гидратообразования и прогнозирования оптимальных условий для извлечения и разделения лантаноидов методом ионной флотации, так как считают, что резкое возрастание степени извлечения происходит в области рН гидратообразования [4, с. 55; 7, с. 468]. Поэтому предпринято определение рН гидратообразования в растворах нитратов лантаноидов c расчетом произведений растворимости и энергий Гиббса образования соответствующих гидроксидов.
Использован метод кондуктометрического титрования. Аликвоты по 10 мл растворов нитратов иттрия(III), церия(III), самария(III) с концентрацией 0,001 моль/кг1, подкисленные HNO3 до рН около 4, титровали 0,00204 н. раствором NaOH. После добавления каждой порции 0,5—1,0 мл раствора щелочи смесь перемешивали до установления постоянного значения удельной электропроводности, которую измеряли с помощью кондуктометра марки «Анион 4100». Параллельно измеряли рН с помощью иономера «Анион 7010». По результатам строили кривые титрования. В работе использовали гексагидраты нитратов иттрия марки «ч.д.а.», самария — марки «х.ч.», На кривых кондуктометрического титрования выделяются следующие участки.
1)линейное понижение удельной электропроводности вследствие нейтрализации азотной кислоты щелочью; 2) при рН 5,0—5,5 на зависимости удельной электропроводности от объема добавленной щелочи наблюдается резкий излом с переходом к почти горизонтальному участку, что свидетельствует о связывании добавляемых гидроксид-анионов в малодиссоциированное соединение. Так как образования гидроксидов не наблюдали (Dоптич.плотность растворов не изменялась), этот участок отвечает образованию гидроксокомплексов. По количеству миллиэквивалентов NaOH и изломов на кривых титрования определили, что в случае Sm и Eu образуются только моногидроксокомплексы Ln(OH)2+, а в случае Y — кроме моногидроксокомплексов образуются также дигидроксокомплексы Ln(OH)2+.
По окончании комплексообразования наблюдается небольшой участок кривой титрования, на котором удельная электропроводность растет вследствие накопления избытка NaOH. При рН около 6,5 начинается 2-ой — почти горизонтальный участок кривой титрования, отвечающий образованию гидроксидов. Последнее наблюдали визуально и подтверждали возрастанием D растворов. На зависимости рН от V добавленной щелочи в этой области также наблюдается близкий к горизонтальному участок.
Значения рН, отвечающие началу этого участка, были приняты в качестве рН гидратообразования рНhydr. Количество миллиэквивалентов NaOH, израсходованной на этих участках, отвечало протеканию реакций:
Ln(OH)+ + 2 OH– = Ln(OH)3 в случае Sm и Eu или Ln(OH)2+ + OH– = Ln(OH)3 в случае Y. Далее на кривых титрования наблюдается почти линейный рост удельной электропроводности, обусловленный избытком NaOH.
Произведения растворимости гидроксидов рассчитывали по формуле: ![]() (1), где концентрация катионов металлов с учетом разбавления раствора в ходе титрования составляла от 1,46 1-4 до 5,41 10-4 моль кг-1, среднеионный коэффициент активности соли лантаноида принимали равным таковому для LaCl3 при данной концентрации согласно [1, с. 125], значения составляли от 0,75 до 0,81 соответственно. Погрешности значений рНhydr рассчитывали по формуле [2, с. 102]:
(1), где концентрация катионов металлов с учетом разбавления раствора в ходе титрования составляла от 1,46 1-4 до 5,41 10-4 моль кг-1, среднеионный коэффициент активности соли лантаноида принимали равным таковому для LaCl3 при данной концентрации согласно [1, с. 125], значения составляли от 0,75 до 0,81 соответственно. Погрешности значений рНhydr рассчитывали по формуле [2, с. 102]:
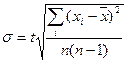 (2)
(2)
где: n — число точек на соответствующем участке кривой титрования,
xi — измеренные значения рН,
t — коэффициент Стьюдента при доверительной вероятности 0,95. На основе погрешности определения рНhydr находили погрешности величин произведений растворимости и энергий Гиббса растворения гидроксидов лантаноидов и иттрия.
Как следует из полученных данных, Y существенно отличается от лантаноидов, его гидроксид термодинамически менее устойчив. У изученных нами лантаноидов свойства гидроксидов близки, рН гидратообразования в среднем составляет 6,48±0,08, а энергия Гиббса растворения 149,83±0,90 кДж моль-1. На основе полученного среднего значения энергии Гиббса растворения гидроксидов лантаноидов была произведена оценка энергий Гиббса их образования. Энергии Гиббса образования гидроксидов лантаноидов и иттрия вычисляли по уравнению:
![]() (3)
(3)
Выводы
1. методом кондуктометрического титрования растворов нитратов лантаноидов и иттрия щелочью определены рН гидратообразования, на основе которых вычислены произведения растворимости и энергии Гиббса образования гидроксидов иттрия, самария, европия в степенях окисления +3.
2. установлено, что рН гидратообразования в исследованных растворах лантаноидов в среднем равен 6,48±0,08, а энергия Гиббса растворения изученных гидроксидов лантаноидов равна 149,83±0,90 кДж моль-1. На этом основании оценены энергии Гиббса образования остальных гидроксидов лантаноидов.
Работа выполнена согласно проекту ГК № 0622 от 05.10.2010.
Список литературы:
- Белоглазов И.Н., Эль-Салим С.З. Обработка результатов эксперимента. «Руда и металлы». 2004. — 142 с.
- Корольков Д.В., Скоробогатов Г.А.. Основы теоретической химии. М.: Академия. 2004. — 165 с.
- Лидин Р.А., Андреева А.А., Молочко А.В. // Справочник. Константы неорг. в-в. Изд. «Двора». М. 2006. — 360 с.
- Равдель А.А., Пономарева А.М. / Краткий справочник физико-химических величин. 2003. — 240 с.
- Чиркст Д.Э., Лобачева О.Л., Берлинский И.В. Термодинамические свойства гидроксосоединений и механизм ионной флотации церия, европия и иттрия // Журн. физич. химии. № 11. Т. 83. 2009. С. 1—6.
- Diakonov I.I., Ragnarsdottir K.V., Tegirov B.R. Standard thermodynamic properties and heat capacity equations of rare earth hydroxides: II. Ce(III)-, Pr- Sm-, Eu(III)-, Gd-, Tb-, Dy-, Ho-, Er-, Tm-, Yb-, and Y-hydroxides. Comparison of thermochemical and solubility data // Chemical Geology. 1998. 151 (1—4), Р. 327—347.
- Gassett B.B., Otis J.S., Peter F.A. The influence of various parameters on foam separation // J.Water Pollution Control Fed. 1965. — V. 37. № 4. Р. 460—470.
- Grieves R.B., Charewicz W.R. // Sep.Sci. 1975. — V. 10. № 1. Р. 77—92.
дипломов


Оставить комментарий