Статья опубликована в рамках: VIII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 22 июля 2013 г.)
Наука: Химия
Секция: Биоорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
APETX2-ПОДОБНЫЕ ТОКСИНЫ АКТИНИИ HETERACTIS CRISPA
Калина Римма Сергеевна
студент, Федеральное государственное автономное образовательное учреждение высшего профессионального образования Дальневосточный Федеральный Университет, г. Владивосток
E-mail: kalinarimma@gmail.com
Гладких Ирина Николаевна
канд. хим. наук, науч. сотр. лаборатории химии пептидов, Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук, г. Владивосток
Кошелев Сергей Геннадьевич
канд. биол. наук, с.н.с. лаборатории нейрорецепторов и нейрорегуляторов, Федеральное государственное бюджетное учреждение науки Институт биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук, г. Москва
Монастырная Маргарита Михайловна
д-р хим. наук, в.н.с. лаборатории химии пептидов, Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук, г. Владивосток
Козловская Эмма Павловна
д-р хим. наук, профессор, Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук, г. Владивосток
APETX2-LIKE TOXINS FROM ACTINIA HETERACTIS CRISPA
Kalina Rimma
student, Far Eastern Federal University, Vladivostok
Gladkikh Irina
candidate of chemical sciences, research worker of the laboratory of Peptide Chemistry, G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch, Russian Academy of Sciences, Vladivostok
Koshelev Sergej
candidate of biological sciences, senior research worker of the laboratory of
neuroreceptors and neuroregulators, M.M. Shemyakin and Yu.A. Ovchinikov Institute of Bioorganic Chemistry of the Russian Academy of Sciences, Moscow
Monastyrnaya Margarita
doctor of Chemistry, leading research worker of the laboratory of Peptide Chemistry, G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch, Russian Academy of Sciences, Vladivostok
Kozlovskaya Emma
doctor of Chemistry, professor, G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch, Russian Academy of Sciences, Vladivostok
АННОТАЦИЯ
Описано выделение и определение биологической активности APETx2-подобных токсинов из актинии Heteractis crispa — модуляторов ASICs каналов.
ABSTRACT
Process of purification and determination of biological activity of the APETx2-like toxins from the sea anemone Heteractis crispa, channel modulators of ASICs, is described.
Ключевые слова: актинии; APETx2; ASICs.
Key words: sea anemones; APETx2; ASICs.
Работа поддержана грантом Президиума РАН № 12-I-P6-10 «Молекулярная и клеточная биология» и грантом ДВО РАН № 13-III-В-05-075 «Новые токсины ASICs-каналов из актинии Heteractis crispa".
Среди морских организмов, продуцирующих биологически активные соединения, особое место занимают морские кишечнополостные, актинии. Их яды содержат широкий спектр белковых компонентов, в том числе нейротоксины-модуляторы ионных каналов и ионотропных рецепторов (Na+, K+, Са2+, ASICs и др.), участвующих в формировании болевого сигнала и его передаче в ЦНС [9]. Направленное действие на различные биологические мишени и огромное структурное разнообразие нейротоксинов позволяют использовать их для создания высокоспецифичных обезболивающих препаратов, а также в качестве инструментов изучения строения и механизмов функционирования ионных каналов.
К настоящему времени обнаружено лишь два полипептидных токсина актиний, ингибирующих кислоточувствительные ASICs каналы: APETx2 (4557,96 Да), продуцируемый актинией Anthopleura elegantissima, который обратимо ингибирует ASIC3, ASIC2b+3, ASIC1a+3 и ASIC1b+3 каналы крысы [6], и π-AnmTX Hcr 1b-1 (4537 Да), полученный нами из H. crispa, ингибирующий ASIC3 каналы человека [3].
Недавно из 70 %-ного этанольного экстракта H. crispa с помощью гидрофобной хроматографии на полихроме-1 и последующей ОФ-ВЭЖХ получено одиннадцать фракций полипептидов (рис. 1, А, Б), значения молекулярных масс которых, по данным MALDI-TOF MS, варьировали от 4500 до 5000 Да (рис. 1, В-И). Тестирование полипептидных фракций 5, 7, 9 и 10 in vivo на модели кислотной стимуляции боли показало, что они проявляют анальгетическую активность [1]. При электрофизиологическом исследовании на ASICs каналах, экспрессированных в мембранах ооцитов лягушки Xenopus laevis, было обнаружено, что наибольшей ингибирующей активностью обладают полипептиды 9-ой фракции: они блокируют ASIC3 каналы человека на 74 %, а ASIC1а каналы крысы — на 57 % (рис. 2). Очевидно, токсины, содержащиеся во фракциях 5—10, являются представителями мультигенного семейства, о чем свидетельствует их большое количество и близость молекулярных масс (рис. 1, В-И). Это затрудняет получение полипептидов в индивидуальном состоянии и требует применения методов молекулярной биологии. Ранее наличие мультигенных семейств было обнаружено нами для пороформирующих токсинов и ингибиторов протеиназ семейства Кунитца, продуцируемых актинией H. Crispa [2, 5].
Согласно множественному выравниванию полипептиды, выделенные из H. сrispa, можно отнести к группе АРЕТх2-подобных токсинов (рис. 3), среди которых детально охарактеризованы АРЕТх1, АРЕТх2 и АРЕТх3 из A. elegantissima, специфично ингибирующие калиевый канал HERG, ASIC3 и NaV1.2—NaV1.8 каналы соответственно [4, 6, 7], π-AnmTX Hcr 1b-1 из H. crispa, ингибирующий ASIC3 [3], а также токсины BDS-I и BDS-II из Anemonia viridis [11], блокирующие каналы подтипов KV3.1, 3.2, 3.4; мишени остальных токсинов [8, 10] пока не известны.
Следует отметить высокую степень гомологии аминокислотных последовательностей АРЕТх1 и АРЕТх2 (73,8 %) и более низкую с π-AnmTX Hcr 1b-1 (50 %). Тем не менее, это позволит использовать их для установления структур АРЕТх2-подобных токсинов методами молекулярной биологии.
Рисунок 1. Профиль элюции полипептидов, содержащихся в 70 %-ном этанольном экстракте H. crispa, полученный (А) в результате гидрофобной хроматографии на полихроме-1; (Б) ОФ-ВЭЖХ полипептидной фракции пика 4 (рис. 1, А) на колонке Nucleosil C18. Отмечены границы объединения активных фракций. (В-И) Масс-спектры полипептидов (рис. 1, Б), содержащихся во фракциях 5 (В), 6 (Г), 7 (Д), 8 (Е), 9 (Ж), 10 (З), 11 (И)
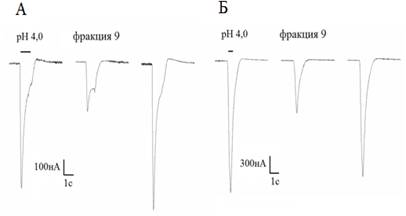
Рисунок 2. Записи токов через ASIC3 каналы человека (А) и ASIC1а каналы крысы (Б), экспрессированные в ооцитах лягушки X. laevis. Токи индуцированы полипептидной фракцией 9 (рис. 1, Б) и изменением значения рН буферного раствора от 7,8 до 4,0. Клетки фиксированы при потенциале —50 мВ, скорость потока раствора ~1 мл/мин
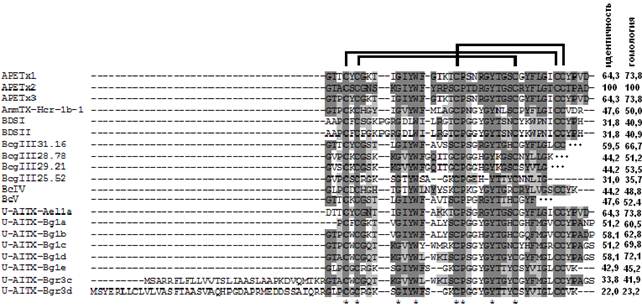
Рисунок 3. Множественное выравнивание аминокислотных последовательностей APETx1–APET3, U-AITX-Ael1a из A. Elegantissima [4, 6, 7, 10], BDS-I и BDS-II из A. Viridis [11], π-AnmTX Hcr 1b-1 из H. Crispa [3], Bcg III из Bunodosoma сangicum [8], Bc IV, V из B. Сaissarum [8] и U-AITX-Bg1a, b, c, d, e из B. Granulifera [10]. Выравнивание выполнено с помощью программы CLUSTALW. Идентичные и консервативные участки отмечены темным и светлым оттенками серого цвета соответственно. Звездочками обозначены высоко консервативные а.о., cверху показана схема расположения дисульфидных мостиков
Список литературы:
- Калина Р.С., Поиск новых токсинов ASIC3-каналов из актинии Heteractis crispa // XIV Всероссийская молодежная школа-конференция по актуальным проблемам химии и биологии: Тез. докл. Владивосток: ТИБОХ ДВО РАН. — 2012. — С. 18.
- Новые актинопорины актинии Heteractis crispa: клонирование и функциональная экспрессия / Е.С. Ткачева и др. // Биохимия. — 2011. — Т. 76. № 10. — С. 1387—1397.
- Полипептидный токсин из морской анемоны, ингибирующий протон-чувствительный канал ASIC3 / С.А. Козлов и др. // Биоорган. химия. — 2012 — Т. 38. № 6. — С. 653—659.
- A natural point mutation changes both target selectivity and mechanism of action of sea anemone toxins / S. Peigneur et all. // FASEB J. — 2012. Vol. 26. № 12. — P. 5141—5151.
- A new multigene superfamily of Kunitz-type protease inhibitors from sea anemone Heteractis crispa / M.P. Isaeva et all. // Peptides. — 2012. — V. 34. № 1. — Р. 88—97.
- A new sea anemone peptide, APETx2, inhibits ASIC3, a major acid-sensitive channel in sensory neurons / S. Diochot et all. // EMBO J. — 2004. — Vol. 23. — P. 1516—1525.
- APETx1, a new toxin from the sea anemone Anthopleura elegantissima, blocks voltage-gated human ether-a-go-go-related gene potassium channels / S. Diochot et all. // Mol. Pharmacol. — 2003. — V. 64 — P. 59—69.
- BcIV, a new paralyzing peptide obtained from the venom of the sea anemone Bunodosoma caissarum. A comparison with the Na+-channel toxin BcIII / J.S. Oliveira et all. // Biochim. Biophys. Acta. — 2006. — V. 1764. — P. 1592—1600.
- Honma T. Peptide toxins in sea anemones: structural and functional aspects / T. Honma, K. Shijmi // Mar. Biotechnol. — 2005. — Vol 8. № 1. — P. 1—10.
- Peptide fingerprinting of the neurotoxic fractions isolated from the secretions of sea anemones Stichodactyla helianthus and Bunodosoma granulifera. New members of the APETx-like family identified by a 454 pyrosequencing approach / A.A. Rodríguez et all. // Peptides. — 2012. — Vol. 34. — P. 26—38.
- Sea anemone peptides with a specific blocking activity against the fast inactivating potassium channel KV3.4 / S. Diochot et all. // J. Biol. Chem. — 1998. — Vol. 273. — P. 6744—6749.
дипломов


Оставить комментарий