Статья опубликована в рамках: V Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 28 апреля 2013 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СИНТЕЗ И СВОЙСТВА ОСНОВАНИЯ ТРЕГЕРА С ФРАГМЕНТАМИ ПРОТОННОЙ ГУБКИ
Власенко Марина Павловна
инженер ЮФУ, г. Ростов-на-Дону
E-mail: mvlasen@mail.ru
Озерянский Валерий Анатольевич
д-р хим. наук, профессор ЮФУ, г. Ростов-на-Дону
E-mail:
Старикова Зоя Александровна
канд. хим. наук, ст. научн. сотрудник ИНЭОС, г. Москва
E-mail:
Основание Трегера (или 2,8-диметил-6H,12H-5,11-метанодибензо[b,f] [1, 5]диазоцин) было впервые синтезировано в 1887 году [8] из п-толуидина и формальдегида в растворе кислоты Ю. Трегером. Однако структура соединения была расшифрована лишь в 1935 году [7]. Позже было показано, что это вещество может быть синтезировано не только при реакции с формальдегидом, но и в системе ДМСО/соляная кислота [3] или с использованием гексаметилентетрамина (НМТА) [4].
Основание Трегера — первое соединение с третичными асимметрическими атомами азота. Именно на примере 2,8-диметил-6H,12H-5,11-метанодибензо[b,f] [1, 5]диазоцина было показано, что не только атомы углерода, но и атомы азота способны образовывать хиральный центр в молекуле. Разделение энантиомеров основания было впервые проведено В. Прелогом в 1944 году [8].
С тех пор, хиральные сольватирующие агенты и основания имеют большое фундаментальное и прикладное значение. Кроме того, молекула основания Трегера может рассматриваться как молекулярный пинцет, поскольку бициклический С, N-скелет жестко зафиксирован ароматическими кольцами, находящимися в непосредственной близости, что придает всей системе V-образную форму с межплоскостным углом между двумя фрагментами около 95о[5]. Это вещество находит широкое применение в качестве молекулярного распознавателя и хирального сольватирующего агента.
Целью нашей работы было получение основания Трегера, содержащего фрагменты протонной губки [1], изучение его структуры, способности к протонированию, а также некоторых химических свойств.
Основание Трегера на основе протонной губки было получено с высоким выходом при циклоконденсации 1-амино-4,5-бис(диметиламино)нафталина с параформом по аналогии с работой [6]. Присоединение метиленового мостика в субстрате возможно по положению 5, с образованием соединения 1 или по положению 3. Однако проведенный эксперимент показал, что в ходе реакции образуется только соединение 3. Кроме того, нами было показано, что используемый нами субстрат 2 вступает в реакцию циклоконденсации гораздо быстрее, чем соединения, описанные в литературе [6].
Полученное основание Трегера кристаллизуется из этилацетата в двух полиморфных формах: в виде игл и кубиков, плавящихся при почти одинаковой температуре. Структура вещества была подтверждена данными корреляционной ЯМР 1Н и 13С спектроскопии, масс-спектрометрией. Кроме того, для кубических кристаллов основания, полученных упариванием рацемического раствора соединения 3 в этилацетате, был проведен рентгеноструктурный анализ. Результаты РСА, полученные для одной из независимых молекул, представлены на рисунке 1.
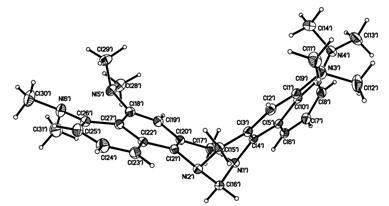
Рисунок 1. Общий вид и обозначение атомов в молекуле (±)-4,5,12,13-тетракис (диметиламино)-7H,15H-8,16-метанодинафто[1,2-b:1`,2`-f]-1,5-диазоцина, эллипсоиды теплового движения атомов показаны на уровне 50 %
Интересно, что в этих условиях основание Трегера кристаллизуется в виде сольвата C31H38N6·0.25EtOAc, причем разупорядоченная молекула этилацетата заключена в полости между двумя разными энантиомерами основания 3 (рисунок 2). Диэдральный угол между плоскостями нафталиновых систем при этом сокращается от 104о в «свободных» молекулах до 92о в молекулах, участвующих в клатратообразовании.
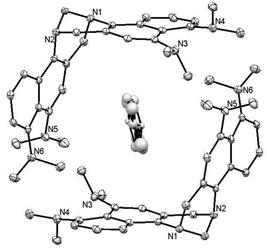
Рисунок 2. Образование клатрата между молекулами 3 и этилацетатом (атомы водорода не показаны)
Поведение этого вещества оказалось высокоспецифичным. Так, его протонирование, в отличие от классических оснований Трегера, затрагивает сначала остатки протонной губки, а не гетероциклическое ядро. Серия экспериментов с привлечением метода динамического ЯМР выявила высокую конфигурационную устойчивость нового соединения, как в нейтральном виде (не подвергается энантиомеризации до 120оС), так и в кислой среде (до 75оС).
По данным ЯМР 1Н-спектроскопии вещество 3 легко образует дикатион 4 и способно протонироваться далее.

Интересно, что попытка его кватернизации не дает продукта алкилирования по гетероциклическому азоту N1 или N2 (рисунок 2). Нагревание основания с 250 кратным избытком йодметана в хлороформе или толуоле постепенно приводит к выпадению осадка, который оказался дигидройодидом 6, т. е. протекает дегидрогалогенирование галогеналкана., а не образование четвертичной соли. Этот факт косвенно указывает на высокую нуклеофильность (из-за донорного эффекта четырех диметиламиногрупп) диазоциновых атомов азота. Нуклеофильность NMe2-групп в протонных губках, как известно, сильно понижена [1].
Введение основания Трегера 3 в реакцию с ещё одним эквивалентом параформа в полифосфорной кислоте приводит к раскрытию гетероциклической связки N–CH2–N и образованию с выходом около 40% нового соединения, кристаллизующегося из н-гексана при сильном охлаждении в виде мелких светло-бежевых игл. По данным ЯМР 1Н, 13С и масс-спектрометрии полученному веществу была приписана структура 4,5,12,13-тетракис(диметиламино)-16-метил-15,16-дигидродинафто[1,2-b:1',2'-f] [1, 5]диазоцин-8(7H)-карбальдегида (7).
В результате затрудненного внутреннего вращения, характерного для подобных гетероциклических амидов, многие сигналы в углеродных и протонных спектрах ЯМР диазоцина 7 сильно двоятся из-за фиксации цис- и транс-форм.
Экспериментальная часть.
(±)-4,5,12,13-Тетракис(диметиламино)-7H,15H-8,16-метанодинафто[1,2-b:1`,2`-f]-1,5-диазоцин получали из амина 2 [1] по аналоги с работой [6], время реакции — 8 ч. Спектр ЯМР 1Н (250 МГц, CDCl3, d, м. д., J/Гц): 2,65 (с, 12 H, 5,13-NMe2), 2,74 (с, 12 H, 4,12-NMe2), 4,23 (д, J = 17,0, 2 H, 7-Н (endo), 15-H (endo)), 4,56 (с, 2 H, CH2), 4,80 (д, J = 17,0, 2 H, 7-Н (exo), 15-H (exo)), 6,39 (c, 2 H, 6-Н, 14-H), 6,93 (дд, J = 7,4, J = 1,0, 2 H, 3-Н, 11-H), 7,41 (т, J = 7,9, 2 H, 2-Н, 10-H), 7,97 (дд, J = 8.2, J = 1,0, 2 H, 1-Н, 9-H). Спектр ЯМР 13C (150 МГц, CDCl3, d, м. д., J/Гц): 43,9 (уш. с, 5,13-NMe2), 46,1 (4,12-NMe2), 56,7 (NCH2C), 69,1 (NCH2N), 112,0 (C-6,14), 113,7 (C-3,11), 116,8 (C-1,9), 121,6, 125,6, 126,8 (C-2,10), 134,6, 138,2, 148,8, 152,5. Масс-спектр, m/z (Iотн (%)): 494 [M]+ (19), 480 [M — CH2]+ (2), 449 (3), 247 (6), 222 (9), 209 (19), 197 (13), 182 (11), 168 (10), 154 (6), 139 (5), 58 (100), 44 (14), 30 (8). Кристаллографические данные и параметры рентгеноструктурного эксперимента: C32H40N6O0.50, 100 K, триклинная, P-1, a = 12,0196(8), b = 16,0292(10), c = 16,8253(11), α= 116,5110(10)°, β= 99,6990(10)°, γ= 92,0810(10)°, V = 2836,4(3) Å3, Z= 4, Dвыч= 1,210 г см–3, m= 0,074 мм–1, число отражений: всего 25781/независимых 13587, число параметров 708, R1 = 0,0747.
4,5,12,13-Тетракис(диметиламино)-16-метил-15,16-дигидродинафто[1,2-b:1',2'-f][1,5]диазоцин-8(7H)-карбальдегид. Спектр ЯМР 1Н (600 МГц, CDCl3, d, м. д., отн. инт. инт-ти, J/Гц): 2,35—2,54 (м, 6,9 H), 2,65—2,94 (м, 69,1 H), 3,03 (с, 3,6 H), 4,03—4,19 (м, 3,4 H), 4,64 (д, J = 13,5, 1,1 H), 5,17 (д, J = 13,7, 1,6 H), 5.51 (д, J = 14,9, 1,0 H), 6,49 (с,1,1 H), 6,60 (с,1,1 H), 6,82—6,88 (м, 2,4 H), 6,89—6,99 (м, 5,8 H), 7,28—7,47 (м, 10,3 H), 7,63—7,72 (м, 2,8 H). Спектр ЯМР 13C (150 Гц, CDCl3, d, м. д., J/Гц): 38,8, 42,5, 43,1 (уш. с.), 45,0 (уш. с.), 45,6 (уш. с.), 50,1, 52,9, 55,8, 58,9, 60,0, 111,8, 111,9, 112,0, 112,1, 112,3, 113,0, 113,9, 115,0, 115,4, 116,9, 117,2, 117,4, 119,3, 119,4, 120,7, 120,9, 124,9, 125,1, 125,5, 125,8, 126,2, 126,4, 126,6, 126,9, 127,2, 130,2, 131,6, 134,1, 134,6, 135,6, 136,4, 136,8, 137,1, 137,3, 138,2, 143,2, 147,8, 148,0, 150,5, 150,6, 150,7, 150,8, 151,0, 164,3, 164,4. Масс-спектр, m/z (Iотн (%)): 594 [M]+ (35), 594 (5), 451 (16), 436 (6), 262 (15), 238 (13), 209 (20), 195 (15), 182 (14), 168 (8), 58 (100), 44 (21).
Список литературы:
1.Озерянский В.А. Синтез 1,4,5–трис(диметиламино)нафталина и других 4–аминопроизводных «протонной губки» / В.А. Озерянский, А.Ф. Пожарский // Изв. АН Сер. хим. — 1997. — С. 1501—1504.
2.Goswami S. Troger's Base Molecular Scaffolds in Dicarboxylic Acid Recognition // Journal of Organic Chemistry. — 2000. Vol. 65. № 7. — P. 1907—1914.
3.Li Z. An Unusual Synthesis of Tröger’s Bases Using DMSO/HCl as Formaldehyde Equivalent // Synthesis. — 2005. № 8 — P. 1228—1230.
4.Masa T. A shorter synthesis of symmetrical 2,11-dimethyl-bis-Tröger's bases. A new molecular tweezer // Arkivoc. — 2004. — P. 86—93.
5.Pardo C. New Chiral Molecular Tweezers with a Bis-Tröger's Base Skeleton // Journal of Organic Chemistry. — 2001. Vol. 66. № 5. — P. 1607—1611.
6.Sergeyev S. Enantioseparations of non-benzenoid and oligo-Tröger’s bases by HPLC on Whelk O1 column // Tetrahedron: Asymmetry. — 2009. Vol. 20. — P. 1918—1923.
7.Spielman M.A. The Structure of Troeger's Base // Journal of the American Chemical Society. — 1935. Vol. 57. № 3. — P. 583—585.
8.Tröger J. Ueber einige mittelst nascirenden Formaldehydes entstehende Basen // Journal für Praktische Chemie. — 1887. Vol. 36. № 1. — P. 225—245.
дипломов


Оставить комментарий