Статья опубликована в рамках: IV Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 01 апреля 2013 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
КОМПЛЕКСООБРАЗОВАНИЕ ПЕРЕХОДНЫХ 3D-МЕТАЛЛОВ С ПРОИЗВОДНЫМИ 1-ФЕНИЛ-3-МЕТИЛ-4-АЗОПИРАЗОЛОНА-5
Шебалдина Лидия Сергеевна
канд. хим. наук, доцент Российский Университет Дружбы Народов, г. Москва
E-mail: lidiyas.7@mail.ru
Ван Нгуен
аспирант кафедры общей химии, Российский Университет Дружбы Народов.
Ковальчукова Ольга Владимировна
профессор кафедры общей химии, д-р хим. наук Российский Университет Дружбы Народов
Производные 1-фенил-3-метил-4-азопиразо-лона-5 (П-5) и металлокомплексы на их основе находят применение в различных областях, например, в качестве красителей для текстильных материалов, в аналитической химии, в качестве медицинских препаратов и др. [2]. Успех пиразолоновых красителей обусловлен простотой реакции азосочетания, большими возможностями для структурных изменений, а также довольно высоким для большинства красителей коэффициентом молярной экстинкции.
Введение в состав азопиразолонового красителя катионов металлов может привести к изменению их цветовой гаммы и возникновению дополнительных свойств. Например, введение катионов меди и серебра может придать окрашенным тканям антибактериальные и фунгицидные свойства, что будет полезным при их использовании в медицине и при реставрационных работах.
Изучение процессов комплексообразования лигандов HL1—H2L3 катионами металлов в растворах проводили методом спектрофото-метрического титрования. Как видно из примера, приведенного на рис. 1, в процессе спектрофотометрического титрования растворов лигандов растворами солей металлов в электронном спектре поглощения наблюдается гипсохромный сдвиг длинноволновой полосы (как и при титровании щелочью), что указывает на аналогию процессов депротонирования и комплексообразования. Это означает, что в процессе комплексообразования происходит замена подвижного атома водорода органической молекулы на катион металла. Показано, что для комплексов с катионами Co2+ и Ni2+ соотношение металл: лиганд составляет 1:1, то для Сu2+ 1:2.
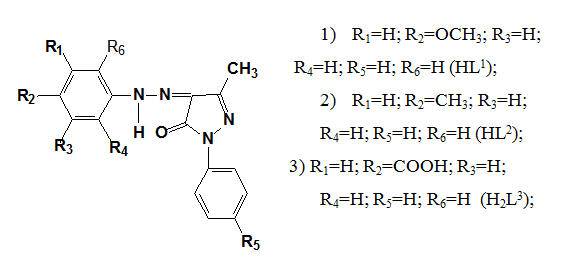
Если считать положение длинноволновой полосы в спектре некоординированного лиганда за 100 %-ную ковалентную связь, а положение этой же полосы в щелочном растворе (натриевая соль) за 100 %-ную ионную связь, то полосы при титровании солями металлов будут занимать промежуточное положение, то есть обладать определенной степенью ковалентности. Рассчитанные степени ковалентности связей металл-лиганд для комплексов HL1—H2L3 приведены в таблице 1.

Рисунок 1. Спектрофотометрическое титрование этанольного раствора HL2 раствором NiCl2
По результатам каждого спектрофото-метрического титрования для трех длин волн построены кривые насыщения, по которым определены состав комплексов в растворе и константы образования комплексов (Таблица 1).
Таблица 1.
Состав и константы образования комплексных соединений металлов в этанольных растворах и степени ковалентности связей металл-лиганд
|
Система |
λ, нм(lgε) |
lgβ (pKa) |
А, % |
|
HL1 |
418(4,63); 253,3(4,61) |
|
|
|
(HL1+Co2+) |
410(4,25); 346(3,93); 250(4,30) |
6,405 |
65 |
|
(HL1+Ni2+) |
407(4,18); 343(3,93); 247(4,25) |
7,073 |
52 |
|
(HL1+Cu2+) |
397(4,21); 248(4,32) |
20,049 |
9 |
|
HL2 |
403(4,41); 244(4,35) |
|
|
|
(HL2+Co2+) |
399(4,32); 333(3,94); 254(4,34) |
7,157 |
76 |
|
(HL2+Ni2+) |
397(4,24); 337(3,99); 252,1(4,3) |
6,743 |
65 |
|
(HL2+Cu2+) |
391(4,29); 252(4,36) |
17,384 |
29 |
|
(HL2+Ag+) |
401(4,31); 218(4,2) |
14,615 |
88 |
|
H2L3 |
401(4,1); 244(4,12) |
|
|
|
(H2L3+Co2+) |
392(3,93); 340(3,92) 249(3,94) |
6,82 |
|
|
(H2L3+Ni2+) |
425(3,92); 315(3,65); 249(4,01) |
6,767 |
|
|
(H2L3+Cu2+) |
392(4,64); 250(4,56) |
19,15 |
|
|
(H2L3+Ag+) |
399(3,9); 247(3,94) |
15,741 |
|
Как видно из анализа значений констант устойчивости металлокомплексов, в случае образования комплексных соединений катионов первого переходного ряда: Co(II), Ni(II), Cu(II) — максимальная устойчивость характерна для комплексов меди. были обнаружены линейные зависимости величин констант образования комплексов от значений ионного потенциала и энергии сродства к электрону ионов-комплексообразователей (рис. 2, 3).
Согласно существующим представлениям, процессы комплексообразования можно описывать с позиции теории жестких и мягких кислот и оснований [1].
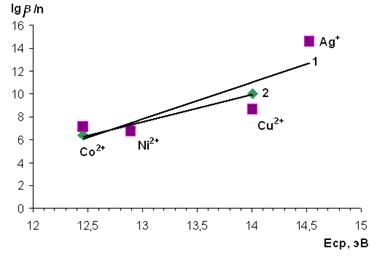
Рисунок 2. Зависимость величины lgβ/n от величины среднего потенциала ионизации металла-комплексообразователя: 1 — для HL2, 2 — для HL1
Использованные в работе двухвалентные ионы (Co2+, Ni2+, Cu2+ ) относятся к промежуточным по жесткости, а катион Ag+ — к мягким кислотам Льюиса. В связи с тем, что рассчитанные степени ковалентности связей образующихся в растворах комплексов имеют большую степень ковалентности, можно предположить, что изучаемые производные 1-фенил-3-метил-4-азопиразолона-5 имеют свойства мягких оснований Льюиса и основной вклад в комплексообразование вносят более «мягкие» атомы азота азогруппы.
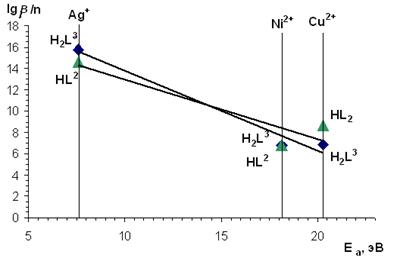
Рисунок 3. Зависимость величины lgβ/n от величины энергии сродства к электрону ионов-комплексообразователей
Увеличение константы кислотной диссоциации органических молекул приводит к линейному увеличению констант образования их металлокомплексов (рис. 4), что не противоречит предложенной в работе [3] закономерности.
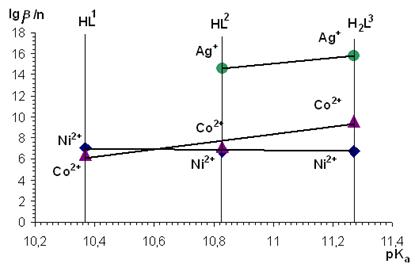
Рисунок 4. Зависимость величны lgβ/n от величины константы кислотной диссоциации лиганда
Таким образом, в процессе работы нами изучено комплексообразование трех лигандов в этанольных растворах, установлен состав и рассчитаны константы образования комплексных соединений и степени ковалентности их координационных связей. Построены корреляционные зависимости устойчивости комплексов от физических характеристик ионов-комплексообразователей.
Список литературы:
1.Гарновский А.Д., Садименко А.П., Осипов О.А., Цинцадзе Г.В. Жестко-мягкие взаимодействия в координационной химии. — Ростов-н/Д.: Изд-во Рост. Ун-та, 1986. — 272 с.
2.Степанов Б.И. Введение в химию и технологию красителей. — М.: Химия, 1984. — 590 с.
3.Brown P.L., Sylva R.N. Unified theory of metal ion complex formation constants. // J. Chem. Res. Miniprint. — 1987. — P. 10110—10181.
дипломов


Оставить комментарий