Статья опубликована в рамках: II Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 04 февраля 2013 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗОВАНИЯ В СУЛЬФАТНЫХ РАСТВОРАХ, СОДЕРЖАЩИХ ХРОМ, ТИТАН И АЛЮМИНИЙ
Трошина Марина Александровна
канд. техн. наук, доцент ТГУ,
г. Тольятти
Одним из возможных путей удовлетворения растущей потребности населения в высококачественных изделиях из кожи, повышения качества и ассортимента продукции кожевенной промышленности является внедрение в технологические процессы новых химических материалов, которые бы позволили интенсифицировать производство, улучшить эксплуатационные свойства кож, расширить их ассортимент. Поэтому в последнее время все больше внимания уделяется процессу дубления, и, следовательно, разработке новых дубящих веществ на основе соединений хрома (III), титана (IV), алюминия (III), циркония (IV) и железа (III).
Работы, выполненные в этом направлении, показали перспективность применения гетерополиядерных дубителей в производстве кож, особенно титансодержащих, так как при этом значительно увеличивается устойчивость и эффективность дубящих соединений титана.
Однако их широкое внедрение в практику осложнено недостаточными исследованиями в области комплексообразования, что не позволяет определить условия стабильного поведения комплексных соединений при дублении кож. Следствием этого является использование кожевенными заводами традиционных хромовых солей, когда применение наиболее дешевых и экологически более чистых комплексных дубителей позволит решить как экологические проблемы, так и снизить себестоимость дубителя.
Исходя из вышесказанного, в данной работе с применением методов спектрофотометрии и изотермической растворимости изучены условия образования сульфатных титансодержащих гетерополиядерных комплексных соединений, образующихся в водных растворах.
Исследование комплексообразования в сульфатных растворах, содержащих ионы хрома, титанила и алюминия, при совместном присутствии как двух, так и трех металлов проводили с использованием спектрофотометрии. Для установления числа и природы частиц в растворе применили метод Остромысленского-Жоба (или изомолярных отношений) и расчетный метод определения числа частиц в растворе, основанный на поиске ранга матрицы.
Использование метода изомолярных отношений дает возможность определить изомолярные концентрации реагирующих веществ, отвечающие максимальному выходу образующегося комплексного соединения. Кривая зависимости выхода комплекса от состава раствора характеризуется экстремальной точкой, которая и отвечает максимально возможной концентрации гетерополиядерного соединения [3].
Для выполнения анализа готовили растворы сульфатов хрома, титанила, и алюминия одинаковой молярной концентрации, равной 0,05 М, и смешивали их по два компонента в антибатных соотношениях от 1:9 до 9:1, сохраняя неизменным общий объем раствора. При этом суммарное количество молей обоих составляющих в общем объеме смеси всегда остается постоянным.
Измерение коэффициента светопоглощения проводили с помощью спектрального вычислительного комплекса КСВУ-23 через час после приготовления растворов в кварцевых кюветах толщиной 1 см. Спектры поглощения фиксировали в ультрафиолетовой области (в интервале длин волн 200—400 нм). Исключение составили растворы, содержащие ионы титана и алюминия, ввиду их сильного поглощения, поэтому диапазон длин волн для них был смещен в видимую область (300—700 нм). Ионная сила исследуемых растворов изомолярных серий поддерживалась равной 0,01, а постоянство рН регулировали индифферентным электролитом (сульфат натрия).
По полученным электронным спектрам поглощения растворов, приготовленных по методу изомолярных отношений, были сняты характеристики коэффициента светопоглощения от длины волны и построены зависимости Жоба при четырех длинах волн. Анализ изомолярных кривых указывает на образование в растворах, содержащих катионы двух металлов, нескольких поглощающих комплексных частиц. Наличие более одного максимума, возможно, свидетельствует о протекании в растворах процессов ассоциации ионов, гидролиза, полимеризации, что, по-видимому, и усложняет вид кривых. Так, в растворах сульфатов хрома и алюминия, по аналогии с автором работы [2], были обнаружены следующие комплексные хромалюминиевые соединения: Cr:Al = 1:1; 3:1; 1:4. Для хромтитановых, и алюмотитановых растворов по зависимостям Жоба определили наличие комплексов состава Cr:Ti = 1:4; 1:2; 2:1, Ti:Al = 1:1; 1:2; 1:4 соответственно.
Полученные результаты хорошо согласуются с проведенными ранее исследованиями по изучению тройных систем в твердом состоянии [5, с. 7]. Однако в растворах образуется большее количество гетерополиядерных комплексных соединений, чем их можно синтезировать в твердом виде.
Сложный ход изомолярных кривых не дает возможности с уверенностью говорить об образовании комплексных соединений именно в том количестве, которое было нами обнаружено графически. В растворах могут присутствовать комплексы и других составов. Более надежным следует считать число частиц, определенное анализом ранга матрицы светопоглощения. В этом случае матрица преобразуется с помощью ряда элементарных операций до эквивалентной преобразованной матрицы, в которой самые большие элементы находятся на главной диагонали, а все элементы ниже ее равны нулю. По этой же схеме преобразовывается и матрица ошибок, которая составлена из величин ожидаемых ошибок. Для спектрофотометра КСВУ-23 величина ожидаемой ошибки принята равной 0,025 единиц светопоглощения. После проведенных преобразований сравнивают элементы главных диагоналей матрицы светопоглощения и матрицы ошибок. При этом используется критерий, который заключается в том, что элемент матрицы светопоглощения можно считать отличным от нуля, если он в три раза больше, чем соответствующий элемент матрицы ошибок. Количество таких элементов и дает искомое число поглощающих частиц. Для проведения такого расчета была использована программа для ЭВМ TRIANG, которая приведена в [9].
В хромалюминиевых, хромтитановых и титаналюминиевых растворах расчетным методом определения ранга матрицы обнаружили следующие количества поглощающих комплексных соединений: 5, 5, 3 и 3 соответственно. Как видно из полученных результатов, количество образующихся комплексных частиц в растворах, найденное расчетным путем, несколько выше и только в системе «сульфат титанила — сульфат алюминия — вода» подтвердился результат, полученный графически. Подобное расхождение, вероятно, объясняется протеканием побочных процессов, многоядерностью образующихся соединений, а также взаимовлиянием комплексов друг на друга. Однако более верными следует считать расчетные данные [9].
Изучение комплексообразования между хромом, титаном и алюминием в водных растворах спектрофотометрическим методом проводили путем смешивания в антибатных соотношениях растворов хромтитанового комплекса, взятого в соотношении Cr:Ti = 1:2 и сульфата алюминия при концентрации каждого компонента 0,05 моль/л. и ионной силе растворов 0,01. Светопоглощение хромтитаналюминиевых растворов в зависимости от длины волны и соотношения компонентов и изомолярные кривые представлены в таблице 1 и на рисунке 1 соответственно. Анализ зависимостей Жоба указывает на образование в исследуемой системе гетерополиядерных комплексных соединений, предположительно следующего состава: Cr:Ti:Al = 2:4:1, 1:2:1, 1:2:2 и 1:2:4. Число поглощающих частиц, найденное определением ранга матрицы, равно 6 (табл. 2).
Склонность к полимеризации титана, ассоциация комплексов ведут к несоответствию между результатами, полученными графическим и расчетным методами, как для тройных, так и четверных систем, что не дает с полной уверенностью говорить о существовании в растворах комплексных частиц определенного состава и в определенном количестве. Поэтому исследование комплексообразования между сульфатами хрома, титанила и алюминия было продолжено с использованием метода изотермической растворимости, дающего более наглядное представление о процессе комплексообразования в насыщенных растворах дубителей.
Таблица 1.
Данные по светопоглощению для изомолярной серии хромтитаналюминиевых растворов
|
№ |
Мольная доля |
Коэффициент светопоглощения при длине волны, нм |
|||||||||
|
п/п |
ХТК |
Al2(SO4)3 |
200 |
225 |
250 |
275 |
300 |
325 |
350 |
375 |
400 |
|
1. |
0,1 |
0,9 |
6,807 |
8,723 |
9,981 |
10,14 |
4,803 |
1,278 |
0,610 |
0,307 |
0,264 |
|
2. |
0,2 |
0,8 |
7,536 |
8,843 |
10,54 |
10,21 |
5,255 |
1,496 |
0,691 |
0,384 |
0,377 |
|
3. |
0,3 |
0,7 |
7,412 |
9,586 |
10,31 |
10,50 |
6,854 |
2,003 |
0,762 |
0,281 |
0,273 |
|
4. |
0,4 |
0,6 |
5,707 |
7,643 |
8,758 |
8,906 |
6,337 |
2,328 |
0,976 |
0,484 |
0,480 |
|
5. |
0,5 |
0,5 |
5,811 |
7,738 |
8,849 |
9,814 |
7,186 |
2,745 |
1,149 |
0,472 |
0,464 |
|
6. |
0,6 |
0,4 |
5,904 |
7,829 |
8,835 |
9,006 |
7,925 |
1,967 |
1,198 |
0,502 |
0,581 |
|
7. |
0,7 |
0,3 |
5,873 |
7,903 |
8,942 |
9,087 |
8,478 |
2,392 |
1,427 |
0,414 |
0,492 |
|
8. |
0,8 |
0,2 |
6,017 |
7,900 |
9,019 |
9,174 |
8,279 |
3,304 |
1,434 |
0,597 |
0,450 |
|
9. |
0,9 |
0,1 |
6,284 |
8,093 |
9,186 |
9,385 |
8,923 |
3,857 |
1,708 |
0,714 |
0,569 |
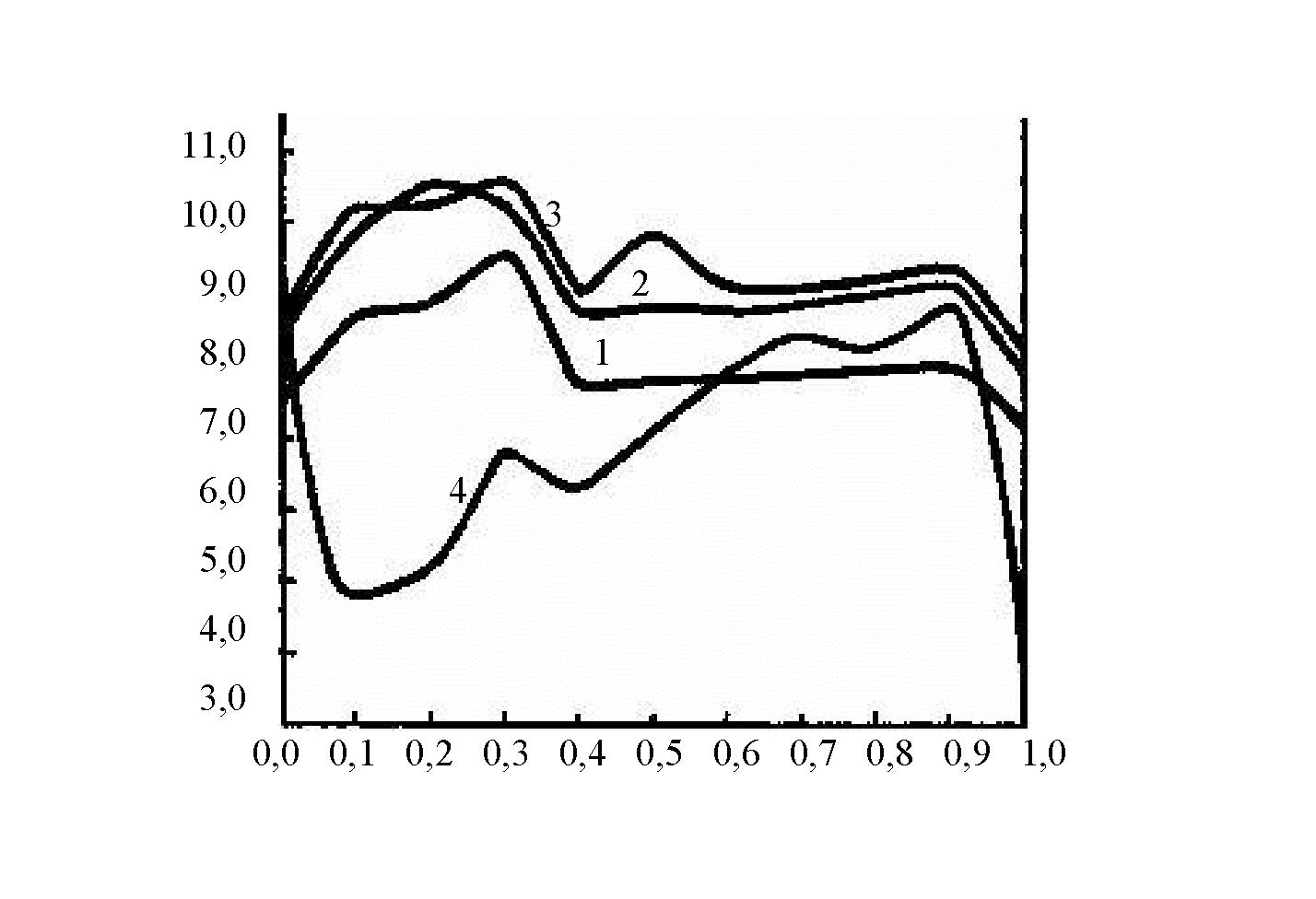
Рисунок 1. Зависимость Жоба для четверной системы Cr2(SO4)3 — TiOSO4 — Al2(SO4)3 — H2O: ось абсцисс — мольная доля сульфата алюминия; ось ординат — коэффициент светопоглощения. Обозначение кривых: 225 нм (1); 250 нм (2); 275 нм (3); 300 нм (4)
Таблица 2.
Элементы главных диагоналей преобразованных матрицсветопоглощения и ошибок для хромтитаналюминиевых комплексов
|
№ п/п |
Название матрицы |
|
||||||||
|
1. |
Светопог-лощения |
10,54 |
-0,331 |
0,982 |
-0,199 |
12,35 |
-1,120 |
0,108 |
0,198 |
0,417 |
|
2. |
Ошибок |
0,025 |
0,043 |
0,048 |
0,044 |
0,041 |
0,034 |
0,034 |
0,033 |
0,034 |
Метод изотермической растворимости широко используется для установления состава, области кристаллизации образующихся комплексов, если происходит комплексообразование в насыщенных растворах между компонентами [8], или по полученным диаграммам можно судить об отсутствии какого-нибудь химического взаимодействия.
Исследование растворимости в четверной системе Cr2(SO4)3 — TiOSO4 — Al2(SO4)3 — H2O проводили методом нонвариантных точек. К насыщенным эвтоническим и перитоническим растворам исходных тройных систем добавляли третью соль до появления новой твердой фазы. Смеси термостатировались при температуре 25оС, которую регулировали в термостате U 15 С, с точностью до ± 0,1оС.
Для определения составов насыщенных растворов, состоящих из трех компонентов и растворителя, использовали метод сечений Мерцлина [6], по которому определяют зависимость какого-либо физического свойства от концентрации третьей соли при постоянной температуре и строят графики «состав-свойство». Состав насыщенных растворов находили по точкам излома функциональных кривых. За измеряемое физическое свойство был выбран показатель преломления, определяемый на рефрактометре УРЛ. Равновесие между твердой и жидкой фазами устанавливалось через 7—10 суток, о чем свидетельствовало постоянство показателя преломления.
Для построения диаграмм растворимости выбрали простой и удобный в применении метод Енеке-Буке или способ трехгранной призмы. По этому методу количество растворителя (воды) относят к постоянному количеству суммы трех солей, взятому за 100 %. Состав солей показывают на основании трехгранной призмы (плоскость равностороннего треугольника), а водный угол удален в бесконечность, перпендикулярно основанию [4].
Центральную проекцию получили при помощи лучей, проведенных из вершин воды пространственных диаграмм на плоскость равносторонних треугольников.
Температура исследования была выбрана равной 25оС из тех соображений, что при увеличении ее повышается взаиморастворимость сульфатов хрома, титанила и алюминия, а также происходит ускорение гидролиза соединений титана, в результате чего может произойти переход их в осадок до вступления в процесс гетерополиядерного комплексообразования. Снижение температуры значительно увеличивает продолжительность эксперимента ввиду медленности установления равновесия между твердой и жидкой фазами из-за понижения растворимости исходных компонентов.
В качестве исходных данных для исследования системы «сульфат хрома — сульфат титанила — сульфат алюминия — вода» были выбраны области кристаллизации хромалюминиевого (ХАК), хромтитанового (ХТК) и алюмотитанового (АТК) гетерополиядерных комплексов, а в качестве исходных компонентов использовали кристаллогидраты сульфатов хрома, титанила и алюминия.
Полученные данные по растворимости четверной системы Cr2(SO4)3 — TiOSO4 — Al2(SO4)3 — H2O представлены на рисунке 2. Точки е1-е6 являются проекциями эвтонических точек тройных систем, точки Е1-Е6 — проекциями тройных эвтоник, а точки 1—11 — проекциями тройных переходных точек. Пограничные линии е1Е1 и е2Е2, исходящие со стороны Al2(SO4)3 — TiOSO4 являются геометрическим местом эвтонических точек тройной системы «сульфат хрома — сульфат титанила — вода», а линии е3Е3, е4Е4 и е5Е5, е6Е6 — геометрическим местом эвтоник систем «сульфат хрома — сульфат алюминия — вода» и «сульфат хрома — сульфат титанила — вода» соответственно. Пограничная линия Е1Е2Е3Е4Е5Е6, проходящая также через точки 1—11, есть искомая проекция поверхности кристаллизации тройных хромтитаналюминиевых соединений [1].
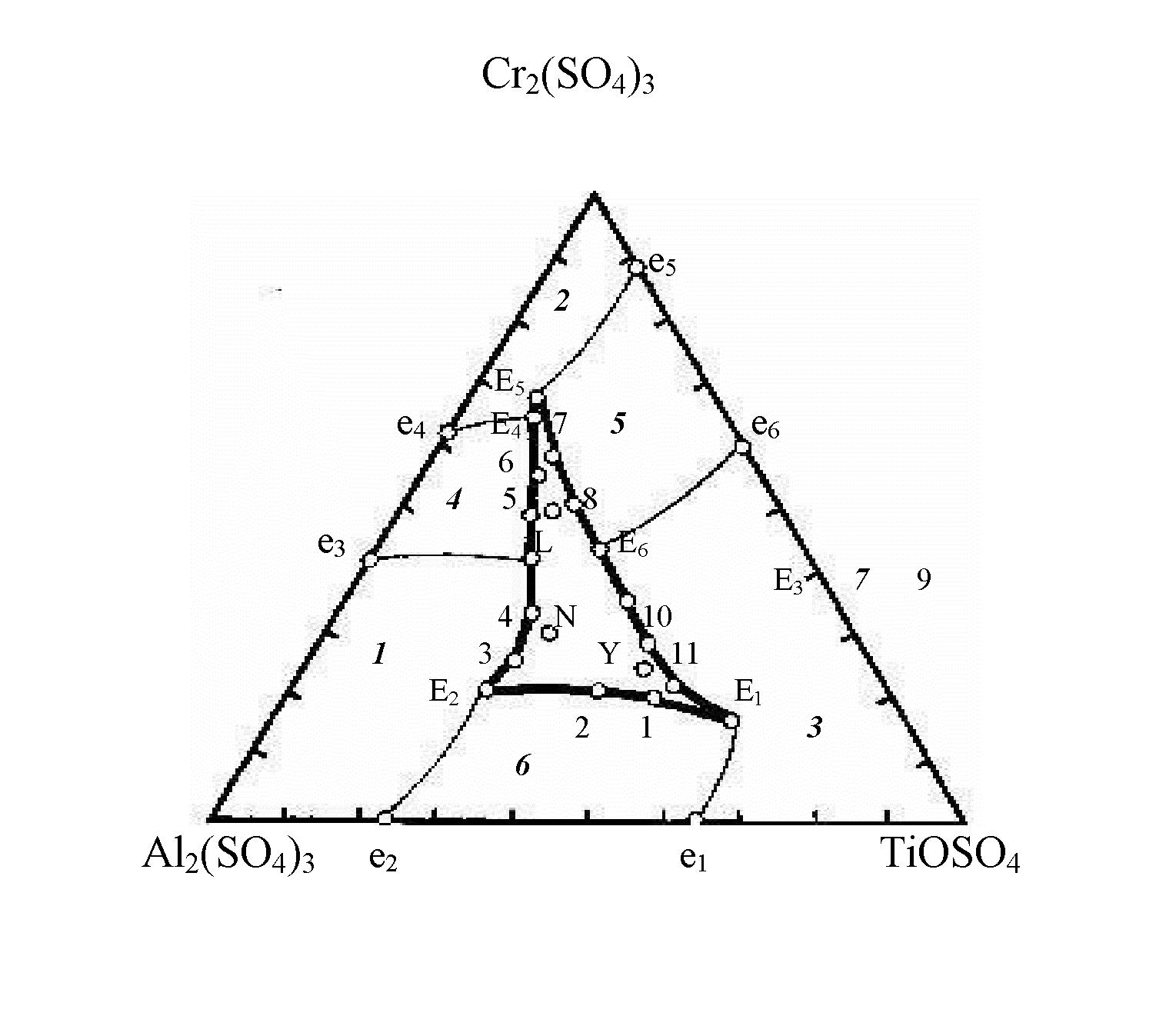
Рисунок 2. Центральная проекция диаграммы растворимости четверной системы Cr2(SO4)3 — TiOSO4 — Al2(SO4)3 — H2O при 25оС
Таким образом, поверхность растворимости исследуемой четверной системы Cr2(SO4)3 — TiOSO4 — Al2(SO4)3 — H2O состоит из 7 полей. Полям кристаллизации исходных солей сульфата алюминия, сульфата хрома и сульфата титанила соответствуют поля 1, 2, 3 соответственно. Поле 4 характеризуется равновесием в гетерогенной системе, состоящей из кристаллов хромалюминиевого комплекса и насыщенного раствора, а поля 5 и 6 — равновесием в системах между насыщенными растворами и кристаллами хромтитанового и алюмотитанового комплексов соответственно. Областью кристаллизации тройных гетерополиядерных комплексных соединений, содержащих хром, титан и алюминий, является поле 7.
Предполагаемые валовые составы хромтитаналюминиевых комплексных соединений, рассчитанные по диаграммам растворимости и соответствующие точкам L, N, Y (рис. 2), следующие:
ХТАК-1 (точка L) - 1,5Cr2(SO4)3×1,5TiOSO4×Al2(SO4)3×40H2O;
ХТАК-2 (точка N) - Cr2(SO4)3×2,5TiOSO4×1,5Al2(SO4)3×45H2O;
ХТАК-3 (точка Y) - Cr2(SO4)3×4TiOSO4×1,5Al2(SO4)3×47H2O.
Сложные валовые составы хромтитаналюминиевых комплексных гетерополиядерных соединений и изменчивость их от соотношения хрома, титана и алюминия в растворе указывают на то, что в химическое взаимодействие между собой вступают полиядерные комплексы этих металлов.
Список литературы:
1. Аносов В.Я., Озерова М.И., Фиалков Ю.Я. Основы физико-химического анализа. — М.: Наука, 1976. — 334 с.
2. Бимурзаева З.Е. Синтез, исследование физико-химических свойств и дубящего действия алюмохромциркониевых и железохромциркониевых комплексов: Дис. канд. техн. наук. — Тараз, 1999. — 131 с.
3. Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. — Л.: Химия, 1968. — 384 с.
4. Викторов М.М. Графические расчеты в технологии неорганических веществ. — Л.: Химия, 1972. — 462 с.
5. Жарлыкапова Р.Б. Синтез, исследование строения и дубящего действия гетерополиядерных комплексов, используемых в кожевенной промышленности: Дис. канд. техн. наук. — М., 1991. — 129 с.
6. Никурашина Л.И., Мерцлин Р.В. Метод сечений. Приложение его к изучению многофазного состояния многокомпонентных систем. — Саратов: Саратовский Гос. Ун-т. 1969. — С. 3—28.
7. Сахы М. Научные основы малоотходных технологий получения и применения, экологически безвредных полиядерных комплексных соединений: Дис. докт. техн. наук. — Тараз, 1999. — 288 с.
8. Турарова Н.Я. О возможности определения состава комплекса по диаграмме состояния гетерогенной системы типа АХ — ВХ — растворитель. // Координационная химия. — 1984. — № 3. — С. 1165—1173.
9. Хартли Ф., Бергес К., Олкок Р. Равновесия в растворах. — М.: Мир, 1983. — 360 с.
дипломов


Оставить комментарий