Статья опубликована в рамках: II Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 04 февраля 2013 г.)
Наука: Биология
Секция: Физиология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИССЛЕДОВАНИЕ СТРУКТУРНО-ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ЭРИТРОЦИТОВ КРЫС ПРИ ИНГАЛЯЦИИ ПРЕПАРАТА «АПИНГАЛИН» НА ФОНЕ АДРЕНАЛОВОГО ОТЕКА ЛЕГКИХ
Копылова Светлана Вячеславовна
доцент, канд. биол. наук, доцент ННГУ,
г. Нижний Новгород
Старателева Юлия Андреевна
канд. биол. наук, ассистент ННГУ,
г. Нижний Новгород
E-mail: sua13@mail.ru
Исследовано изменение структурно-функционального состояния мембран эритроцитов крыс при ингаляционном введении препарата «Апиналин» в условиях адреналового отека легких. Показано, что развитие у крыс отека легких привело к дестабилизации фосфолипидного компонента эритроцитарной мембраны и снижению электрофоретической подвижности клеток. Курсовая ингаляция препаратом «Апиналин» способствовала нормализации соотношений фосфолипидных фракций мембран: снижению уровня лизофосфатидилхолина, повышению количества сфингомиелина, фосфатидилхолина и фосфатидилэтаноламина, что было сопряжено с повышением электрофоретической подвижности эритроцитов.
Введение
В последнее время все большее значение приобретает необходимость использования природных соединений с целью оптимизации лечения при ряде патологий, в том числе заболеваний дыхательной системы. Особое место среди таких соединений занимают продукты пчеловодства. Установлено, что они оказывают широкий спектр действия на организм, обладая противомикробным, противовоспалительным, биостимулирующим, анестезирующим действием [3]. По-видимому, особенно эффективным является использование апипродуктов в виде различных комплексов, поскольку они способны оказывать более выраженное лечебное действие на организм. Одним из таких комплексов является препарат «Апингалин», приготовленный на основе пчелиного прополиса и маточного молочка.
С другой стороны, известно, что в патогенезе ряда заболеваний особое место занимают нарушения структурно-функциональных характеристик мембран клеток, в частности эритроцитов, во многом определяющих протекание физиологических и биохимических процессов во всем организме. В связи с этим, анализ изменения электрофоретической подвижности (ЭФП) и фосфолипидного спектра эритроцитов может иметь важное значение при решении проблем возникновения и терапии различных заболеваний. Исходя из вышеизложенного, целью работы явилось: исследование изменения структурно-функционального состояния эритроцитов крыс при ингаляции препарата «Апингалин» на фоне моделирования адреналового отека легких.
Экспериментальная часть.
Исследования проводились на белых крысах, самках, весом 150—180 грамм. Животные были разделены на группы. К первой — интактной — группе относились здоровые животные. Крысам второй — контрольной — группы моделировали адреналовый отек легких (ОЛ). Для этого им внутрибрюшинно вводили адреналин в дозе 0.5 мг/кг [6]. Третью — опытную — группу составили животные с отеком легких, которых в течение 10 дней по 10 минут ингалировали препаратом «Апингалин», представляющим собой водноспиртовую суспензию пчелиного маточного молочка и прополиса.
ЭФП эритроцитов исследовали методом микроэлектрофореза. Липидный спектр эритроцитов определяли с помощью метода одномерной тонкослойной хроматографии. Фракционирование (разгонку) осуществляли в системе хлороформ — метанол — вода (65:25:4). Хроматограммы сканировали на сканере Epson stylus CX4700, результаты обрабатывали с помощью программы «Onedscan» для Windows 98. Расчеты фракций ФЛ производили в % относительно общего содержания фосфолипидов. Применение данного метода позволило выявить 4 фракции фосфолипидов: лихофосфатидилхолин (ЛФХ), сфингомиелин (СМ), фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭА).
Результаты и их обсуждение.
В ходе эксперимента было установлено, что развитие у крыс ОЛ повлекло за собой изменения функционального состояния мембран эритроцитов: произошло снижение ЭФП эритроцитов на 15 % относительно интактной группы животных (рис. 1).
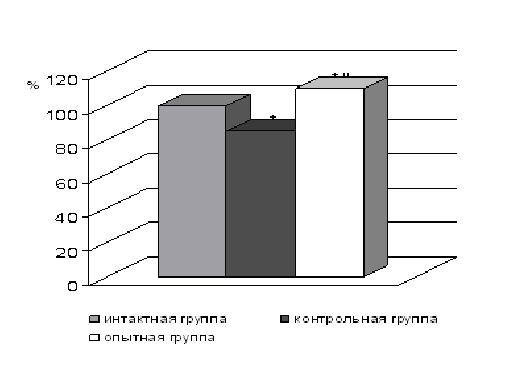
Рисунок 1. Изменение ЭФП эритроцитов крыс при ингаляционном введении препарата «Апингалин» на фоне отека легких
* — достоверность различия показателей по отношению к интактной группе животных (р<0,05);
˝ — достоверность различия показателей по отношению к контрольной группе животных (р<0,05).
Анализ липидного спектра эритроцитов показал наличие существенных изменений фосфолипидного компонента мембран. Произошло значительное увеличение количества ЛФХ — в 4 раза по сравнению с интактной группой (р<0,05) (рис. 2).
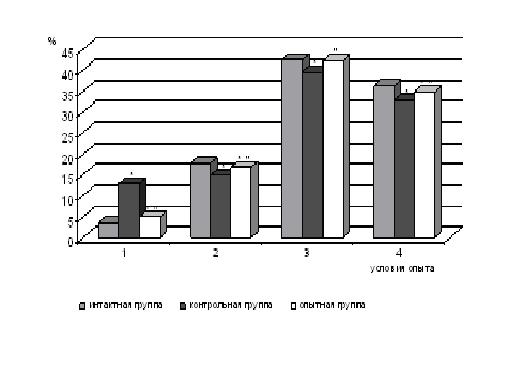
Рисунок 2. Изменение фосфолипидного спектра мембран эритроцитов крыс при ингаляции препарата «Апингалин» на фосфолипидный спектр в условиях отека легких: 1 — ЛФХ; 2 — СМ; 3 — ФХ; 4 — ФЭА
* — достоверность различия показателей по отношению к интактной группе животных (р<0,05);
˝ — достоверность различия показателей по отношению к контрольной группе животных (р<0,05)
При этом были выявлены однонаправленные изменения фракций ФХ, СМ и ФЭА сторону их уменьшения на 6,6 %, 17,6 % и 9,6 % соответственно, относительно группы «интактные животные» (р<0,05) (рис. 2).
Результаты исследования ФЛ эритроцитов позволили вычислить коэффициент ФХ2/СМ∙ЛФХ, характеризующий проницаемость мембран. Было выявлено его снижение в контрольной группе в 3,5 раза относительно интактных животных.
Обсуждая данные, касающиеся изменения ЭФП эритроцитов, следует отметить, что феномен движения клеток крови в электрическом поле связан, прежде всего, с величиной поверхностного заряда клеток, который во многом определяет их функциональное состояние. Вероятно, нарушение функциональной активности эритроцитов при отеке легких обусловлено снижением электроотрицательности клеток, что, в свою очередь, может быть связано со структурными изменениями эритроцитов, а именно — модификацией фосфолипидного спектра мембран, о чем свидетельствуют полученные результаты. Так, было выявлено значительное нарушение соотношений между мембранодеструктивными и мембраностабилизирующими фракциями в сторону снижения последних и значительного увеличения уровня ЛФХ — наиболее цитотоксичной фракции. Возможно, ее высокое содержание является следствием избыточной активности фосфолипазных реакций, характерных для воспалительного процесса, и приводящих к накоплению лизоформ ФЛ, характеризующихся высокими детергентными свойствами [1].
Наличие мембранодеструктивных процессов подтверждает и уменьшение фракции ФХ, являющегося стабилизатором фосфолипидного бислоя эритроцитарных мембран, а так же снижение количества СМ и ФЭА. Как известно, СМ находится преимущественно в поверхностном слое плазматической мембраны, а ФЭА — во внутреннем, следовательно, в эритроцитарных мембранах происходят структурные нарушения на протяжении всего липидного бислоя. Кроме того, известно, что ФЭА принадлежит к легкоокисляемым фракциям и является основным субстратом перекисного окисления липидов (ПОЛ), в связи с этим, можно предположить, что уменьшение содержания данной фракции обусловлено интенсификацией ПОЛ при ОЛ. Повышенная активность ПОЛ влечет за собой повышение проницаемости мембран, утечку из клеток ионов калия и снижение ЭФП, что подтверждается полученными данными [2, с. 4].
Выявленное снижение коэффициента ФХ2/СМ∙ЛФХ по сравнению с нормой так же указывает на повышение проницаемости мембран, и подтверждает данные об усилении активности фосфолипаз и накоплении лизопроизводных ФЛ [6].
Таким образом, развитие у крыс отека легких привело к дестабилизации фосфолипидного компонента эритроцитов, что повлекло за собой снижение суммарного заряда клеток и, как следствие, нарушение функциональной полноценности эритроцитарной мембраны.
Ингаляционная терапия животных препаратом на основе маточного молочка и прополиса «Апингалин» способствовала нормализации изучаемых параметров. Наблюдалось достоверное увеличение ЭФП эритроцитов на 25 % относительно контрольной группы животных (рис. 1). Была выявлена тенденция к восстановлению нормального соотношения между фракциями ФЛ эритроцитов. Обнаружено заметное снижение фракции ЛФХ — в 2,6 относительно контрольной группы (р<0,05) (рис. 2). Произошло повышение уровня ФЭА на 5,7 %, а так же увеличение количества СМ — почти на 12,2 % и ФХ — на 6,3 % по сравнению с контрольной группой животных (р<0,05) (рис. 2). Расчет интегрального коэффициента проницаемости ФХ2/СМ∙ЛФХ показал значительное увеличение его по сравнению с контрольной группой — в 2 раза.
По-видимому, нормализация структурного состояния эритроцитов обусловила повышение электрокинетического потенциала и, как результат, улучшение функциональных свойств эритроцитов, на что указывает повышение ЭФП клеток.
Вероятно, одним из механизмов восстановления соотношений липидного компонента после курсовой ингаляции «Апингалином» может быть торможение повышенного ПОЛ, которым сопровождалось развитие отека легких. Немаловажную роль при этом играют биофлавоноиды прополиса, которые, как известно, за счет своей структуры в той или иной степени обладают антиоксидантными свойствами и являются ловушкой для свободных радикалов.
Так, в опытной группе животных было отмечено значительное снижение фракции ЛФХ, обладающей мембранотоксическим и мембранолитическим действием. Мы считаем, что это связано с ингибированием эндогенных фосфолипаз антиоксидантами прополиса. В результате, по всей видимости, происходит торможение гидролитического окисления жирных кислот, приводящего к образованию деструктивной фракции ЛФХ и субстратов ПОЛ — ненасыщенных жирных кислот [1, с. 6].
Еще одной характеристикой мембраностабилизирующих процессов в эритроцитах можно считать повышение количества СМ и ФХ. Известно, что СМ входит в состав липопротеиновых комплексов Na-K-АТФазы, следовательно, повышение его количества отразится на активности АТФазы, и, следовательно, — на электрокинетических свойствах эритроцитарных мембран [4]. В частности, после курсовой ингаляции крыс препаратом «Апингалин» прослеживается тенденция к восстановлению нормальной проницаемости эритроцитов, на что указывает повышение коэффициента ФХ2/СМ∙ЛФХ по сравнению с контрольной группой. Очевидно, это привело к стабилизации эритроцитарных мембран и улучшению структурно-функциональных характеристик эритроцитов.
Исходя из полученных результатов, можно заключить, что курсовая ингаляция крыс препаратом «Апингалин» в условиях адреналового отека легких способствовала модификации структуры эритроцитарных мембран в сторону более оптимального состава фосфолипидного спектра, что является необходимым условием нормального функционирования клетки. По-видимому, это обусловило нормализацию физико-химических свойств эритроцитов и, следовательно, привело к восстановлению функциональной активности клеток, на что указывает повышение ЭФП.
Список литературы:
1. Евдокимова Е.В. Влияние Учумской грязи на структурно-функциональное состояние мембран эритроцитов в динамике лечения больных остеохондрозом позвоночника: Автореф. дис. канд. мед. наук. — Красноярск, 2005. — 25 с.
2. Клеменова И.А. Клинико-патогенетическая роль структурно-функциональной организации плазматических мембран при псориазе: Автореф. дис. д-р мед. наук. — М., 2008. — 40 с.
3. Крылов В.Н. Агафонов А.В., Кривцов Н.И., Лебедев В.И. и др. Теория и средства апитерапии. М.: Комильфо, 2007. — 296 с.
4. Крылов В.Н., Дерюгина А.В., Антипенко Е.А. Типовые изменения электрофоретической подвижности эритроцитов и их фосфолипидный состав при разных заболеваниях // Клиническая лабораторная диагностика. — 2009. — № 9. — С. 37—40.
5. Попов В.Г., Тополянский В.Г. Отек легких. М., 1975. — 60 с.
6. Преснухина Н.Г. Структурно-функциональное состояние эритроцитов при псориазе и КВЧ-воздействии: Автореф. дис. канд. биол. наук. — Н. Новгород, 2005. — 22 с.
дипломов


Оставить комментарий